1 . 钼酸钠(Na2MoO4)可与重金属盐产生沉淀,是目前应用较多的一种新型水处理剂。利用精钼矿 主要成分是MoS2,含少量PbS等
主要成分是MoS2,含少量PbS等 来制取钼酸钠晶体的工艺流程如下图所示。
来制取钼酸钠晶体的工艺流程如下图所示。

请回答下列问题:
⑴混合气A中含有一种大气污染物,其化学式为___________ 。
⑵焙烧的过程中采用如图1所示的“多层逆流焙烧”。
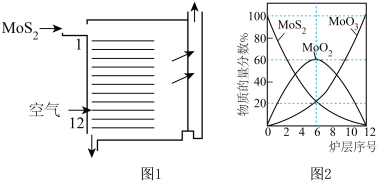
①多层逆流焙烧的优点是___________  任答两点
任答两点 。
。
②依据如图2,写出第6—12层MoO2参加反应的化学方程式___________ 。
⑶写出碱浸时发生反应的离子方程式___________ 。
⑷PbS与H2O2反应时,温度高于40℃后,反应速率反而减慢,原因是___________ 。
⑸流程图中“除SO42-”的过程中,当BaMoO4开始沉淀时,SO42-的去除率为97.0%,已知原Na2MoO4溶液中c(MoO42-)=0.48mol/L, c(SO42-)=0.040mol/L,Ksp(BaSO4) = 1.0×10-10,则Ksp(BaMoO4) =___________ 。 过程中溶液体积变化忽略不计
过程中溶液体积变化忽略不计
⑹锂和二硫化钼形成的二次电池的总反应为:xLi + nMoS2 Lix(MoS2)n,则电池放电时的正极反应式是
Lix(MoS2)n,则电池放电时的正极反应式是___________ 。
 主要成分是MoS2,含少量PbS等
主要成分是MoS2,含少量PbS等 来制取钼酸钠晶体的工艺流程如下图所示。
来制取钼酸钠晶体的工艺流程如下图所示。 
请回答下列问题:
⑴混合气A中含有一种大气污染物,其化学式为
⑵焙烧的过程中采用如图1所示的“多层逆流焙烧”。

①多层逆流焙烧的优点是
 任答两点
任答两点 。
。②依据如图2,写出第6—12层MoO2参加反应的化学方程式
⑶写出碱浸时发生反应的离子方程式
⑷PbS与H2O2反应时,温度高于40℃后,反应速率反而减慢,原因是
⑸流程图中“除SO42-”的过程中,当BaMoO4开始沉淀时,SO42-的去除率为97.0%,已知原Na2MoO4溶液中c(MoO42-)=0.48mol/L, c(SO42-)=0.040mol/L,Ksp(BaSO4) = 1.0×10-10,则Ksp(BaMoO4) =
 过程中溶液体积变化忽略不计
过程中溶液体积变化忽略不计
⑹锂和二硫化钼形成的二次电池的总反应为:xLi + nMoS2
 Lix(MoS2)n,则电池放电时的正极反应式是
Lix(MoS2)n,则电池放电时的正极反应式是
您最近一年使用:0次
解题方法
2 . 烟气中 和
和 的转化和综合利用既有利于节约资源,又有利于保护环境。
的转化和综合利用既有利于节约资源,又有利于保护环境。

 采用“联合脱硫脱氮技术”处理烟气
采用“联合脱硫脱氮技术”处理烟气 含
含 、
、 、
、 可获得含
可获得含 、
、 、
、 的副产品,工业流程如图1所示。
的副产品,工业流程如图1所示。
 反应釜 Ⅰ中
反应釜 Ⅰ中 与足量石灰乳反应的化学方程式为
与足量石灰乳反应的化学方程式为________ 。
 下列措施能提高各反应釜中气体去除率的有
下列措施能提高各反应釜中气体去除率的有 ________  填字母
填字母 。
。
A. 加快通入气体的速率
B. 采用气、液逆流的方式吸收气体
C. 吸收过程中定期补充吸收液
 反应釜 Ⅱ中
反应釜 Ⅱ中 转化为
转化为 反应的化学方程式为
反应的化学方程式为________ 。
 预处理器中发生的主要反应为
预处理器中发生的主要反应为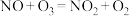 ,
,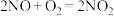 。室温下,固定进入预处理器的NO的物质的量,改变加入
。室温下,固定进入预处理器的NO的物质的量,改变加入 的物质的量,反应一段时间后体系中
的物质的量,反应一段时间后体系中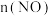 、
、 随反应前
随反应前 的变化如图2所示。当
的变化如图2所示。当 时,反应后
时,反应后 的物质的量减少,其原因是
的物质的量减少,其原因是__________________________________ 。
 研究表明:
研究表明: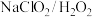 酸性复合吸收剂可同时有效脱硫、脱硝。图3所示为复合吸收剂组成一定时,温度对脱硫、脱硝的影响。
酸性复合吸收剂可同时有效脱硫、脱硝。图3所示为复合吸收剂组成一定时,温度对脱硫、脱硝的影响。
 温度高于60℃后,NO去除率下降的原因为
温度高于60℃后,NO去除率下降的原因为________ 。
 写出废气中的
写出废气中的 与
与 反应的离子方程式:
反应的离子方程式:________ 。
 和
和 的转化和综合利用既有利于节约资源,又有利于保护环境。
的转化和综合利用既有利于节约资源,又有利于保护环境。 
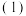 采用“联合脱硫脱氮技术”处理烟气
采用“联合脱硫脱氮技术”处理烟气 含
含 、
、 、
、 可获得含
可获得含 、
、 、
、 的副产品,工业流程如图1所示。
的副产品,工业流程如图1所示。  反应釜 Ⅰ中
反应釜 Ⅰ中 与足量石灰乳反应的化学方程式为
与足量石灰乳反应的化学方程式为 下列措施能提高各反应釜中气体去除率的有
下列措施能提高各反应釜中气体去除率的有  填字母
填字母 。
。 A. 加快通入气体的速率
B. 采用气、液逆流的方式吸收气体
C. 吸收过程中定期补充吸收液
 反应釜 Ⅱ中
反应釜 Ⅱ中 转化为
转化为 反应的化学方程式为
反应的化学方程式为 预处理器中发生的主要反应为
预处理器中发生的主要反应为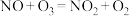 ,
,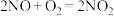 。室温下,固定进入预处理器的NO的物质的量,改变加入
。室温下,固定进入预处理器的NO的物质的量,改变加入 的物质的量,反应一段时间后体系中
的物质的量,反应一段时间后体系中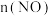 、
、 随反应前
随反应前 的变化如图2所示。当
的变化如图2所示。当 时,反应后
时,反应后 的物质的量减少,其原因是
的物质的量减少,其原因是 研究表明:
研究表明: 酸性复合吸收剂可同时有效脱硫、脱硝。图3所示为复合吸收剂组成一定时,温度对脱硫、脱硝的影响。
酸性复合吸收剂可同时有效脱硫、脱硝。图3所示为复合吸收剂组成一定时,温度对脱硫、脱硝的影响。  温度高于60℃后,NO去除率下降的原因为
温度高于60℃后,NO去除率下降的原因为 写出废气中的
写出废气中的 与
与 反应的离子方程式:
反应的离子方程式:
您最近一年使用:0次
解题方法
3 . 以硫铁矿(主要成分为 ,还有少量CuS、
,还有少量CuS、 等杂质)为原料制备绿矾晶体
等杂质)为原料制备绿矾晶体 的工艺流程如下:
的工艺流程如下:

(1)“酸浸”过程,矿渣中的 与稀
与稀 反应的离子方程式
反应的离子方程式_______________ 。
(2)烟气中的 会污染环境,可用足量氨水吸收,写出该反应的离子方程式
会污染环境,可用足量氨水吸收,写出该反应的离子方程式_____ 。
(3)滤液中金属阳离子的检验方法__________ 。
(4) 溶液制备绿矾晶体过程中要保持
溶液制备绿矾晶体过程中要保持 过量,理由
过量,理由______ 。(结合化学用语说明原因)
(5)燃料细菌脱硫法是用氧化亚铁硫杆菌 对硫铁矿进行催化脱硫,同时得到
对硫铁矿进行催化脱硫,同时得到 溶液。其过程如图所示:
溶液。其过程如图所示:
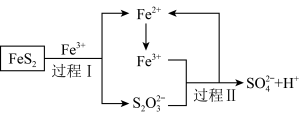
已知总反应为: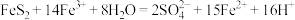
①将过程I离子方程式补充完整
____ FeS2+_____ Fe3++______ _______ =7Fe2++________ S2O32-+_____ _____
②过程II反应的离子方程式___________________________________ 。
(6)绿矾晶体在空气中易被氧化。取 样品,加水完全溶解,用酸化的
样品,加水完全溶解,用酸化的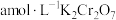 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。反应原理:
。反应原理: 。则绿矾晶体纯度的计算式为
。则绿矾晶体纯度的计算式为_______________ 。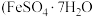 摩尔质量为
摩尔质量为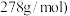
 ,还有少量CuS、
,还有少量CuS、 等杂质)为原料制备绿矾晶体
等杂质)为原料制备绿矾晶体 的工艺流程如下:
的工艺流程如下: 
(1)“酸浸”过程,矿渣中的
 与稀
与稀 反应的离子方程式
反应的离子方程式(2)烟气中的
 会污染环境,可用足量氨水吸收,写出该反应的离子方程式
会污染环境,可用足量氨水吸收,写出该反应的离子方程式(3)滤液中金属阳离子的检验方法
(4)
 溶液制备绿矾晶体过程中要保持
溶液制备绿矾晶体过程中要保持 过量,理由
过量,理由(5)燃料细菌脱硫法是用氧化亚铁硫杆菌
 对硫铁矿进行催化脱硫,同时得到
对硫铁矿进行催化脱硫,同时得到 溶液。其过程如图所示:
溶液。其过程如图所示: 
已知总反应为:
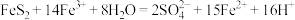
①将过程I离子方程式补充完整
②过程II反应的离子方程式
(6)绿矾晶体在空气中易被氧化。取
 样品,加水完全溶解,用酸化的
样品,加水完全溶解,用酸化的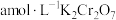 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。反应原理:
。反应原理: 。则绿矾晶体纯度的计算式为
。则绿矾晶体纯度的计算式为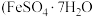 摩尔质量为
摩尔质量为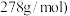
您最近一年使用:0次
解题方法
4 . “五水共治”是浙江治水的成功典范,其中含氮废水处理是污水治理的一个重要课题,图3是高含氰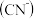 废水处理方案:
废水处理方案:

 高含氰废水可以通过电解法进行处理,阳极反应分两个阶段,第一阶段电极反应式:
高含氰废水可以通过电解法进行处理,阳极反应分两个阶段,第一阶段电极反应式: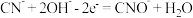 ,请写出第二阶段的电极反应式
,请写出第二阶段的电极反应式________ 。
 电解后低含氰废水通过化学氧化方法处理:在碱性条件下加入NaClO,将
电解后低含氰废水通过化学氧化方法处理:在碱性条件下加入NaClO,将 氧化为碳酸盐与对环境友好气体。请写出相关离子反应方程式
氧化为碳酸盐与对环境友好气体。请写出相关离子反应方程式________ 。
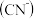 废水处理方案:
废水处理方案: 
 高含氰废水可以通过电解法进行处理,阳极反应分两个阶段,第一阶段电极反应式:
高含氰废水可以通过电解法进行处理,阳极反应分两个阶段,第一阶段电极反应式: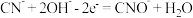 ,请写出第二阶段的电极反应式
,请写出第二阶段的电极反应式 电解后低含氰废水通过化学氧化方法处理:在碱性条件下加入NaClO,将
电解后低含氰废水通过化学氧化方法处理:在碱性条件下加入NaClO,将 氧化为碳酸盐与对环境友好气体。请写出相关离子反应方程式
氧化为碳酸盐与对环境友好气体。请写出相关离子反应方程式
您最近一年使用:0次
解题方法
5 .  是石油化学工业的一种重要催化剂,其中Ag起催化作用,
是石油化学工业的一种重要催化剂,其中Ag起催化作用,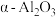 是载体且不溶于硝酸,该催化剂的回收实验如图1所示.其中的转化反应为:
是载体且不溶于硝酸,该催化剂的回收实验如图1所示.其中的转化反应为:

阅读上述实验流程,完成下列填空:
 加酸溶解应该选用装置
加酸溶解应该选用装置 图
图
______  选填a、b、
选填a、b、 .
.
 在实验操作
在实验操作 Ⅱ
Ⅱ ,如果用自来水代替蒸馏水进行洗涤,将会发生化学反应的离子方程式
,如果用自来水代替蒸馏水进行洗涤,将会发生化学反应的离子方程式 ______ .
 实验操作
实验操作 Ⅳ
Ⅳ 所需玻璃仪器为
所需玻璃仪器为 ______  填写三种
填写三种 .
.
 实验操作
实验操作 Ⅶ
Ⅶ 从
从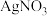 溶液获得
溶液获得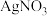 晶体需要进行的实验操作依次为:
晶体需要进行的实验操作依次为: ______  多选扣分
多选扣分 .
.
 蒸馏
蒸馏  蒸发
蒸发  灼烧
灼烧  冷却结晶
冷却结晶
 已知:
已知: ;
;

NO和 的混合气体的组成可表示为
的混合气体的组成可表示为 该混合气体通入NaOH溶液被完全吸收时,x的值为
该混合气体通入NaOH溶液被完全吸收时,x的值为 ______
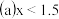
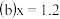

 已知
已知 中Ag的质量分数,若计算Ag的回收率,还必须知道的实验数据为
中Ag的质量分数,若计算Ag的回收率,还必须知道的实验数据为 ______ 和 ______ .
 是石油化学工业的一种重要催化剂,其中Ag起催化作用,
是石油化学工业的一种重要催化剂,其中Ag起催化作用,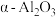 是载体且不溶于硝酸,该催化剂的回收实验如图1所示.其中的转化反应为:
是载体且不溶于硝酸,该催化剂的回收实验如图1所示.其中的转化反应为:

阅读上述实验流程,完成下列填空:
 加酸溶解应该选用装置
加酸溶解应该选用装置 图
图
 选填a、b、
选填a、b、 .
. 在实验操作
在实验操作 Ⅱ
Ⅱ ,如果用自来水代替蒸馏水进行洗涤,将会发生化学反应的离子方程式
,如果用自来水代替蒸馏水进行洗涤,将会发生化学反应的离子方程式  实验操作
实验操作 Ⅳ
Ⅳ 所需玻璃仪器为
所需玻璃仪器为  填写三种
填写三种 .
. 实验操作
实验操作 Ⅶ
Ⅶ 从
从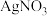 溶液获得
溶液获得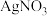 晶体需要进行的实验操作依次为:
晶体需要进行的实验操作依次为:  多选扣分
多选扣分 .
. 蒸馏
蒸馏  蒸发
蒸发 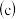 灼烧
灼烧 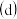 冷却结晶
冷却结晶  已知:
已知: ;
; 
NO和
 的混合气体的组成可表示为
的混合气体的组成可表示为 该混合气体通入NaOH溶液被完全吸收时,x的值为
该混合气体通入NaOH溶液被完全吸收时,x的值为 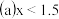
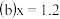

 已知
已知 中Ag的质量分数,若计算Ag的回收率,还必须知道的实验数据为
中Ag的质量分数,若计算Ag的回收率,还必须知道的实验数据为
您最近一年使用:0次
解题方法
6 . 高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示:
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:
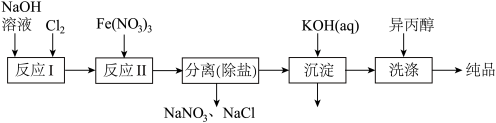
①洗涤粗品时选用异丙醇而不用水的理由是:________ 。
②反应II的离子方程式为___________ 。
③高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为_______ 它能净水的原因是_______ 。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。
①加入饱和KOH溶液的目的是:__________ 。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠____ (填“大”或“小”)。
(3)干法制备K2FeO4的反应中氧化剂和还原剂的物质的量之比________
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:

①洗涤粗品时选用异丙醇而不用水的理由是:
②反应II的离子方程式为
③高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。
①加入饱和KOH溶液的目的是:
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠
(3)干法制备K2FeO4的反应中氧化剂和还原剂的物质的量之比
您最近一年使用:0次
解题方法
7 . 碲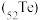 被誉为“国防与尖端技术的维生素”。工业上常用铜阳极泥(主要成分是
被誉为“国防与尖端技术的维生素”。工业上常用铜阳极泥(主要成分是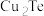 、含Ag、Au等杂质)为原料提取碲并回收金属,其工艺流程如下:
、含Ag、Au等杂质)为原料提取碲并回收金属,其工艺流程如下:
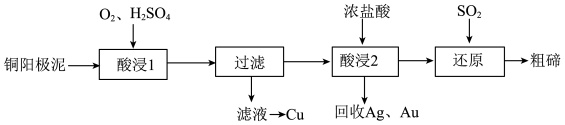
已知: 微溶于水,易与较浓的强酸、强碱反应。回答下列问题:
微溶于水,易与较浓的强酸、强碱反应。回答下列问题:
(1)已知Te为ⅥA族元素, 被浓NaOH溶液溶解,所生成盐的化学式为
被浓NaOH溶液溶解,所生成盐的化学式为________ 。
(2)“酸浸1”过程中,为加快浸出速率,可采取的方法有________ (填1种)。“酸浸2”时温度过高会使Te的浸出率降低,原因是________ 。
(3)“酸浸1”过程中,控制溶液的酸度使 转化为
转化为 ,反应的化学方程式为
,反应的化学方程式为________ ;“还原”过程中,发生反应的离子方程式为________ 。
(4)工业上也可用电解法从铜阳极泥中提取碲,方法是:将铜阳极泥在空气中焙烧使碲转化为 ,再用NaOH溶液碱浸,以石墨为电极电解所得溶液获得Te。电解过程中阴极上发生反应的电极方程式为
,再用NaOH溶液碱浸,以石墨为电极电解所得溶液获得Te。电解过程中阴极上发生反应的电极方程式为________ 。在阳极区溶液中检验出有 存在,生成
存在,生成 的原因是
的原因是________ 。
(5)常温下,向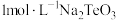 溶液中滴加盐酸,当溶液
溶液中滴加盐酸,当溶液 时,
时, ;
;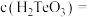
________ 。(已知: 的
的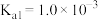
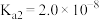 )
)
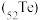 被誉为“国防与尖端技术的维生素”。工业上常用铜阳极泥(主要成分是
被誉为“国防与尖端技术的维生素”。工业上常用铜阳极泥(主要成分是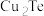 、含Ag、Au等杂质)为原料提取碲并回收金属,其工艺流程如下:
、含Ag、Au等杂质)为原料提取碲并回收金属,其工艺流程如下: 
已知:
 微溶于水,易与较浓的强酸、强碱反应。回答下列问题:
微溶于水,易与较浓的强酸、强碱反应。回答下列问题:(1)已知Te为ⅥA族元素,
 被浓NaOH溶液溶解,所生成盐的化学式为
被浓NaOH溶液溶解,所生成盐的化学式为(2)“酸浸1”过程中,为加快浸出速率,可采取的方法有
(3)“酸浸1”过程中,控制溶液的酸度使
 转化为
转化为 ,反应的化学方程式为
,反应的化学方程式为(4)工业上也可用电解法从铜阳极泥中提取碲,方法是:将铜阳极泥在空气中焙烧使碲转化为
 ,再用NaOH溶液碱浸,以石墨为电极电解所得溶液获得Te。电解过程中阴极上发生反应的电极方程式为
,再用NaOH溶液碱浸,以石墨为电极电解所得溶液获得Te。电解过程中阴极上发生反应的电极方程式为 存在,生成
存在,生成 的原因是
的原因是(5)常温下,向
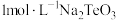 溶液中滴加盐酸,当溶液
溶液中滴加盐酸,当溶液 时,
时, ;
;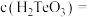
 的
的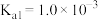
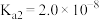 )
)
您最近一年使用:0次
8 . 铁及其化合物在生产、生活中具有广泛的用途。请回答下列问题:
(1)氰化物极毒, 可以消除含氰废液中的
可以消除含氰废液中的 ,其中
,其中 的电子式为
的电子式为________ 。
(2)碳酸亚铁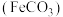 是一种重要的工业盐,外观为白色固体,潮湿空气中易被氧化。用硫铁矿烧渣
是一种重要的工业盐,外观为白色固体,潮湿空气中易被氧化。用硫铁矿烧渣 主要含
主要含 、
、 、少量
、少量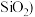 制备
制备 的工艺流程如下:
的工艺流程如下:
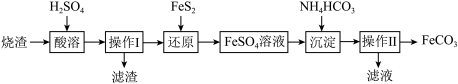
①“还原”时,发生反应的离子方程式为________ 。
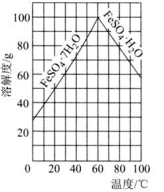
②FeSO4的溶解度曲线如图所示,欲获得 ,采用的实验操作是
,采用的实验操作是________ 。
③FeCO3在空气中煅烧可制备铁红,反应的化学方程式为________ 。
④“沉淀”步骤中 达到沉淀溶解平衡时,若
达到沉淀溶解平衡时,若
 ,欲使所得的
,欲使所得的 中不含有
中不含有 ,应调节溶液的pH不超过
,应调节溶液的pH不超过________  已知:
已知: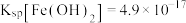 ,
,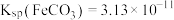 ,
, 。
。
(3)铁 镍电池结构、强度极好,循环寿命和工作寿命长。电池总反应为
镍电池结构、强度极好,循环寿命和工作寿命长。电池总反应为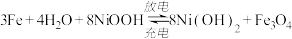 。写出放电时的负极反应式:
。写出放电时的负极反应式:________ 。
(4)化合物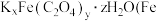 为
为 价
价 为亮绿色晶体,可用于晒制蓝图。其组成测定实验如下:
为亮绿色晶体,可用于晒制蓝图。其组成测定实验如下:
步骤Ⅰ:称取0.491g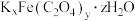 置于锥形瓶中,加足量蒸馏水和稀
置于锥形瓶中,加足量蒸馏水和稀 ;
;
步骤Ⅱ:用
 溶液进行滴定,恰好反应时消耗
溶液进行滴定,恰好反应时消耗 溶液
溶液 ;
;
步骤Ⅲ:再加入适当的还原剂,将 完全转化为
完全转化为 ,用
,用 溶液继续滴定,当
溶液继续滴定,当 完全氧化时,消耗溶液
完全氧化时,消耗溶液 溶液2.00mL。
溶液2.00mL。
①步骤Ⅰ中加足量稀 的目的是
的目的是________ 。
②该化合物的化学式为________ 。
(1)氰化物极毒,
 可以消除含氰废液中的
可以消除含氰废液中的 ,其中
,其中 的电子式为
的电子式为(2)碳酸亚铁
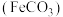 是一种重要的工业盐,外观为白色固体,潮湿空气中易被氧化。用硫铁矿烧渣
是一种重要的工业盐,外观为白色固体,潮湿空气中易被氧化。用硫铁矿烧渣 主要含
主要含 、
、 、少量
、少量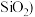 制备
制备 的工艺流程如下:
的工艺流程如下:
①“还原”时,发生反应的离子方程式为
②FeSO4的溶解度曲线如图所示,欲获得
 ,采用的实验操作是
,采用的实验操作是
③FeCO3在空气中煅烧可制备铁红,反应的化学方程式为
④“沉淀”步骤中
 达到沉淀溶解平衡时,若
达到沉淀溶解平衡时,若
 ,欲使所得的
,欲使所得的 中不含有
中不含有 ,应调节溶液的pH不超过
,应调节溶液的pH不超过 已知:
已知: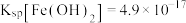 ,
,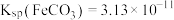 ,
, 。
。(3)铁
 镍电池结构、强度极好,循环寿命和工作寿命长。电池总反应为
镍电池结构、强度极好,循环寿命和工作寿命长。电池总反应为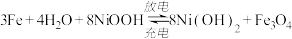 。写出放电时的负极反应式:
。写出放电时的负极反应式:(4)化合物
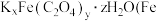 为
为 价
价 为亮绿色晶体,可用于晒制蓝图。其组成测定实验如下:
为亮绿色晶体,可用于晒制蓝图。其组成测定实验如下:步骤Ⅰ:称取0.491g
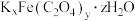 置于锥形瓶中,加足量蒸馏水和稀
置于锥形瓶中,加足量蒸馏水和稀 ;
;步骤Ⅱ:用

 溶液进行滴定,恰好反应时消耗
溶液进行滴定,恰好反应时消耗 溶液
溶液 ;
;步骤Ⅲ:再加入适当的还原剂,将
 完全转化为
完全转化为 ,用
,用 溶液继续滴定,当
溶液继续滴定,当 完全氧化时,消耗溶液
完全氧化时,消耗溶液 溶液2.00mL。
溶液2.00mL。①步骤Ⅰ中加足量稀
 的目的是
的目的是②该化合物的化学式为
您最近一年使用:0次
名校
解题方法
9 . 碲(52Te)被誉为“国防与尖端技术的维生素”。工业上常用铜阳极泥(主要成分是Cu2Te、含Ag、Au等杂质)为原料提取碲并回收金属,其工艺流程如下:

已知:TeO2微溶于水,易与较浓的强酸、强碱反应。回答下列问题:
(1)已知Te为VIA族元素,TeO2被浓NaOH溶液溶解,所生成盐的化学式为____________ 。
(2)“酸浸2”时温度过高会使Te的浸出率降低,原因是________________________ 。
(3)“酸浸1”过程中,控制溶液的酸度使Cu2Te转化为TeO2,反应的化学方程式为____________ ;
“还原”过程中,发生反应的离子方程式为_____________________________ 。
(4)工业上也可用电解法从铜阳极泥中提取碲,方法是:将铜阳极泥在空气中焙烧使碲转化为TeO2,再用NaOH溶液碱浸,以石墨为电极电解所得溶液获得Te。电解过程中阴极上发生反应的电极方程式为____________________ 。在阳极区溶液中检验出有TeO42-存在,生成TeO42-的原因是_____________________ 。
(5)常温下,向l mol·L-1 Na2TeO3溶液中滴加盐酸,当溶液pH=5时,c(TeO32-):c(H2TeO3)=__________ 。(已知:H2TeO3的Ka1=1.0×10-3 Ka2=2.0×10-8)

已知:TeO2微溶于水,易与较浓的强酸、强碱反应。回答下列问题:
(1)已知Te为VIA族元素,TeO2被浓NaOH溶液溶解,所生成盐的化学式为
(2)“酸浸2”时温度过高会使Te的浸出率降低,原因是
(3)“酸浸1”过程中,控制溶液的酸度使Cu2Te转化为TeO2,反应的化学方程式为
“还原”过程中,发生反应的离子方程式为
(4)工业上也可用电解法从铜阳极泥中提取碲,方法是:将铜阳极泥在空气中焙烧使碲转化为TeO2,再用NaOH溶液碱浸,以石墨为电极电解所得溶液获得Te。电解过程中阴极上发生反应的电极方程式为
(5)常温下,向l mol·L-1 Na2TeO3溶液中滴加盐酸,当溶液pH=5时,c(TeO32-):c(H2TeO3)=
您最近一年使用:0次
2020-01-24更新
|
459次组卷
|
3卷引用:江西省抚州市南城一中2020届高三上学期期末考试理综化学试题
名校
解题方法
10 . 制备锌印刷电路板是用稀硝酸腐蚀锌板,产生的废液称“烂板液”。“烂板液”中除含有硝酸锌外,还含有自来水带入的Cl-和Fe3+。在实验室里用“烂板液”制取znSO4·7H2O的过程如下:

(1)若稀硝酸腐蚀锌板时还原产物为NH4NO3,氧化剂与还原剂的物质的量之比是_________
(2)若步骤①的pH>12,则Zn(OH)2溶解生成四羟基合锌酸钠,写出Zn(OH)2被溶解的离子方程式_____________
(3)滤液D中除了含有OH-离子外,还含有的阴离子有_________ (填离子符号)。
(4)若滤液E的pH=4, c(Zn2+)=2mol/L,c(Fe3+)=2.6×10-9mol/L能求得的溶度积是____ (填选项)
A Ksp[Zn(OH)2] B Ksp[Zn(OH)2]和Ksp[Fe(OH)3] C Ksp[Fe(OH)3]
(5)已知:①Fe(OH)3 (s) Fe3+(aq)+3OH-(aq) △H=a kJ/mol
Fe3+(aq)+3OH-(aq) △H=a kJ/mol
②H2O (l) H+(aq)+ OH-(aq) △H=b kJ/mol
H+(aq)+ OH-(aq) △H=b kJ/mol
请写出Fe3+发生水解反应的热化学方程式___________
(6)若Fe(OH)3的溶度积常数为Ksp,H2O 的离子积常数为Kw ,Fe3+发生水解反应的平衡常数K=________ 。(用含Ksp、Kw的代数式表示)

(1)若稀硝酸腐蚀锌板时还原产物为NH4NO3,氧化剂与还原剂的物质的量之比是
(2)若步骤①的pH>12,则Zn(OH)2溶解生成四羟基合锌酸钠,写出Zn(OH)2被溶解的离子方程式
(3)滤液D中除了含有OH-离子外,还含有的阴离子有
(4)若滤液E的pH=4, c(Zn2+)=2mol/L,c(Fe3+)=2.6×10-9mol/L能求得的溶度积是
A Ksp[Zn(OH)2] B Ksp[Zn(OH)2]和Ksp[Fe(OH)3] C Ksp[Fe(OH)3]
(5)已知:①Fe(OH)3 (s)
 Fe3+(aq)+3OH-(aq) △H=a kJ/mol
Fe3+(aq)+3OH-(aq) △H=a kJ/mol②H2O (l)
 H+(aq)+ OH-(aq) △H=b kJ/mol
H+(aq)+ OH-(aq) △H=b kJ/mol请写出Fe3+发生水解反应的热化学方程式
(6)若Fe(OH)3的溶度积常数为Ksp,H2O 的离子积常数为Kw ,Fe3+发生水解反应的平衡常数K=
您最近一年使用:0次
2020-01-21更新
|
349次组卷
|
5卷引用:湖北省荆州中学、宜昌一中等“荆、荆、襄、宜四地七校2020届高三上学期期末考试理综化学试题
湖北省荆州中学、宜昌一中等“荆、荆、襄、宜四地七校2020届高三上学期期末考试理综化学试题山西省临汾市2020届高三第一次模拟理综化学试题(已下线)专题七 工艺流程题(提分特训)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训(已下线)考点17 化工生产诸要素及流程图分析-2020年高考化学命题预测与模拟试题分类精编(已下线)第八章 水溶液中的离子反应与平衡 第54练 水溶液中四大平衡常数的综合应用



