解题方法
1 . 海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。

请回答下列问题:
(1)步骤I中,粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,粗盐精制过程中要使用Na2CO3溶液,请写出加入Na2CO3溶液后相关化学反应的离子方程式:__ 。
(2)海水提溴,制得1molBr2需要消耗__ molCl2。步骤Ⅱ中需要向母液中加入稀硫酸酸化,其作用是___ 。步骤Ⅱ若用Na2SO3水溶液吸收Br2,有关反应的离子方程式为___ 。
(3)判断Mg(OH)2是否洗涤干净的操作是___ 。

请回答下列问题:
(1)步骤I中,粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,粗盐精制过程中要使用Na2CO3溶液,请写出加入Na2CO3溶液后相关化学反应的离子方程式:
(2)海水提溴,制得1molBr2需要消耗
(3)判断Mg(OH)2是否洗涤干净的操作是
您最近一年使用:0次
名校
解题方法
2 . 随着工农业发展,NH4Cl的价格低迷、需求降低导致利用“侯氏制碱法”生产的碱厂出现亏损。“新联合制碱法”应运而生,流程如下:
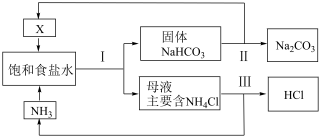
(1)写出气体X的结构式_______________________ 。
(2)上述工艺流程中参与循环使用的气体有____________ 、____________ 。
(3)所得产品Na2CO3中不会含有NH4Cl,原因是__________________ (用化学方程式表示)。
(4)过程III以MgO为催化剂进行转化,示意图如下:

①步骤ii实际上要经过加热和高温两步反应,“加热”步骤制得HCl,“高温”步骤得到MgO,其化学方程式分别为__________________ 、________ 。
②过程III分两步得到NH3和HCl,比一步得到NH3和HCl的好处是________________ 。

(1)写出气体X的结构式
(2)上述工艺流程中参与循环使用的气体有
(3)所得产品Na2CO3中不会含有NH4Cl,原因是
(4)过程III以MgO为催化剂进行转化,示意图如下:

①步骤ii实际上要经过加热和高温两步反应,“加热”步骤制得HCl,“高温”步骤得到MgO,其化学方程式分别为
②过程III分两步得到NH3和HCl,比一步得到NH3和HCl的好处是
您最近一年使用:0次
2019-11-25更新
|
138次组卷
|
3卷引用:江西省2020届高三第一次大联考化学试题
江西省2020届高三第一次大联考化学试题(已下线)考点15 金属元素及其化合物-2020年高考化学命题预测与模拟试题分类精编江西省景德镇市浮梁县第一中学2020-2021学年高二下学期5月月考化学试题(争优部1、2班)
解题方法
3 . 火电厂粉煤灰的主要成分为SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2等。某研究小组对其进行综合处理的流程如图所示:

已知:①“酸浸”后钛主要以TiOSO4的形式存在,强电解质TiOSO4在溶液中仅能电离出SO42-和TiO2+,TiO2+在80℃左右水解生成TiO2·xH2O。
②已知FeSO4在不同温度下的溶解度和析出晶体的组成如下表:
回答下列问题:
(1)加快“酸浸”速率的措施有哪些?写出一条即可___ ,滤渣1的主要成分为___ (填化学式)。
(2)“反应”时加入铁粉的作用为___ (用离子方程式表示)。
(3)“结晶”时,若要获得FeSO4·7H2O,则对溶液进行的操作是:蒸发浓缩,___ ,过滤,洗涤,干燥。
(4)“水解”反应的离子方程式为____ 。
(5)实验室用MgCl2·6H2O制备MgCl2固体,在加热的同时要不断通入___ (填化学式,下同)若不通入该物质,最终得到的产物中可能含有___ 。

已知:①“酸浸”后钛主要以TiOSO4的形式存在,强电解质TiOSO4在溶液中仅能电离出SO42-和TiO2+,TiO2+在80℃左右水解生成TiO2·xH2O。
②已知FeSO4在不同温度下的溶解度和析出晶体的组成如下表:
温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 |
溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 |
析出晶体 | FeSO4·7H2O | FeSO4·4H2O | FeSO4·H2O | |||||||
(1)加快“酸浸”速率的措施有哪些?写出一条即可
(2)“反应”时加入铁粉的作用为
(3)“结晶”时,若要获得FeSO4·7H2O,则对溶液进行的操作是:蒸发浓缩,
(4)“水解”反应的离子方程式为
(5)实验室用MgCl2·6H2O制备MgCl2固体,在加热的同时要不断通入
您最近一年使用:0次
名校
解题方法
4 . 高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:

已知:①2KOH+Cl2=KCl+KClO+H2O(条件:温度较低)
②6KOH+3Cl2=5KCl+KClO3+3H2O(条件:温度较高)
③K2FeO4在水溶液中易水解:4 +10H2O⇌4Fe(OH)3(胶体)+8OH-+3O2↑
+10H2O⇌4Fe(OH)3(胶体)+8OH-+3O2↑
回答下列问题:实验室可利用如图装置完成流程①和②

(1)写出工业上制取Cl2的化学方程式___________ ;两水槽中的水为___________ (填“热水”或“冷水”)。
(2)反应一段时间后,停止通氯气,再往仪器a中加入浓KOH溶液的目的是___________ ;
A.为下一步反应提供碱性的环境
B.使KClO3转化为 KClO
C.与溶液I中过量的Cl2继续反应,生成更多的KClO
D.KOH固体溶解时会放出较多的热量,有利于提高反应速率
(3)从溶液Ⅱ中分离出 K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子方程式为:___________ 。
(4)用重结晶法提纯粗产品:将粗产品先用KOH稀溶液溶解,再加入饱和的KOH溶液,冷却结晶,过滤,用少量异丙醇洗涤,最后低温真空干燥。
①洗涤粗品时选用异丙醇而不用水的理由是___________ 。
②如何判断 K2FeO4 晶体已经洗涤干净___________ 。
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图,电解过程中阳极的电极反应式为___________ 。

(6) 在水溶液中的存在形态如图所示。下列说法正确的是
在水溶液中的存在形态如图所示。下列说法正确的是___________ 。

A.不论溶液的酸碱性如何变化,铁元素都有4 种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,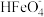 的分布分数逐渐增大
的分布分数逐渐增大
C.向pH=6 的这种溶液中加KOH溶液,发生反应的离子方程式为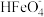 +OH-=
+OH-= +H2O
+H2O

已知:①2KOH+Cl2=KCl+KClO+H2O(条件:温度较低)
②6KOH+3Cl2=5KCl+KClO3+3H2O(条件:温度较高)
③K2FeO4在水溶液中易水解:4
 +10H2O⇌4Fe(OH)3(胶体)+8OH-+3O2↑
+10H2O⇌4Fe(OH)3(胶体)+8OH-+3O2↑回答下列问题:实验室可利用如图装置完成流程①和②

(1)写出工业上制取Cl2的化学方程式
(2)反应一段时间后,停止通氯气,再往仪器a中加入浓KOH溶液的目的是
A.为下一步反应提供碱性的环境
B.使KClO3转化为 KClO
C.与溶液I中过量的Cl2继续反应,生成更多的KClO
D.KOH固体溶解时会放出较多的热量,有利于提高反应速率
(3)从溶液Ⅱ中分离出 K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子方程式为:
(4)用重结晶法提纯粗产品:将粗产品先用KOH稀溶液溶解,再加入饱和的KOH溶液,冷却结晶,过滤,用少量异丙醇洗涤,最后低温真空干燥。
①洗涤粗品时选用异丙醇而不用水的理由是
②如何判断 K2FeO4 晶体已经洗涤干净
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图,电解过程中阳极的电极反应式为

(6)
 在水溶液中的存在形态如图所示。下列说法正确的是
在水溶液中的存在形态如图所示。下列说法正确的是
A.不论溶液的酸碱性如何变化,铁元素都有4 种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,
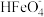 的分布分数逐渐增大
的分布分数逐渐增大C.向pH=6 的这种溶液中加KOH溶液,发生反应的离子方程式为
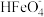 +OH-=
+OH-= +H2O
+H2O
您最近一年使用:0次
名校
解题方法
5 . 海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

(1)步骤③的实验操作名称是______ 。
(2)为检验提取碘后的水溶液中是否还含有单质碘,可选择的试剂是:_____ 。
(3)步骤④反应中能生成可溶性的Mn2+,写出该反应的离子方程式:_____ 。

(1)步骤③的实验操作名称是
(2)为检验提取碘后的水溶液中是否还含有单质碘,可选择的试剂是:
(3)步骤④反应中能生成可溶性的Mn2+,写出该反应的离子方程式:
您最近一年使用:0次
2019-11-13更新
|
189次组卷
|
2卷引用:江苏省淮安市马坝高级中学2019-2020学年高二上学期期中考试化学(必修)试题
18-19高二·浙江·期中
解题方法
6 . 铝及其化合物在工业生产中有广泛用途,工业上可用铝土矿(主要成分为 ,含
,含 、
、 等杂质)为原料冶炼铝的工艺流程如下:
等杂质)为原料冶炼铝的工艺流程如下:

已知:溶液中的 与
与 反应,能生成硅铝酸盐沉淀,化学反应方程式为:
反应,能生成硅铝酸盐沉淀,化学反应方程式为:

请回答下列问题:
(1)试剂X为___________________ 。
(2)向铝土矿中加入试剂X的操作中主要成分发生的离子方程式_______________________________ 。反应Ⅰ过滤所得沉淀主要成分为_________________________________________ 。
(3)反应II中生成 的离子方程式为
的离子方程式为_________________________________________ 。
(4)氮化铝具有耐高温、抗冲击、导热性好等优良性质,广泛应用于电子工业、陶瓷工业等领域。相关反应的热化学方程式如下:






在一定条件下,氧化铝制备氮化铝的热化学方程式为____________________________________ 。
(5)一种可超快充电的新型铝电池,充放电时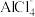 和
和 两种离子在Al电极上相互转化,其他离子不参与电极反应。放电时负极Al的电极反应式为
两种离子在Al电极上相互转化,其他离子不参与电极反应。放电时负极Al的电极反应式为____________________________________ 。
 ,含
,含 、
、 等杂质)为原料冶炼铝的工艺流程如下:
等杂质)为原料冶炼铝的工艺流程如下:
已知:溶液中的
 与
与 反应,能生成硅铝酸盐沉淀,化学反应方程式为:
反应,能生成硅铝酸盐沉淀,化学反应方程式为:
请回答下列问题:
(1)试剂X为
(2)向铝土矿中加入试剂X的操作中主要成分发生的离子方程式
(3)反应II中生成
 的离子方程式为
的离子方程式为(4)氮化铝具有耐高温、抗冲击、导热性好等优良性质,广泛应用于电子工业、陶瓷工业等领域。相关反应的热化学方程式如下:






在一定条件下,氧化铝制备氮化铝的热化学方程式为
(5)一种可超快充电的新型铝电池,充放电时
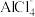 和
和 两种离子在Al电极上相互转化,其他离子不参与电极反应。放电时负极Al的电极反应式为
两种离子在Al电极上相互转化,其他离子不参与电极反应。放电时负极Al的电极反应式为
您最近一年使用:0次
18-19高三·浙江·期末
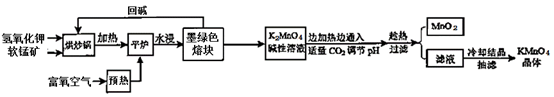
7 . 高锰酸钾(KMnO4)是常用的氧化剂。以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体的操作流程如下:
相关资料:①物质溶解度
②锰酸钾[K2MnO4]
外观性状:墨绿色结晶。其水溶液呈深绿色,这是锰酸根(MnO42-)的特征颜色。
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性中,MnO42-会发生岐化反应。
试回答下列问题:
(1)烘炒前,混配KOH和软锰矿固体,将软锰矿粉碎,其作用是_____ ,上述流程中趁热过滤的目的是___ 。
(2)请写出实验中通入适量CO2时体系中可能发生反应的离子方程式:____ 。
(3)下列有关上述流程及操作说法正确的是_____ 。
A. 平炉中发生的反应中MnO2的作用是氧化剂
B. 流程中CO2用醋酸溶液代替,得到的产品纯度更高,而不能用盐酸和硫酸代替
C. 抽滤前,应先将滤纸放入布氏漏斗中,微开水龙头,使滤纸紧贴漏斗的瓷板上
D. 抽滤完毕,先断开水泵与吸滤瓶间的橡皮管,然后关闭水龙头
(4)洗涤KMnO4晶体最好的试剂是______ 。
A. 无水乙醇 B. 乙醇水溶液 C. 氢氧化钾溶液 D. 冷水
(5)晶体干燥时,温度控制在80℃为宜,温度不宜过高的理由是___ 。
相关资料:①物质溶解度

②锰酸钾[K2MnO4]
外观性状:墨绿色结晶。其水溶液呈深绿色,这是锰酸根(MnO42-)的特征颜色。
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性中,MnO42-会发生岐化反应。
试回答下列问题:
(1)烘炒前,混配KOH和软锰矿固体,将软锰矿粉碎,其作用是
(2)请写出实验中通入适量CO2时体系中可能发生反应的离子方程式:
(3)下列有关上述流程及操作说法正确的是
A. 平炉中发生的反应中MnO2的作用是氧化剂
B. 流程中CO2用醋酸溶液代替,得到的产品纯度更高,而不能用盐酸和硫酸代替
C. 抽滤前,应先将滤纸放入布氏漏斗中,微开水龙头,使滤纸紧贴漏斗的瓷板上
D. 抽滤完毕,先断开水泵与吸滤瓶间的橡皮管,然后关闭水龙头
(4)洗涤KMnO4晶体最好的试剂是
A. 无水乙醇 B. 乙醇水溶液 C. 氢氧化钾溶液 D. 冷水
(5)晶体干燥时,温度控制在80℃为宜,温度不宜过高的理由是
您最近一年使用:0次
解题方法
8 . KIO3是一种重要的无机化合物,可作为食盐中的补碘剂,常见制备方法如下。
(1)氯酸钾氧化法:化学反应方程式为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2,每生成3mol KH(IO3)2,反应中转移的电子数为___ ,向反应后溶液中加_______ 溶液得到KIO3。
(2)KIO3也可采用“电解法”制备,装置如图所示。
①写出电解时阴极的电极反应式__________ 。
②电解过程中通过阳离子交换膜的离子主要为_____ ,其迁移方向是_______ (用A、B表示)。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有_______ (写出一点)。
(3)一种由含碘废水制取碘酸钾的工艺如图:
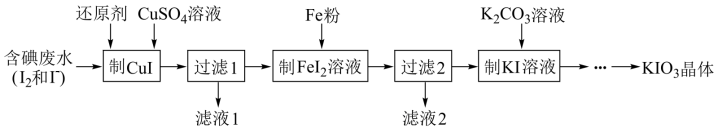
①进行“过滤1”时,需同时对CuI沉淀进行洗涤。在洗涤液中可通过滴加____ 盐溶液来检验其是否已洗涤干净。
②“制FeI2”时,发生反应的化学方程式为_________ 。
(4)山东省已下调食用盐碘含量标准每千克盐含碘25毫克(波动范围为18~33mg•kg-1)。测定食盐试样中碘元素含量的步骤如下:称取4.000g市售食盐加入锥形瓶中,依次加入适量的水、稍过量KI及稀硫酸;充分反应后,再加入12.00mL6.000×10-4mol•L-1Na2S2O3溶液,与生成的碘恰好完全反应。有关反应原理为:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O32-=2I-+S4O62-。计算该食盐试样中碘元素的含量____ mg•kg-1。
(1)氯酸钾氧化法:化学反应方程式为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2,每生成3mol KH(IO3)2,反应中转移的电子数为
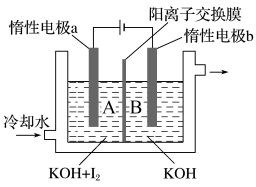
(2)KIO3也可采用“电解法”制备,装置如图所示。
①写出电解时阴极的电极反应式
②电解过程中通过阳离子交换膜的离子主要为
③与“电解法”相比,“KClO3氧化法”的主要不足之处有
(3)一种由含碘废水制取碘酸钾的工艺如图:

①进行“过滤1”时,需同时对CuI沉淀进行洗涤。在洗涤液中可通过滴加
②“制FeI2”时,发生反应的化学方程式为
(4)山东省已下调食用盐碘含量标准每千克盐含碘25毫克(波动范围为18~33mg•kg-1)。测定食盐试样中碘元素含量的步骤如下:称取4.000g市售食盐加入锥形瓶中,依次加入适量的水、稍过量KI及稀硫酸;充分反应后,再加入12.00mL6.000×10-4mol•L-1Na2S2O3溶液,与生成的碘恰好完全反应。有关反应原理为:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O32-=2I-+S4O62-。计算该食盐试样中碘元素的含量
您最近一年使用:0次
名校
解题方法
9 . 钴铁氧体(CoFe2O4)不仅是重要的磁性材料、磁致伸缩材料,还是重要的锂离子电池负极材料。工业上,可以由废旧锂钴电池正极材料(主要含Fe、Al、硅等杂质)回收钴,再用电化学法制得CoFe2O4。其流程如图所示(过程中所加试剂均足量)
Ⅰ.废旧电池中钴的回收

(1)含铝滤液中,铝元素的存在形式为________ (写化学式);硅在过程_____ (填序号)与钴分离。
(2)写出过程②中LiCoO2与H2O2发生反应的化学方程式____________________________ 。
(3)过程③Na2CO3的主要作用为________________________________________ 。
Ⅱ.电解法制得钴铁合金
(4)配制 0.050mol⋅L-1 FeSO4和0.025mol⋅L-1 CoSO4的混合溶液,用铜作阴极、石墨作阳极进行电解,获得CoFe2合金。阴极的电极方程式为____________________________________ 。
Ⅲ.阳极氧化法制得钴铁氧体
(5)以1.500mol⋅L−1NaOH溶液作电解液,纯净的钴铁合金(CoFe2)作阳极进行电解,在阳极上获得CoFe2O4薄膜。该电解过程的化学方程式为_________________________ 。
(6)当电路上有0.4mol电子转移时,阳极电极材料增重质量为3.4g,与理论值不符,其原因可能为______________________________________________ 。
(7)由废旧锂钴电池制CoFe2O4的现实意义在于:______________________ (写一条即可)。
Ⅰ.废旧电池中钴的回收

(1)含铝滤液中,铝元素的存在形式为
(2)写出过程②中LiCoO2与H2O2发生反应的化学方程式
(3)过程③Na2CO3的主要作用为
Ⅱ.电解法制得钴铁合金
(4)配制 0.050mol⋅L-1 FeSO4和0.025mol⋅L-1 CoSO4的混合溶液,用铜作阴极、石墨作阳极进行电解,获得CoFe2合金。阴极的电极方程式为
Ⅲ.阳极氧化法制得钴铁氧体
(5)以1.500mol⋅L−1NaOH溶液作电解液,纯净的钴铁合金(CoFe2)作阳极进行电解,在阳极上获得CoFe2O4薄膜。该电解过程的化学方程式为
(6)当电路上有0.4mol电子转移时,阳极电极材料增重质量为3.4g,与理论值不符,其原因可能为
(7)由废旧锂钴电池制CoFe2O4的现实意义在于:
您最近一年使用:0次
2019-10-29更新
|
316次组卷
|
3卷引用:江西省临川一中2020届上学期第二次联合考试化学试题
解题方法
10 . 我国由海水提取的食盐(海盐)不足四成,大部分产自内陆盐湖(湖盐)和盐矿(矿盐)。
(1)由内陆盐湖水为原料进行晒盐,有“夏天采盐(食盐)、冬天捞硝(芒硝)”的说法,下列对其化学原理的描述正确的是___ (选填编号)。
a.由夏到冬,芒硝的溶解度变小
b.由冬到夏,氯化钠的溶解度变小
c.夏天温度高,氯化钠易结晶析出
(2)芒硝型矿盐卤水中含有一定量Na2SO4和少量Ca2+、Mg2+、H2S等杂质,利用硫酸钙微溶于水的性质,用石灰-烟道气(CO2)法净化芒硝型矿盐卤水的流程如图:

脱硫工序中先吹空气,发生物理和化学变化:物理变化是氢硫酸有挥发性,部分被直接吹出,化学变化是___ (用化学方程式表示)。再加入稍过量的FeCl3溶液除去残留的硫化氢。检验FeCl3已经过量的试剂是___ (填写化学式)。
(3)加入Ca(OH)2能降低芒硝浓度并生成烧碱,同时除去Fe3+,另一目的是___ 。滤渣A的主要成分除了Fe(OH)3外,还有___ (填写化学式)。
(4)如图所示是石灰-纯碱法净化芒硝型矿盐卤水的部分流程:加入纯碱的作用是___ (选填编号)。
a.调节溶液的pH b.除去溶液中的Ca2+
c.除去溶液中的Mg2+ d.除去溶液中的SO42―
石灰-烟道气法与石灰-纯碱法相比较,石灰-烟道气法的优点是___ 。

(5)如图是离子交换膜法电解食盐水的示意图,离子交换膜只允许阳离子通过,上述精盐水需要进行二次精制后才能作为离子交换膜电解槽的原料。对盐水进行二次精制的目的是___ (选填编号)。
a.进一步降低Ca2+、Mg2+的浓度,提高烧碱纯度
b.进一步降低SO42―的浓度,提高烧碱纯度
c.防止杂质离子与碱生成的沉淀堵塞离子交换膜
d.防止溶液酸性或碱性过强,腐蚀离子交换膜
盐水中硫酸根浓度过高会使生成的氯气中混有氧气,检验氯气中是否含有少量氧气的操作是___ 。

(1)由内陆盐湖水为原料进行晒盐,有“夏天采盐(食盐)、冬天捞硝(芒硝)”的说法,下列对其化学原理的描述正确的是
a.由夏到冬,芒硝的溶解度变小
b.由冬到夏,氯化钠的溶解度变小
c.夏天温度高,氯化钠易结晶析出
(2)芒硝型矿盐卤水中含有一定量Na2SO4和少量Ca2+、Mg2+、H2S等杂质,利用硫酸钙微溶于水的性质,用石灰-烟道气(CO2)法净化芒硝型矿盐卤水的流程如图:

脱硫工序中先吹空气,发生物理和化学变化:物理变化是氢硫酸有挥发性,部分被直接吹出,化学变化是
(3)加入Ca(OH)2能降低芒硝浓度并生成烧碱,同时除去Fe3+,另一目的是
(4)如图所示是石灰-纯碱法净化芒硝型矿盐卤水的部分流程:加入纯碱的作用是
a.调节溶液的pH b.除去溶液中的Ca2+
c.除去溶液中的Mg2+ d.除去溶液中的SO42―
石灰-烟道气法与石灰-纯碱法相比较,石灰-烟道气法的优点是

(5)如图是离子交换膜法电解食盐水的示意图,离子交换膜只允许阳离子通过,上述精盐水需要进行二次精制后才能作为离子交换膜电解槽的原料。对盐水进行二次精制的目的是
a.进一步降低Ca2+、Mg2+的浓度,提高烧碱纯度
b.进一步降低SO42―的浓度,提高烧碱纯度
c.防止杂质离子与碱生成的沉淀堵塞离子交换膜
d.防止溶液酸性或碱性过强,腐蚀离子交换膜
盐水中硫酸根浓度过高会使生成的氯气中混有氧气,检验氯气中是否含有少量氧气的操作是

您最近一年使用:0次



