常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。

(1)石墨中化学键类型为______________ ,在电池中的作用为_________________
(2) 酸性锌锰干电池的负极反应为_________________________
(3) 碱性锌锰干电池在放电过程产生MnOOH,写出正极反应式_____________
(4)填充物用60℃温水溶解,目的是_____________________ 。
(5)操作A的名称为______________ 。
(6)铜帽溶解时加入H2O2的目的是_______________________ (用化学方程式表示)

(1)石墨中化学键类型为
(2) 酸性锌锰干电池的负极反应为
(3) 碱性锌锰干电池在放电过程产生MnOOH,写出正极反应式
(4)填充物用60℃温水溶解,目的是
(5)操作A的名称为
(6)铜帽溶解时加入H2O2的目的是
18-19高一下·江西南昌·阶段练习 查看更多[4]
江苏省宿迁市泗阳县实验高级中学2021-2022学年高一下学期第二次质量调研化学试题人教版2019必修第二册 第六章 第一节 第3课时 化学电池(已下线)【南昌新东方】2019 南昌二中 高一下 第二次月考【全国百强校】江西省南昌市第二中学2018-2019学年高一下学期第二次月考化学试题
更新时间:2019-05-17 09:14:04
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】I.完成下列问题:

(1)若A为Zn,B为Cu,溶液C为硫酸溶液,则正极上发生的电极反应式:____ ,溶液中SO 移向
移向____ (填“正极”或“负极”)。
(2)若导线上转移电子lmol,则消耗Zn____ g。
(3)若A为Al,B为Mg,溶液C为氢氧化钠溶液,则正极是____ (填“Mg”或“Al”)。该反应负极的电极反应式为____ 。
II.已知12g石墨转变为12g金刚石需吸收能量。
(4)①上述变化属于____ (填“物理”或“化学”)变化。
②常温常压下,石墨与金刚石更稳定的是____ 。
(5)如图是反应H2(g)+I2(g) 2HI(g))过程中的能量变化图。由图可知,反应物断键吸收的总能量
2HI(g))过程中的能量变化图。由图可知,反应物断键吸收的总能量____ (填“>”、“<”或“=”)生成物成键放出的总键能。


(1)若A为Zn,B为Cu,溶液C为硫酸溶液,则正极上发生的电极反应式:
 移向
移向(2)若导线上转移电子lmol,则消耗Zn
(3)若A为Al,B为Mg,溶液C为氢氧化钠溶液,则正极是
II.已知12g石墨转变为12g金刚石需吸收能量。
(4)①上述变化属于
②常温常压下,石墨与金刚石更稳定的是
(5)如图是反应H2(g)+I2(g)
 2HI(g))过程中的能量变化图。由图可知,反应物断键吸收的总能量
2HI(g))过程中的能量变化图。由图可知,反应物断键吸收的总能量
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】某小组探究Cu和H2O2的反应的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
【实验探究】
实验i:向装有0.5g Cu的烧杯中加入20mL30% H2O2溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
(1)①写出该反应的化学方程式:_______ 。
②电极反应式:
ⅰ.氧化反应:_______ 。
ⅱ.还原反应: H2O2+ 2e- = 2OH-
【继续探究】
针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
(2)实验ii中:溶液变蓝的原因是_______ (用化学方程式表示)。
(3)对比实验i和iii,为探究浓氨水对Cu的还原性或H2O2氧化性的影响,该同学利用下图装置继续实验。
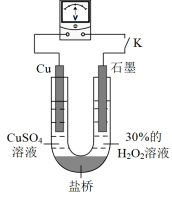
已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。
a.K闭合时,电压为x。
b.向U型管右侧溶液中滴加浓氨水后,电压减小了y。
c.继续向U型管左侧溶液中滴加浓氨水后,电压增大了z。
①从电极反应角度解释产生现象c的原因:_______ 。
②利用该方法也可证明酸性增强可提高H2O2的氧化性,具体实验操作及现象是_______ 。
(4)总结:物质氧化性和还原性变化的一般规律是_______ 。
【实验探究】
实验i:向装有0.5g Cu的烧杯中加入20mL30% H2O2溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
(1)①写出该反应的化学方程式:
②电极反应式:
ⅰ.氧化反应:
ⅱ.还原反应: H2O2+ 2e- = 2OH-
【继续探究】
针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
| 装置 | 序号 | 试剂a | 现象 |
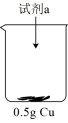 | ii | 20mL30% H2O2与4mL5mol/L H2SO4混合液 | Cu表面很快生产少量气泡,溶液逐渐变蓝,产生较多气泡 |
| iii | 20mL30% H2O2与4mL5mol/L氨水混合液 | 溶液立即变为深蓝色,产生大量气泡,Cu表面有少量蓝色不溶物 |
(3)对比实验i和iii,为探究浓氨水对Cu的还原性或H2O2氧化性的影响,该同学利用下图装置继续实验。

已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。
a.K闭合时,电压为x。
b.向U型管右侧溶液中滴加浓氨水后,电压减小了y。
c.继续向U型管左侧溶液中滴加浓氨水后,电压增大了z。
①从电极反应角度解释产生现象c的原因:
②利用该方法也可证明酸性增强可提高H2O2的氧化性,具体实验操作及现象是
(4)总结:物质氧化性和还原性变化的一般规律是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】工业上由黄铜矿(主要成分 )冶炼铜的主要流程如下:
)冶炼铜的主要流程如下:

(1)冰铜中的 在高温下也能被氧化成
在高温下也能被氧化成 和气体A,该反应的化学方程式是
和气体A,该反应的化学方程式是___________ 。
(2)下列处理气体A的方法,不合理的是___________ 。
a.高空排放 b.用纯碱溶液吸收制备亚硫酸钠
c.用氨水吸收后,再经氧化制备硫酸铵 d.用 溶液吸收制备
溶液吸收制备
(3)用稀 浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在
浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在___________ (填离子符号)。
(4)由泡铜冶炼粗铜的化学反应方程式为___________ 。
(5)利用反应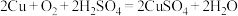 可制备
可制备 ,若将该反应设计为原电池,其负极电极反应式为
,若将该反应设计为原电池,其负极电极反应式为___________ 。
(6)取一定量的泡铜,加入1 L 0.6 mol⋅L-1 溶液恰好完全溶解,同时放出2240 mL NO气体(标准状况),另取等量的泡铜,用足量的
溶液恰好完全溶解,同时放出2240 mL NO气体(标准状况),另取等量的泡铜,用足量的 还原,得到的铜的质量为
还原,得到的铜的质量为___________ g。
 )冶炼铜的主要流程如下:
)冶炼铜的主要流程如下:
(1)冰铜中的
 在高温下也能被氧化成
在高温下也能被氧化成 和气体A,该反应的化学方程式是
和气体A,该反应的化学方程式是(2)下列处理气体A的方法,不合理的是
a.高空排放 b.用纯碱溶液吸收制备亚硫酸钠
c.用氨水吸收后,再经氧化制备硫酸铵 d.用
 溶液吸收制备
溶液吸收制备
(3)用稀
 浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在
浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在(4)由泡铜冶炼粗铜的化学反应方程式为
(5)利用反应
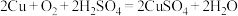 可制备
可制备 ,若将该反应设计为原电池,其负极电极反应式为
,若将该反应设计为原电池,其负极电极反应式为(6)取一定量的泡铜,加入1 L 0.6 mol⋅L-1
 溶液恰好完全溶解,同时放出2240 mL NO气体(标准状况),另取等量的泡铜,用足量的
溶液恰好完全溶解,同时放出2240 mL NO气体(标准状况),另取等量的泡铜,用足量的 还原,得到的铜的质量为
还原,得到的铜的质量为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】(1)已知2H→H2放出437.6kJ的热量,下列说法正确的是_________________ 。
A.氢气分子内每个氢原子都达到稳定结构
B.氢气分子的能量比两个氢原子的能量低
C.1 mol H2离解成2 mol H要放出437.6 kJ热量
D.氢原子比氢气分子稳定

(2)科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术2H2O 2H2↑+O2↑,制得的氢气可用于制作燃料电池。试回答下列问题:
2H2↑+O2↑,制得的氢气可用于制作燃料电池。试回答下列问题:
①分解海水时,生成的氢气用于制作燃料电池时,实现了化学能转化为_________ 能;分解海水的反应属于___________ 反应(填“放热”或“吸热”)。
②某种氢氧燃料电池,电解质溶液是甲,一个电极上发生的电极反应为:H2 +2OH- - 2e- =2H2O,则甲溶液可能是_____________ (选填字母)。
A.稀硫酸 B.食盐水 C.乙醇 D. KOH溶液
(3)锌锰干电池是应用最广泛的电池之一(如图所示),请回答下列有关问题:

①锌锰干电池的负极材料是______ ,该电池工作时,NH4+ 移向____ 极(填“正”或“负”)。
②关于该电池的使用和性能说法正确的是_______________ 。
A.该电池可反复充电使用
B.该电池可用于闹钟、收音机、照相机等
C.该电池使用后能投入火中,也可投入池塘中
D.碱性锌锰电池比酸性锌锰电池寿命长、性能好
A.氢气分子内每个氢原子都达到稳定结构
B.氢气分子的能量比两个氢原子的能量低
C.1 mol H2离解成2 mol H要放出437.6 kJ热量
D.氢原子比氢气分子稳定

(2)科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术2H2O
 2H2↑+O2↑,制得的氢气可用于制作燃料电池。试回答下列问题:
2H2↑+O2↑,制得的氢气可用于制作燃料电池。试回答下列问题:①分解海水时,生成的氢气用于制作燃料电池时,实现了化学能转化为
②某种氢氧燃料电池,电解质溶液是甲,一个电极上发生的电极反应为:H2 +2OH- - 2e- =2H2O,则甲溶液可能是
A.稀硫酸 B.食盐水 C.乙醇 D. KOH溶液
(3)锌锰干电池是应用最广泛的电池之一(如图所示),请回答下列有关问题:

①锌锰干电池的负极材料是
②关于该电池的使用和性能说法正确的是
A.该电池可反复充电使用
B.该电池可用于闹钟、收音机、照相机等
C.该电池使用后能投入火中,也可投入池塘中
D.碱性锌锰电池比酸性锌锰电池寿命长、性能好
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】(1)最早使用的化学电池是锌锰电池,即大家熟悉的干电池。这种电池在使用过程中,锌外壳会逐渐变薄,最后内部糊状的电解质会泄漏出来,使电器腐蚀。后来人们采用了什么方法将其改造成了防漏电池。请列举一种方法即可_____________。
这种电池还有一个缺点:即使不用,放置过久,也会失效,请说明失效的原因_________。
(2)为提高电池寿命和提高其性能,人们将电池内的电解质NH4Cl换成湿的KOH,并在构造上做了改进,制成了碱性锌锰电池。其总反应为:
Zn + 2MnO2 + 2H2O ="===" 2MnOOH + Zn(OH)2
写出该电池正极反应式___________。电池工作时,电子流向 (填“正”或“负”)极。
(3)二氧化锰是制造锌锰干电池的基本材料。MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是 。若电解电路中通过2mol电子,MnO2的理论产量为 。
(4)生产MnO2另一种方法:以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰。流程如下:

某软锰矿的主要成分为MnO2,还含有Si(16.72%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
①硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式
为 。
②加入MnS的目的是除去 杂质。
这种电池还有一个缺点:即使不用,放置过久,也会失效,请说明失效的原因_________。
(2)为提高电池寿命和提高其性能,人们将电池内的电解质NH4Cl换成湿的KOH,并在构造上做了改进,制成了碱性锌锰电池。其总反应为:
Zn + 2MnO2 + 2H2O ="===" 2MnOOH + Zn(OH)2
写出该电池正极反应式___________。电池工作时,电子流向 (填“正”或“负”)极。
(3)二氧化锰是制造锌锰干电池的基本材料。MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是 。若电解电路中通过2mol电子,MnO2的理论产量为 。
(4)生产MnO2另一种方法:以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰。流程如下:

某软锰矿的主要成分为MnO2,还含有Si(16.72%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥–0.42 | ≥2.5 | ≥7 | ≥7 |
①硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式
为 。
②加入MnS的目的是除去 杂质。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】化学电池在通讯、交通及日常生活中有着广泛的应用。
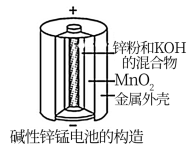
(1)碱性锌锰干电池(如图所示)是应用最普遍的电池之一,电池总反应为Zn+2MnO2+2H2O 2MnOOH+Zn(OH)2,碱性锌锰干电池的负极材料是
2MnOOH+Zn(OH)2,碱性锌锰干电池的负极材料是___ (填名称),负极上发生的电极反应为___ 。若反应消耗13g负极材料,则电池中转移电子的物质的量为___ mol。
(2)铅蓄电池是典型的可充电电池,它的正、负极格板都是惰性材料,电池总反应式为PbO2+2H2SO4 2PbSO4+2H2O。下列说法正确的是
2PbSO4+2H2O。下列说法正确的是___ (填标号)。
A.电解液中H2SO4的浓度始终保持不变
B.放电时正极上的电极反应式为PbO2+2e-+4H++SO =PbSO4+2H2O
=PbSO4+2H2O
C.放电时,当外电路通过1mol电子时,理论上负极质量增加48g
D.放电时,溶液中的SO 向正极移动
向正极移动
(3)镁铝电池的构造如图所示,当电解质溶液为NaOH溶液时,可知电池的负极材料为___ (填“Mg”或“Al”),正极上的电极反应式为___ 。


(1)碱性锌锰干电池(如图所示)是应用最普遍的电池之一,电池总反应为Zn+2MnO2+2H2O
 2MnOOH+Zn(OH)2,碱性锌锰干电池的负极材料是
2MnOOH+Zn(OH)2,碱性锌锰干电池的负极材料是(2)铅蓄电池是典型的可充电电池,它的正、负极格板都是惰性材料,电池总反应式为PbO2+2H2SO4
 2PbSO4+2H2O。下列说法正确的是
2PbSO4+2H2O。下列说法正确的是A.电解液中H2SO4的浓度始终保持不变
B.放电时正极上的电极反应式为PbO2+2e-+4H++SO
 =PbSO4+2H2O
=PbSO4+2H2OC.放电时,当外电路通过1mol电子时,理论上负极质量增加48g
D.放电时,溶液中的SO
 向正极移动
向正极移动(3)镁铝电池的构造如图所示,当电解质溶液为NaOH溶液时,可知电池的负极材料为

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
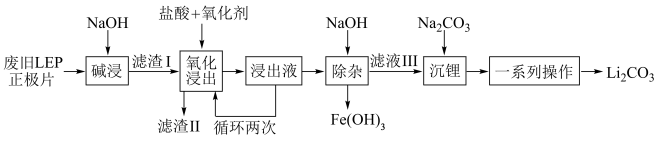
【推荐1】随着新能源汽车销量的猛增,动力电池退役高峰将至,磷酸铁锂(LFP)是目前使用最多的动力电池材料,因此回收磷酸铁锂具有重要意义。一种从废旧磷酸铁锂正极片( 、导电石墨、铝箔)中回收锂的工艺流程如下:
、导电石墨、铝箔)中回收锂的工艺流程如下:
已知: 在水中的溶解度随温度升高而降低。
在水中的溶解度随温度升高而降低。
回答下列问题:
(1)旧电池拆解前进行放电处理有利于锂在正极的回收,其原因是___________ 。
(2)“碱浸”时,为加快浸出速率,可采取的措施是___________ (答出一点即可)。
(3)“氧化浸出”时,实际生产中氧化剂选用 ,不选用
,不选用 的原因是
的原因是___________ 。“氧化浸出”时生成了难溶的 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(4)“沉锂”过程中使用水浴加热保持温度在95℃,“一系列操作”具体包括___________ 、___________ 、干燥。
(5)滤液Ⅲ中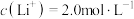 ,“沉锂”结束时溶液中
,“沉锂”结束时溶液中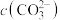 为
为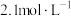 ,则“沉锂”过程中,锂的沉降率为
,则“沉锂”过程中,锂的沉降率为___________ %[已知:浸出液在沉锂过程中溶液体积不变,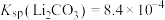 ]。
]。
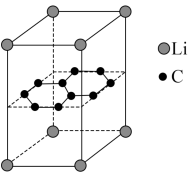
(6)某锂电池的负极材料晶体是锂原子嵌入石墨烯层间形成的,晶胞结构(底面为平行四边形)如图所示。该晶体的化学式为___________ ,该晶体中最近的两个碳原子核间距离为apm,石墨烯层间距离为bpm,则该晶体的密度为___________  (列出计算式,用
(列出计算式,用 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。
 、导电石墨、铝箔)中回收锂的工艺流程如下:
、导电石墨、铝箔)中回收锂的工艺流程如下:
已知:
 在水中的溶解度随温度升高而降低。
在水中的溶解度随温度升高而降低。回答下列问题:
(1)旧电池拆解前进行放电处理有利于锂在正极的回收,其原因是
(2)“碱浸”时,为加快浸出速率,可采取的措施是
(3)“氧化浸出”时,实际生产中氧化剂选用
 ,不选用
,不选用 的原因是
的原因是 ,该反应的离子方程式为
,该反应的离子方程式为(4)“沉锂”过程中使用水浴加热保持温度在95℃,“一系列操作”具体包括
(5)滤液Ⅲ中
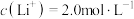 ,“沉锂”结束时溶液中
,“沉锂”结束时溶液中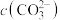 为
为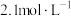 ,则“沉锂”过程中,锂的沉降率为
,则“沉锂”过程中,锂的沉降率为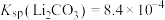 ]。
]。(6)某锂电池的负极材料晶体是锂原子嵌入石墨烯层间形成的,晶胞结构(底面为平行四边形)如图所示。该晶体的化学式为
 (列出计算式,用
(列出计算式,用 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。
您最近一年使用:0次
【推荐2】某科研人员以废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO)为原料回收镍,工艺流程如下:

已知:常温下,有关氢氧化物开始沉淀和沉淀完全的pH如表:
回答下列问题:
(1)浸出渣主要成分为_________ (填化学式)。
(2)“除铜”时,Fe3+与H2S反应的离子方程式为__________________ 。
(3)“氧化”的目的是将溶液中Fe2+氧化为Fe3+,温度需控制在40~50℃之间,该步骤温度不能太高的原因是_______________________ 。
(4)“调pH”时,pH的控制范围为_________ 。
(5)在碱性条件下,电解产生2NiOOH·H2O的原理分两步,其中第一步是Cl-在阳极被氧化为ClO-,则该电极反应式为_______________________ 。

已知:常温下,有关氢氧化物开始沉淀和沉淀完全的pH如表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7. 7 |
沉淀完全的pH | 3.7 | 9.7 | 9. 2 |
(1)浸出渣主要成分为
(2)“除铜”时,Fe3+与H2S反应的离子方程式为
(3)“氧化”的目的是将溶液中Fe2+氧化为Fe3+,温度需控制在40~50℃之间,该步骤温度不能太高的原因是
(4)“调pH”时,pH的控制范围为
(5)在碱性条件下,电解产生2NiOOH·H2O的原理分两步,其中第一步是Cl-在阳极被氧化为ClO-,则该电极反应式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】Ⅰ.现有一包白色固体粉末,由 、
、 、NaCl、
、NaCl、 、
、 中的三种物质组成,为确定其成分,进行如下实验:
中的三种物质组成,为确定其成分,进行如下实验:
①取少量白色粉末,加入足量水,充分搅拌后过滤,得到白色沉淀和无色滤液;
②向Ⅰ滤出的沉淀中加入足量稀盐酸,沉淀完全溶解,并产生无色气体。
据此回答下列问题:
(1)原白色固体粉末中一定含有______ ,一定不含有______ (填化学式)。
(2)为进一步确定白色粉末的组成,向①过滤得到的无色滤液中,加入少量某无色溶液,根据是否有白色沉淀产生,可判断原白色粉末的组成,加入的无色溶液不可以是下列溶液中的______(填序号)。
Ⅱ.某同学设计如下实验方案,来分离NaCl和 两种固体混合物,供选试剂:
两种固体混合物,供选试剂: 溶液、
溶液、 溶液、
溶液、 溶液、盐酸
溶液、盐酸
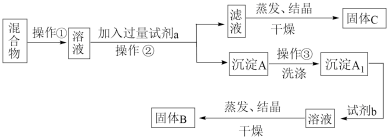
(3)试剂a是______ (填化学式,下同),试剂b是______ 。
(4)加入试剂b所发生反应的化学方程式为__________________ 。
(5)该方案能否达到实验目的?答:______ (填“能”或“不能”)。若不能,应如何改进?答:______ (若能,此问不用回答)
 、
、 、NaCl、
、NaCl、 、
、 中的三种物质组成,为确定其成分,进行如下实验:
中的三种物质组成,为确定其成分,进行如下实验:①取少量白色粉末,加入足量水,充分搅拌后过滤,得到白色沉淀和无色滤液;
②向Ⅰ滤出的沉淀中加入足量稀盐酸,沉淀完全溶解,并产生无色气体。
据此回答下列问题:
(1)原白色固体粉末中一定含有
(2)为进一步确定白色粉末的组成,向①过滤得到的无色滤液中,加入少量某无色溶液,根据是否有白色沉淀产生,可判断原白色粉末的组成,加入的无色溶液不可以是下列溶液中的______(填序号)。
A. 溶液 溶液 | B. 溶液 溶液 | C. 溶液 溶液 | D. 溶液 溶液 |
Ⅱ.某同学设计如下实验方案,来分离NaCl和
 两种固体混合物,供选试剂:
两种固体混合物,供选试剂: 溶液、
溶液、 溶液、
溶液、 溶液、盐酸
溶液、盐酸
(3)试剂a是
(4)加入试剂b所发生反应的化学方程式为
(5)该方案能否达到实验目的?答:
您最近一年使用:0次



