硒(Se)是第四周期VIA族元素,是人体内不可或缺的微量元素,其氢化物H2Se是制备新型光伏太阳能电池、半导体材料和金属硒化物的基础原料。
(1)T°C时,向一恒容密闭容器中加入3molH2和1molSe,发生反应H2(g)+Se(s)⇌H2Se(g)。以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如图1、图2所示:
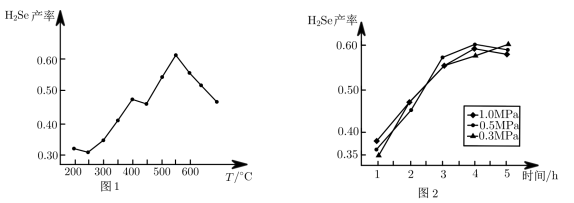
则制备H2Se的最佳温度和压强为_____ 。
(2)由H2Se在一定条件下制备CuSe,已知25℃时CuSe的Ksp=7.9×10-49,CuS的Ksp=l.3×10-36,则反应CuS(s)+Se2-(aq)⇌CuSe(s)+S2-(aq)的化学平衡常数K=____ (保留2位有效数字)。
(1)T°C时,向一恒容密闭容器中加入3molH2和1molSe,发生反应H2(g)+Se(s)⇌H2Se(g)。以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如图1、图2所示:

则制备H2Se的最佳温度和压强为
(2)由H2Se在一定条件下制备CuSe,已知25℃时CuSe的Ksp=7.9×10-49,CuS的Ksp=l.3×10-36,则反应CuS(s)+Se2-(aq)⇌CuSe(s)+S2-(aq)的化学平衡常数K=
更新时间:2020-09-18 17:54:14
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】铁、铜单质及其化合物应用范围很广。现有含氯化亚铁杂质的氯化铜晶体( ),为制取纯净的
),为制取纯净的 ,某兴趣小组首先将其制成水溶液。
,某兴趣小组首先将其制成水溶液。
(1)通常将氢氧化钠溶液加入氯化亚铁溶液的实验现象是__________________________________ ,书写氢氧化亚铁在空气中转化为氢氧化铁的化学方程式________________________________ 。
(2)已知pH=1.9时,Fe3+就能开始沉淀,因此可首先加入氧化剂将Fe2+氧化后再除去,下列氧化剂最适合的是___________ 。
A. NaClO B. H2O2 C. KMnO4 D. 浓硫酸
(3)在所得的FeCl3、CuCl2混合溶液中加入镁粉,产生的气体是______ 。试解释原因:__________________________________________________ 。有同学提出加入CuO以除去Fe3+。你认为理由是___________________________________________________________________ 。
(4)能不能直接蒸发CuCl2溶液得到 晶体?
晶体?__________ (填“能”或“不能”)。若能,不用回答;若不能,说明理由______________________________________________________ 。经检测, 中含水28.6%,则
中含水28.6%,则 中
中 的值为
的值为___________ 。
 ),为制取纯净的
),为制取纯净的 ,某兴趣小组首先将其制成水溶液。
,某兴趣小组首先将其制成水溶液。(1)通常将氢氧化钠溶液加入氯化亚铁溶液的实验现象是
(2)已知pH=1.9时,Fe3+就能开始沉淀,因此可首先加入氧化剂将Fe2+氧化后再除去,下列氧化剂最适合的是
A. NaClO B. H2O2 C. KMnO4 D. 浓硫酸
(3)在所得的FeCl3、CuCl2混合溶液中加入镁粉,产生的气体是
(4)能不能直接蒸发CuCl2溶液得到
 晶体?
晶体? 中含水28.6%,则
中含水28.6%,则 中
中 的值为
的值为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。
甲烷水蒸气催化重整是制高纯氢的方法之一。
①反应器中初始反应的生成物为H2和CO2,其物质的量之比为4∶1,甲烷和水蒸气反应的方程式是__ 。
②反应物投料比采用n(H2O)∶n(CH4)=4∶1,大于初始反应的化学计量数之比,目的是__ (选填字母序号)。
a.促进CH4转化 b.促进CO转化为CO2 c.减少积炭生成
③用CaO可以去除CO2。H2体积分数和CaO消耗率随时间变化关系如图所示。从t1时开始,H2体积分数显著降低,单位时间CaO消耗率__ (填“升高”“降低”或“不变”)。此时CaO消耗率约为35%,但已失效,结合化学方程式解释原因:___ 。

甲烷水蒸气催化重整是制高纯氢的方法之一。
①反应器中初始反应的生成物为H2和CO2,其物质的量之比为4∶1,甲烷和水蒸气反应的方程式是
②反应物投料比采用n(H2O)∶n(CH4)=4∶1,大于初始反应的化学计量数之比,目的是
a.促进CH4转化 b.促进CO转化为CO2 c.减少积炭生成
③用CaO可以去除CO2。H2体积分数和CaO消耗率随时间变化关系如图所示。从t1时开始,H2体积分数显著降低,单位时间CaO消耗率

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】水煤气法制甲醇工艺流程框图如下

(注:除去水蒸气后的水煤气含55~59%的H2,15~18%的CO,11~13%的CO2,少量的H2S、CH4,除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成)
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g) CO(g)+H2(g),此反应是吸热反应。①此反应的化学平衡常数表达式为
CO(g)+H2(g),此反应是吸热反应。①此反应的化学平衡常数表达式为____________________ ;
②下列能提高碳的平衡转化率的措施是____________________ 。
A.加入C(s) B.加入H2O(g) C.升高温度 D.增大压强
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:
CH4 (g)+3/2O2 (g) CO (g)+2H2O (g) +519kJ。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
CO (g)+2H2O (g) +519kJ。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
① X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
② Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③ Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂是_____ (填“X”或“Y”或“Z”),选择的理由是_________________________________________ 。
(3)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g) + CO(g) CH3OH(g)+181.6kJ。T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
CH3OH(g)+181.6kJ。T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:v正________ v逆(填“>”、“<”或“=”)。
②若加入同样多的CO、H2,在T5℃反应,10 min后达到平衡,此时c(H2)=0.4 mol·L-1、c(CO)=0.7 mol·L-1、则该时间内反应速率v(CH3OH) =____________ mol·(L·min)-1。
(4)生产过程中,合成气要进行循环,其目的是__________________________________ 。

(注:除去水蒸气后的水煤气含55~59%的H2,15~18%的CO,11~13%的CO2,少量的H2S、CH4,除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成)
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g)
 CO(g)+H2(g),此反应是吸热反应。①此反应的化学平衡常数表达式为
CO(g)+H2(g),此反应是吸热反应。①此反应的化学平衡常数表达式为②下列能提高碳的平衡转化率的措施是
A.加入C(s) B.加入H2O(g) C.升高温度 D.增大压强
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:
CH4 (g)+3/2O2 (g)
 CO (g)+2H2O (g) +519kJ。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
CO (g)+2H2O (g) +519kJ。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)① X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
② Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③ Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂是
(3)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g) + CO(g)
 CH3OH(g)+181.6kJ。T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
CH3OH(g)+181.6kJ。T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:| 物质 | H2 | CO | CH3OH |
| 浓度/(mol·L-1) | 0.2 | 0.1 | 0.4 |
①比较此时正、逆反应速率的大小:v正
②若加入同样多的CO、H2,在T5℃反应,10 min后达到平衡,此时c(H2)=0.4 mol·L-1、c(CO)=0.7 mol·L-1、则该时间内反应速率v(CH3OH) =
(4)生产过程中,合成气要进行循环,其目的是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】 、CO、
、CO、 等都是重要的能源,也是重要的化工原料。
等都是重要的能源,也是重要的化工原料。
(1)25℃,101kPa时,8.0g 完全燃烧生成二氧化碳气体和液态水放出445.1kJ热量。写出该反应的热化学反应方程式:
完全燃烧生成二氧化碳气体和液态水放出445.1kJ热量。写出该反应的热化学反应方程式:___________ 。
(2)水煤气中的CO和 在高温下反应可生成甲烷。在体积为2L的恒容密闭容器中,充入1molCO和5molH2,一定温度下发生反应:
在高温下反应可生成甲烷。在体积为2L的恒容密闭容器中,充入1molCO和5molH2,一定温度下发生反应: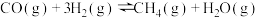 。测得CO和H2的转化率随时间变化如图-1所示。
。测得CO和H2的转化率随时间变化如图-1所示。___________ ,6分钟时,H2的转化率为___________ 。
②下列叙述中能说明上述反应达到化学平衡状态的是___________ 。(填字母)
a.容器中混合气体的密度保持不变
b.容器中混合气体的总压强保持不变
c.容器中 的质量分数保持不变
的质量分数保持不变
d.单位时间内每消耗1molCO,同时生成1mol
(3)甲烷燃料电池装置图如图-2,电池总反应为 。现用此燃料电池电解饱和食盐水。
。现用此燃料电池电解饱和食盐水。
①通入氧气的电极为电池的___________ (填“正极”或“负极”)
②若通入0.1mol 充分反应,计算用此燃料电池电解饱和食盐水,理论上得到氢气的体积(标准状况下)。写出计算过程,否则不得分。
充分反应,计算用此燃料电池电解饱和食盐水,理论上得到氢气的体积(标准状况下)。写出计算过程,否则不得分。___________ 。
 、CO、
、CO、 等都是重要的能源,也是重要的化工原料。
等都是重要的能源,也是重要的化工原料。(1)25℃,101kPa时,8.0g
 完全燃烧生成二氧化碳气体和液态水放出445.1kJ热量。写出该反应的热化学反应方程式:
完全燃烧生成二氧化碳气体和液态水放出445.1kJ热量。写出该反应的热化学反应方程式:(2)水煤气中的CO和
 在高温下反应可生成甲烷。在体积为2L的恒容密闭容器中,充入1molCO和5molH2,一定温度下发生反应:
在高温下反应可生成甲烷。在体积为2L的恒容密闭容器中,充入1molCO和5molH2,一定温度下发生反应: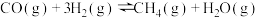 。测得CO和H2的转化率随时间变化如图-1所示。
。测得CO和H2的转化率随时间变化如图-1所示。
②下列叙述中能说明上述反应达到化学平衡状态的是
a.容器中混合气体的密度保持不变
b.容器中混合气体的总压强保持不变
c.容器中
 的质量分数保持不变
的质量分数保持不变d.单位时间内每消耗1molCO,同时生成1mol

(3)甲烷燃料电池装置图如图-2,电池总反应为
 。现用此燃料电池电解饱和食盐水。
。现用此燃料电池电解饱和食盐水。①通入氧气的电极为电池的
②若通入0.1mol
 充分反应,计算用此燃料电池电解饱和食盐水,理论上得到氢气的体积(标准状况下)。写出计算过程,否则不得分。
充分反应,计算用此燃料电池电解饱和食盐水,理论上得到氢气的体积(标准状况下)。写出计算过程,否则不得分。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。工业生产甲醇的常用方法是CO(g)+2H2(g)===CH3OH(g) ΔH<0。
(1)在25℃、101 kPa下,1 g甲醇(液态)完全燃烧后,恢复到原状态放热Q kJ,则表示甲醇燃烧热的热化学方程式为__________________________ 。
(2)工业上利用甲醇制备氢气常用的方法之一是甲醇蒸气重整法。此方法当中的一个主要反应为CH3OH(g)===CO(g)+2H2(g),说明该反应能自发进行的原因_________________________ 。
(3)甲醇燃料电池由于其结构简单、能量转化率高、对环境无污染、可作为常规能源的替代品而越来越受到关注。其工作原理如右图,质子交换膜左右两侧的溶液均为1L 1.5 mol/L H2SO4 溶液。

①通入气体a的电极是电池的______________ (填“正”或“负”)极,其电极反应式为_______________ ;
②当电池中有2 mole-发生转移时,左右两侧溶液的质量之差为__________________ (忽略气体的溶解,假设反应物完全耗尽)。
(1)在25℃、101 kPa下,1 g甲醇(液态)完全燃烧后,恢复到原状态放热Q kJ,则表示甲醇燃烧热的热化学方程式为
(2)工业上利用甲醇制备氢气常用的方法之一是甲醇蒸气重整法。此方法当中的一个主要反应为CH3OH(g)===CO(g)+2H2(g),说明该反应能自发进行的原因
(3)甲醇燃料电池由于其结构简单、能量转化率高、对环境无污染、可作为常规能源的替代品而越来越受到关注。其工作原理如右图,质子交换膜左右两侧的溶液均为1L 1.5 mol/L H2SO4 溶液。

①通入气体a的电极是电池的
②当电池中有2 mole-发生转移时,左右两侧溶液的质量之差为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】能源是人类赖以生存和发展的重要物质基础,常规能源的合理利用和新能源的合理开发是当今社会面临的严峻课题,回答下列问题:
(1)乙醇(C2H5OH)是未来内燃机的首选环保型液体燃料。1 g乙醇完全燃烧生成液态水放出a kJ的热量,则乙醇燃烧的热化学方程式为__________ 。
(2)由于C3H8(g)= C3H6(g)+H2(g) H=+bkJmol(b>0)的反应中,反应物具有的总能量________ (填“大于”“等于”或“小于”)生成物具有的总能量,那么在化学反应时,反应物就需要________ (填“放出”或“吸收”)能量才能转化为生成物。
(3)关于用水制取二次能源氢气,以下研究方向不正确的是________ 。
A 组成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢成为二次能源
B 设法将太阳光聚焦,产生高温,使水分解产生氢气
C 寻找高效催化剂,使水分解产生氢气,同时释放能量
D 寻找特殊催化剂,用于开发廉价能源,以分解水制取氢气
(4)已知下列两个热化学方程式,
A 2H2(g)+O2(g)=2H2O(l) H = -571.6kJ∙mol-1
B C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) H= -2220kJ∙mol-1
能表示燃烧热的热化学方程式为________ (填A或B)。将标况下22.4L的C3H8和H2混合气体(其中H2的体积分数为1/2),在上述条件下完全燃烧,则放出的热量为________ kJ。
(1)乙醇(C2H5OH)是未来内燃机的首选环保型液体燃料。1 g乙醇完全燃烧生成液态水放出a kJ的热量,则乙醇燃烧的热化学方程式为
(2)由于C3H8(g)= C3H6(g)+H2(g) H=+bkJmol(b>0)的反应中,反应物具有的总能量
(3)关于用水制取二次能源氢气,以下研究方向不正确的是
A 组成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢成为二次能源
B 设法将太阳光聚焦,产生高温,使水分解产生氢气
C 寻找高效催化剂,使水分解产生氢气,同时释放能量
D 寻找特殊催化剂,用于开发廉价能源,以分解水制取氢气
(4)已知下列两个热化学方程式,
A 2H2(g)+O2(g)=2H2O(l) H = -571.6kJ∙mol-1
B C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) H= -2220kJ∙mol-1
能表示燃烧热的热化学方程式为
您最近一年使用:0次



