用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2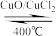 2Cl2+2H2O
2Cl2+2H2O
(1)已知:反应A中,4 mol HCl被氧化,放出116 kJ的热量。

①H2O的结构式是_______ 。
②反应A的热化学方程式是_______ 。
③断开1 mol H—O键与断开1 mol H—Cl键所需能量相差为_______ kJ,HCl中H—Cl键比H2O中H—O键(填“强”或“弱”)_______ 。
(2)对于反应A,下图是4种投料比[n(HCl)∶n(O2)],分别为1∶1、2∶1、4∶1、6∶1]下,反应温度对HCl平衡转化率影响的曲线。

①曲线b对应的投料比是_______ 。
②当曲线b、c、d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度与投料比的关系是:投料比越大,对应的温度_______ 。
③投料比为2∶1、温度为400℃时,平衡混合气中Cl2的物质的量分数是_______ 。O2转化率为_______ 。
反应A:4HCl+O2
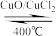 2Cl2+2H2O
2Cl2+2H2O(1)已知:反应A中,4 mol HCl被氧化,放出116 kJ的热量。

①H2O的结构式是
②反应A的热化学方程式是
③断开1 mol H—O键与断开1 mol H—Cl键所需能量相差为
(2)对于反应A,下图是4种投料比[n(HCl)∶n(O2)],分别为1∶1、2∶1、4∶1、6∶1]下,反应温度对HCl平衡转化率影响的曲线。

①曲线b对应的投料比是
②当曲线b、c、d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度与投料比的关系是:投料比越大,对应的温度
③投料比为2∶1、温度为400℃时,平衡混合气中Cl2的物质的量分数是
更新时间:2021-01-11 13:10:37
|
【知识点】 化学反应原理综合考查解读
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】煤是一种重要的化工原料,人们将利用煤制取的水煤气、焦炭、甲醚等广泛用于工农业生产中。
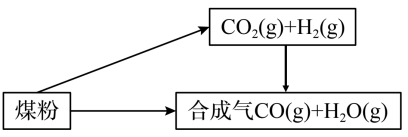
(1)已知: ①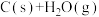

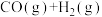
 +131.3kJ·mol-1
+131.3kJ·mol-1
②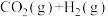


 +41.3kJ·mol-1
+41.3kJ·mol-1
则碳与水蒸气反应生成二氧化碳和氢气的热化学方程式为______ ,该反应在________ (填“高温”、“低温”或“任何温度”)下有利于正向自发进行。
(2)有人利用炭还原法处理氮氧化物,发生反应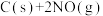
 N2(g)+CO2(g)。向某密闭容器中加入一定量的活性炭和
N2(g)+CO2(g)。向某密闭容器中加入一定量的活性炭和 ,在
,在 ℃时,不同时间测得各物质的浓度如下表所示:
℃时,不同时间测得各物质的浓度如下表所示:
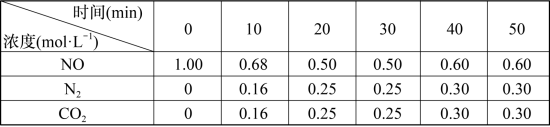
①10~20 内,N2的平均反应速率
内,N2的平均反应速率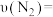
________________ ;
②30 后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是
后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是_________ (填字母序号)。
A.通入一定量的 B.加入一定量的活性炭
B.加入一定量的活性炭
C.加入合适的催化剂 D.适当缩小容器的体积
(3)研究表明:反应

 平衡常数随温度的变化如下表所示:
平衡常数随温度的变化如下表所示:
若反应在500℃时进行,设起始时 和
和 的浓度均为0.020
的浓度均为0.020 ,在该条件下达到平衡时,
,在该条件下达到平衡时,  的转化率为
的转化率为__________ 。
(4)用 做燃料电池电解
做燃料电池电解 溶液、
溶液、 和
和 混合液的示意图如图1所示,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时
混合液的示意图如图1所示,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时 、
、 两极上产生的气体体积相同。
两极上产生的气体体积相同。

a.图1中A极产生的气体在标准状况下的体积为__________ ;
b.电极为 、
、 的装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2所示,则图中③线表示的是
的装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2所示,则图中③线表示的是__________ (填离子符号)的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要__________  5.0
5.0
 溶液。
溶液。
c.乙炔(CH≡CH)是重要的化工原料,广泛应用于焊割、燃料电池及有机合成等。乙炔-空气燃料电池是一种碱性(20%-30%的KOH溶液)燃料电池。电池放电时,负极的电极反应式为__________ 。

(1)已知: ①
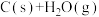

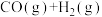
 +131.3kJ·mol-1
+131.3kJ·mol-1②
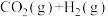


 +41.3kJ·mol-1
+41.3kJ·mol-1则碳与水蒸气反应生成二氧化碳和氢气的热化学方程式为
(2)有人利用炭还原法处理氮氧化物,发生反应
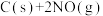
 N2(g)+CO2(g)。向某密闭容器中加入一定量的活性炭和
N2(g)+CO2(g)。向某密闭容器中加入一定量的活性炭和 ,在
,在 ℃时,不同时间测得各物质的浓度如下表所示:
℃时,不同时间测得各物质的浓度如下表所示:
①10~20
 内,N2的平均反应速率
内,N2的平均反应速率
②30
 后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是
后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是A.通入一定量的
 B.加入一定量的活性炭
B.加入一定量的活性炭C.加入合适的催化剂 D.适当缩小容器的体积
(3)研究表明:反应


 平衡常数随温度的变化如下表所示:
平衡常数随温度的变化如下表所示:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
 和
和 的浓度均为0.020
的浓度均为0.020 ,在该条件下达到平衡时,
,在该条件下达到平衡时,  的转化率为
的转化率为(4)用
 做燃料电池电解
做燃料电池电解 溶液、
溶液、 和
和 混合液的示意图如图1所示,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时
混合液的示意图如图1所示,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时 、
、 两极上产生的气体体积相同。
两极上产生的气体体积相同。
a.图1中A极产生的气体在标准状况下的体积为
b.电极为
 、
、 的装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2所示,则图中③线表示的是
的装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2所示,则图中③线表示的是 5.0
5.0
 溶液。
溶液。c.乙炔(CH≡CH)是重要的化工原料,广泛应用于焊割、燃料电池及有机合成等。乙炔-空气燃料电池是一种碱性(20%-30%的KOH溶液)燃料电池。电池放电时,负极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】Ⅰ、O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+O3(g)=IO-(aq)+O2(g) △H1 ②IO-(aq)+H+(aq) HOI(aq) △H2
HOI(aq) △H2
③HOI(aq)+I-(aq)+H+(aq) I2(aq)+H2O(l) △H3 总反应△H=
I2(aq)+H2O(l) △H3 总反应△H=______ 。
Ⅱ、用H2O2、KI和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
(1)资料1:KI在该反应中的作用: H2O2+I-=H2O+IO-; H2O2+IO-=H2O+O2↑+I-。
总反应的化学方程式是__________ 。
(2)资料2:H2O2分解反应过程中能量变化如图所示,其中①有KI加入,

②无KI加入。下列判断正确的是___________ (填字母)。
a 加入KI后改变了反应的路径
b 加入KI后改变了总反应的能量变化
c H2O2+I-=H2O+IO-是放热反应
(3)实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。再加入CCl4,振荡、静置,气泡明显减少。
资料3:I2也可催化H2O2的分解反应。
①加CCl4并振荡、静置后还可观察到_____ ,说明有I2生成。
②气泡明显减少的原因可能是:i. H2O2浓度降低;ii.________ 。以下对照实验说明i不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管加入CCl4,B试管不加CCl4,分别振荡、静置。观察到的现象是______ 。
(4)资料4:I-(aq)+I2(aq) I
I (aq) K=640。为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10mL 0.10mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:
(aq) K=640。为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10mL 0.10mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:
①a=______ 。
②该平衡体系中除了含有I-,I2,I3-外,一定还含有其他含碘微粒,理由是________ 。
①I-(aq)+O3(g)=IO-(aq)+O2(g) △H1 ②IO-(aq)+H+(aq)
 HOI(aq) △H2
HOI(aq) △H2③HOI(aq)+I-(aq)+H+(aq)
 I2(aq)+H2O(l) △H3 总反应△H=
I2(aq)+H2O(l) △H3 总反应△H=Ⅱ、用H2O2、KI和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
(1)资料1:KI在该反应中的作用: H2O2+I-=H2O+IO-; H2O2+IO-=H2O+O2↑+I-。
总反应的化学方程式是
(2)资料2:H2O2分解反应过程中能量变化如图所示,其中①有KI加入,

②无KI加入。下列判断正确的是
a 加入KI后改变了反应的路径
b 加入KI后改变了总反应的能量变化
c H2O2+I-=H2O+IO-是放热反应
(3)实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。再加入CCl4,振荡、静置,气泡明显减少。
资料3:I2也可催化H2O2的分解反应。
①加CCl4并振荡、静置后还可观察到
②气泡明显减少的原因可能是:i. H2O2浓度降低;ii.
(4)资料4:I-(aq)+I2(aq)
 I
I (aq) K=640。为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10mL 0.10mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:
(aq) K=640。为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10mL 0.10mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:| 微粒 | I- | I2 | I3- |
| 浓度/(mol·L-1) | 2.5×10-3 | a | 4.0×10-3 |
②该平衡体系中除了含有I-,I2,I3-外,一定还含有其他含碘微粒,理由是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】NO用途广泛,对其进行研究具有重要的价值和意义
(1)2NO(g)+O2(g)=2NO2(g)△H=akJ•mol-1的反应历程与能量变化关系如图所示。已知:第Ⅱ步反应为:NO3(g)+NO(g)=2NO2(g)△H=bkJ•mol-1

①第I步反应的热化学方程式为__ 。
②关于2NO(g)+O2(g)=2NO2(g)的反应历程,下列说法正确的是__ 。
A.相同条件下,决定该反应快慢的步骤为第Ⅱ步反应
B.使用合适的催化剂会使E1、E2、E3同时减小
C.第I步反应为吸热反应,第Ⅱ步反应为放热反应
D.反应的中同产物是NO3和NO
(2)NO的氢化还原反应为2NO(g)+2H2(g)⇌N2(g)+2H2O(g)。研究表明:某温度时,v正=k•cm(NO)•cn(H2),其中k=2.5×103mol(m+n-1)•L(m+n-1)•s-1.该温度下,当c(H2)=4.0×10-3mol•L-1时,实验测得v正与c(NO)的关系如图一所示,则m=___ ,n=___ 。

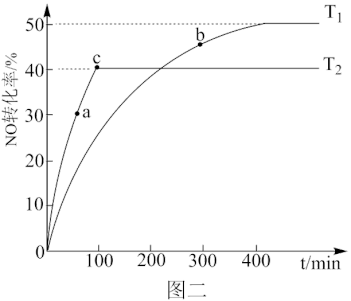
(3)NO易发生二聚反应2NO(g)⇌N2O2(g)。在相同的刚性反应器中充入等量的NO,分别发生该反应。不同温度下,NO的转化率随时间(t)的变化关系如图二所示。
①该反应的△H___ 0(填“>”“<”或“=”)。
②T1温度下,欲提高NO的平衡转化率,可采取的措施为__ (任写一条即可)。
③a、b处正反应速率va__ vb(填”>”“<”或“=”),原因为___ 。
④e点对应体系的总压强为200kPa,则T2温度下,该反应的平衡常数kp=___ kPa-1(Kp为以分压表示的平衡常数)
(1)2NO(g)+O2(g)=2NO2(g)△H=akJ•mol-1的反应历程与能量变化关系如图所示。已知:第Ⅱ步反应为:NO3(g)+NO(g)=2NO2(g)△H=bkJ•mol-1

①第I步反应的热化学方程式为
②关于2NO(g)+O2(g)=2NO2(g)的反应历程,下列说法正确的是
A.相同条件下,决定该反应快慢的步骤为第Ⅱ步反应
B.使用合适的催化剂会使E1、E2、E3同时减小
C.第I步反应为吸热反应,第Ⅱ步反应为放热反应
D.反应的中同产物是NO3和NO
(2)NO的氢化还原反应为2NO(g)+2H2(g)⇌N2(g)+2H2O(g)。研究表明:某温度时,v正=k•cm(NO)•cn(H2),其中k=2.5×103mol(m+n-1)•L(m+n-1)•s-1.该温度下,当c(H2)=4.0×10-3mol•L-1时,实验测得v正与c(NO)的关系如图一所示,则m=


(3)NO易发生二聚反应2NO(g)⇌N2O2(g)。在相同的刚性反应器中充入等量的NO,分别发生该反应。不同温度下,NO的转化率随时间(t)的变化关系如图二所示。
①该反应的△H
②T1温度下,欲提高NO的平衡转化率,可采取的措施为
③a、b处正反应速率va
④e点对应体系的总压强为200kPa,则T2温度下,该反应的平衡常数kp=
您最近一年使用:0次



