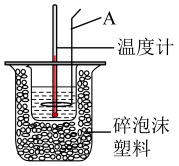
50 mL 0.50 mol•L-1盐酸与50 mL 0.55 mol•L-1NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:

(1)大小烧杯间填满碎纸条的作用_______ ;
(2)大烧杯上如不盖硬纸板,求得的中和热数值_______ (填“偏大”、“偏小”或“无影响”);
(3)实验中改用60mL0.50mol•L-1盐酸与50mL0.55 mol•L-1NaOH溶液进行反应,与上述实验相比,所放出的热量_______ (填“相等”或“不相等”),所求中和热_______ (填“相等”或“不相等”),简述理由_______ ;
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会_______ ,用50mL0.5mol•L-1NaOH溶液进行上述实验,测得的中和热的数值会_______ (均填“偏大””、“偏小””或“无影响”)。

(1)大小烧杯间填满碎纸条的作用
(2)大烧杯上如不盖硬纸板,求得的中和热数值
(3)实验中改用60mL0.50mol•L-1盐酸与50mL0.55 mol•L-1NaOH溶液进行反应,与上述实验相比,所放出的热量
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会
更新时间:2021-01-26 15:59:49
|
相似题推荐
解答题-实验探究题
|
较易
(0.85)
名校
【推荐1】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)烧杯间填满碎纸条的作用是____________________ 。
(2)大烧杯上如不盖硬纸板,求得的中和热的数值_________ (填“偏大”“偏小”“无影响”)。
(3)从实验装置上看,图中如果没有环形玻璃搅拌棒搅拌,如此求得的中和热的数值_________ (填“偏大”“偏小”“无影响”)。
(4)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量_____________________ (填“相等”“不相等”),所求中和热____________ (填“相等”“不相等”),简述理由:_______________________________ 。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会______________ ;用50 mL 0.50 mol·L-1NaOH溶液进行上述实验,测得的中和热的数值会_____________________ 。(均填“偏大”“偏小”“无影响”)

(1)烧杯间填满碎纸条的作用是
(2)大烧杯上如不盖硬纸板,求得的中和热的数值
(3)从实验装置上看,图中如果没有环形玻璃搅拌棒搅拌,如此求得的中和热的数值
(4)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐2】某实验小组设计用0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行测定中和热的实验。

(1)该装置中缺少的一种玻璃仪器是___ ,装置中还存在的错误有___ ;大烧杯杯口若不盖泡沫塑料板,测得中和热的数值将____ (填“偏大”、“偏小”或“无影响”)。
(2)实验中,所用NaOH稍过量的原因是___ 。
(3)在中和热测定实验中,有用水洗涤温度计上的盐酸溶液的步骤,若无此操作,则测得的中和热数值____ (填“偏大”、“偏小”或“不变”)。测量NaOH溶液温度时,温度计上的碱未用水冲洗,对测定结果有何影响?___ (填“偏大”、“偏小”或“无影响”)。
(4)该实验小组做了三次实验,每次取盐酸和NaOH溶液各50mL,并记录如表原始数据:
已知盐酸、NaOH溶液密度均近似为1.00g/cm3,中和后混合液的比热容c=4.18×10-3kJ/(g·℃),则该反应的中和热ΔH=___ 。(保留到小数点后1位)

(1)该装置中缺少的一种玻璃仪器是
(2)实验中,所用NaOH稍过量的原因是
(3)在中和热测定实验中,有用水洗涤温度计上的盐酸溶液的步骤,若无此操作,则测得的中和热数值
(4)该实验小组做了三次实验,每次取盐酸和NaOH溶液各50mL,并记录如表原始数据:
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 25.1 | 25.1 | 28.5 | 3.4 |
| 3 | 25.1 | 25.1 | 25.1 | 28.6 | 3.5 |
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐3】利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50mL 0.50 盐酸倒入内筒中,测出盐酸温度;
盐酸倒入内筒中,测出盐酸温度;
②用另一量筒量取50mL 0.55 NaOH溶液,并用同一温度计测出其温度;
NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入内筒中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)倒入NaOH溶液的正确操作是___________ (填字母)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使盐酸与NaOH溶液混合均匀的正确操作是___________(填字母)。
(3)现将一定量的氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L 1 的稀盐酸恰好完全反应,其反应热分别为
的稀盐酸恰好完全反应,其反应热分别为 、
、 、
、 ,则
,则 、
、 、
、 的大小关系为
的大小关系为___________ 。
(4)假设盐酸和氢氧化钠溶液的密度都是1 ,又知中和反应后生成溶液的比热容4.18J/(g·℃)。为了计算中和热,某学生实验记录数据如下:
,又知中和反应后生成溶液的比热容4.18J/(g·℃)。为了计算中和热,某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热
___________ (结果保留一位小数)。
(5)若计算生成1mol 时的放出的热量小于57.3kJ,产生偏差的原因可能是
时的放出的热量小于57.3kJ,产生偏差的原因可能是___________ (填字母)。
a.实验装置保温、隔热效果差
b.量取盐酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定盐酸起始温度后直接测定NaOH溶液的温度
e.使用玻璃搅拌器搅拌不均匀
f.实验中用铜丝搅拌器代替玻璃搅拌器

①用量筒量取50mL 0.50
 盐酸倒入内筒中,测出盐酸温度;
盐酸倒入内筒中,测出盐酸温度;②用另一量筒量取50mL 0.55
 NaOH溶液,并用同一温度计测出其温度;
NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入内筒中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)倒入NaOH溶液的正确操作是
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使盐酸与NaOH溶液混合均匀的正确操作是___________(填字母)。
| A.用温度计小心搅拌 |
| B.揭开杯盖用玻璃棒搅拌 |
| C.轻轻地振荡烧杯 |
| D.用套在温度计上的玻璃搅拌器轻轻地搅动 |
 的稀盐酸恰好完全反应,其反应热分别为
的稀盐酸恰好完全反应,其反应热分别为 、
、 、
、 ,则
,则 、
、 、
、 的大小关系为
的大小关系为(4)假设盐酸和氢氧化钠溶液的密度都是1
 ,又知中和反应后生成溶液的比热容4.18J/(g·℃)。为了计算中和热,某学生实验记录数据如下:
,又知中和反应后生成溶液的比热容4.18J/(g·℃)。为了计算中和热,某学生实验记录数据如下:| 实验序号 | 起始温度 /℃ /℃ | 终止温度 /℃ /℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.2 | 23.3 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.0 | 20.3 | 24.7 |
| 4 | 20.4 | 20.6 | 23.8 |

(5)若计算生成1mol
 时的放出的热量小于57.3kJ,产生偏差的原因可能是
时的放出的热量小于57.3kJ,产生偏差的原因可能是a.实验装置保温、隔热效果差
b.量取盐酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定盐酸起始温度后直接测定NaOH溶液的温度
e.使用玻璃搅拌器搅拌不均匀
f.实验中用铜丝搅拌器代替玻璃搅拌器
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐1】化学反应伴随有能量的变化,获取反应能量变化有多条途径。
(1)通过测定反应过程中所放出的热量可计算中和热。某学生分别取50mL的0.50mol/L盐酸与0.55mol/L氢氧化钠溶液进行中和反应,实验记录数据如下:
①已知热量计算 ,盐酸和氢氧化钠溶液的密度都是
,盐酸和氢氧化钠溶液的密度都是 ,又知中和后生成溶液的比热容c=4.180J/(g・℃),依据该学生的实验数据计算,该实验测得的
,又知中和后生成溶液的比热容c=4.180J/(g・℃),依据该学生的实验数据计算,该实验测得的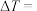
______ ℃,
______ J;该实验数据测出的中和热
______  (保留1位有效数字)。
(保留1位有效数字)。
②上述实验得出的 大于-57.3
大于-57.3 ,产生偏差的原因不可能是
,产生偏差的原因不可能是______ (填字母)。
a.实验装置保温、隔热效果差
b.量取HCl溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
③若改用60mL 0.25
 和50mL 0.55
和50mL 0.55 NaOH溶液进行反应与上述实验相比,所放出的热量
NaOH溶液进行反应与上述实验相比,所放出的热量______ (填“相等”或“不相等”),若实验操作均正确,则是否影响中和热的计算结果______ (填“偏大”、“偏小”或“不影响”)。
④若改用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热 会
会______ (填“偏大”、“偏小”或“不影响”)。
(2)通过化学键的键能计算。已知:
计算可得: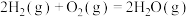

______  。
。
(3)通过盖斯定律计算。氧化亚铜()常用于制船底防污漆,已知反应:
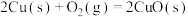

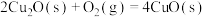

则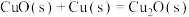 的
的
______ (用 和
和 表达)。
表达)。
(1)通过测定反应过程中所放出的热量可计算中和热。某学生分别取50mL的0.50mol/L盐酸与0.55mol/L氢氧化钠溶液进行中和反应,实验记录数据如下:

实验序号 | 起始温度 | 终止温度 | |
盐酸 | 氢氧化钠 | 混合溶液 | |
1 | 20.0 | 20.2 | 23.3 |
2 | 20.2 | 20.4 | 23.5 |
3 | 20.6 | 20.6 | 25.6 |
 ,盐酸和氢氧化钠溶液的密度都是
,盐酸和氢氧化钠溶液的密度都是 ,又知中和后生成溶液的比热容c=4.180J/(g・℃),依据该学生的实验数据计算,该实验测得的
,又知中和后生成溶液的比热容c=4.180J/(g・℃),依据该学生的实验数据计算,该实验测得的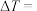


 (保留1位有效数字)。
(保留1位有效数字)。②上述实验得出的
 大于-57.3
大于-57.3 ,产生偏差的原因不可能是
,产生偏差的原因不可能是a.实验装置保温、隔热效果差
b.量取HCl溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
③若改用60mL 0.25

 和50mL 0.55
和50mL 0.55 NaOH溶液进行反应与上述实验相比,所放出的热量
NaOH溶液进行反应与上述实验相比,所放出的热量④若改用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热
 会
会(2)通过化学键的键能计算。已知:
化学键种类 |
|
|
|
键能/ | 436 | 496 | 463.4 |
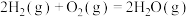

 。
。(3)通过盖斯定律计算。氧化亚铜()常用于制船底防污漆,已知反应:
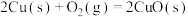

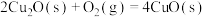

则
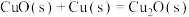 的
的
 和
和 表达)。
表达)。
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐2】50mL0.5mol·L-1的盐酸与50mL0.55mol·L-1的NaOH溶液在如图所示的位置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,可知下图装置有三处不妥之处,请指出____________ 、_____________ 、________________ 。
(2)在测定中和热的实验中,计算反应热时需要的数据有_________
①酸的浓度和体积 ②碱的浓度和体积 ③比热容 ④反应前后溶液的温度差 ⑤操作所需时间
A.①②③⑤ B.①②③④ C.②③④⑤ D.①③④⑤
(3)实验中改用60mL0.50mol·L-1的盐酸跟50mL0.55mol·L-1的NaOH溶液进行反应,与上述实验相比,所求中和热_________ (填“相等”或“不相等”),所放出的热量________ (填“相等”或“不相等”)。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会______ (填“偏大”、“偏小”或“无影响”)。

(1)从实验装置上看,可知下图装置有三处不妥之处,请指出
(2)在测定中和热的实验中,计算反应热时需要的数据有
①酸的浓度和体积 ②碱的浓度和体积 ③比热容 ④反应前后溶液的温度差 ⑤操作所需时间
A.①②③⑤ B.①②③④ C.②③④⑤ D.①③④⑤
(3)实验中改用60mL0.50mol·L-1的盐酸跟50mL0.55mol·L-1的NaOH溶液进行反应,与上述实验相比,所求中和热
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐3】某化学兴趣小组要完成中和热的测定实验。
(1)实验桌上备有大、小两个烧杯、量筒、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5mol∙L-1盐酸、0.55mol∙L-1氢氧化钠溶液,实验尚缺少的玻璃用品是_______ 。
(2)实验不能用环形铜丝搅拌棒代替环形玻璃搅拌棒,其原因是_______ 。
(3)他们记录的实验数据如表:
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18kJ∙℃-1∙kg-1,各物质的密度均为1g∙cm-3。根据实验结果写出氢氧化钠溶液与盐酸溶液反应的热化学方程式:_______ 。
(4)若用醋酸代替盐酸做实验,对测定结果_______ (填“有”或“无”)影响。
(1)实验桌上备有大、小两个烧杯、量筒、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5mol∙L-1盐酸、0.55mol∙L-1氢氧化钠溶液,实验尚缺少的玻璃用品是
(2)实验不能用环形铜丝搅拌棒代替环形玻璃搅拌棒,其原因是
(3)他们记录的实验数据如表:
| 实验用品 | 溶液温度 | 中和热 | |||
| t1 | t2 | ΔH | |||
| a | 50mL0.55mol∙L-1NaOH溶液 | 50mL0.5mol∙L-1HCl溶液 | 20℃ | 23.3℃ | |
| b | 50mL0.55mol∙L-1NaOH溶液 | 50mL0.5mol∙L-1HCl溶液 | 20℃ | 23.5℃ | |
(4)若用醋酸代替盐酸做实验,对测定结果
您最近一年使用:0次

 ℃
℃ ℃
℃




