氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。回答下列问题:
(1)已知:2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH=+181 kJ/mol
①若某反应的平衡常数表达式为K= ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:___________ ;
②下列措施能够增大此反应中NO的转化率的是(填字母代号)___________ 。
a.增大容器压强 b.升高温度 c.使用优质催化剂 d.增大CO的浓度
(2)汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g) 2NO(g),△H>0,已知该反应在240℃,平衡常数K=6.4×10-3.请回答:
2NO(g),△H>0,已知该反应在240℃,平衡常数K=6.4×10-3.请回答:
①某温度下,向2L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5mol,则N2的反应速率为___________ 。
②假定该反应是在恒容条件下进行,判断该反应达到平衡的标志___________ 。
A.消耗1mol N2同时生成1mol O2 B.气体密度不变
C.混合气体压强不变 D.2v正(N2) = v逆(NO)
③将N2、O2的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是___________ (填字母序号)。
A. B.
B. C.
C.
④240℃,某时刻测得容器内N2、O2、NO的浓度分别为0.25mol/L、0.04mol/L和0.0030mol/L,此时反应___________ (填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”)。
(1)已知:2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH=+181 kJ/mol
①若某反应的平衡常数表达式为K=
 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:②下列措施能够增大此反应中NO的转化率的是(填字母代号)
a.增大容器压强 b.升高温度 c.使用优质催化剂 d.增大CO的浓度
(2)汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)
 2NO(g),△H>0,已知该反应在240℃,平衡常数K=6.4×10-3.请回答:
2NO(g),△H>0,已知该反应在240℃,平衡常数K=6.4×10-3.请回答:①某温度下,向2L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5mol,则N2的反应速率为
②假定该反应是在恒容条件下进行,判断该反应达到平衡的标志
A.消耗1mol N2同时生成1mol O2 B.气体密度不变
C.混合气体压强不变 D.2v正(N2) = v逆(NO)
③将N2、O2的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是
A.
 B.
B. C.
C.
④240℃,某时刻测得容器内N2、O2、NO的浓度分别为0.25mol/L、0.04mol/L和0.0030mol/L,此时反应
更新时间:2021-04-26 08:11:43
|
【知识点】 化学反应原理综合考查解读
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】研究碳、氮、硫等元素化合物的性质或转化对建设生态文明,美丽中国具有重要意义。
(1)海水中无机碳的存在形式及分布如图所示:
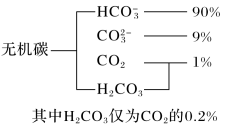
用离子方程式表示海水呈弱碱性的原因__ 。已知春季海水pH=8.1,预测夏季海水碱性将会__ (填“增强”或“减弱”)
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)⇌CH3OH(g) ΔH<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是__ (填字母)。
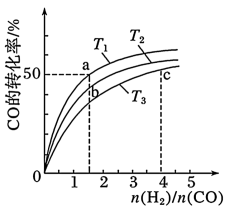
A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.a点状态下再通入0.5molCO和0.5molCH3OH,平衡不移动
D.c点状态下再通入1molCO和4molH2,新平衡中H2的体积分数增大
(3)NO加速臭氧层被破坏,其反应过程如图所示:
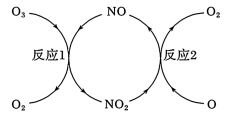
①NO的作用是__ 。
②已知:
O3(g)+O(g)=2O2(g) ΔH=-143kJ·mol-1
反应1:O3(g)+NO(g)=NO2(g)+O2(g) ΔH1=-200.2kJ·mol-1。
反应2:热化学方程式为__ 。
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g) N2(g)+2CO2(g) ΔH=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随
N2(g)+2CO2(g) ΔH=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随 的变化曲线如图。
的变化曲线如图。
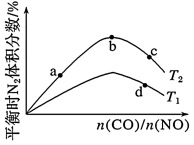
①b点时,平衡体系中C、N原子个数之比接近___ 。
②a、b、c三点CO的转化率从大到小的顺序为__ ;a、c、d三点的平衡常数从大到小的顺序为___ 。
③若 =0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为
=0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为___ 。
(1)海水中无机碳的存在形式及分布如图所示:

用离子方程式表示海水呈弱碱性的原因
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)⇌CH3OH(g) ΔH<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是

A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.a点状态下再通入0.5molCO和0.5molCH3OH,平衡不移动
D.c点状态下再通入1molCO和4molH2,新平衡中H2的体积分数增大
(3)NO加速臭氧层被破坏,其反应过程如图所示:

①NO的作用是
②已知:
O3(g)+O(g)=2O2(g) ΔH=-143kJ·mol-1
反应1:O3(g)+NO(g)=NO2(g)+O2(g) ΔH1=-200.2kJ·mol-1。
反应2:热化学方程式为
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)
 N2(g)+2CO2(g) ΔH=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随
N2(g)+2CO2(g) ΔH=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随 的变化曲线如图。
的变化曲线如图。
①b点时,平衡体系中C、N原子个数之比接近
②a、b、c三点CO的转化率从大到小的顺序为
③若
 =0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为
=0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】我国科研人员成功研制出一条从二氧化碳合成淀粉的途径,其中第一步为 ,为推进“碳达峰”和“碳中和”目标实现的技术路线提供了一种新思路。
,为推进“碳达峰”和“碳中和”目标实现的技术路线提供了一种新思路。
(1)计算机模拟该反应的反应历程如下图所示,其中吸附在催化剂上面的物质用“*”标注,“TS”表示过渡状态。

①

_______  。
。
②该反应历程中反应速率最快步骤的化学方程式为_______ 。
(2)实验研究表明,其他条件相同时,使用分子筛(分子筛能选择性分离出水蒸气)能有效提高甲醇的平衡产率,其原因是_______ 。
(3)540K下,分别按初始投料比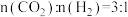 ,
,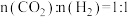 ,
, 进行该反应,得到不同压强下
进行该反应,得到不同压强下 的平衡转化率关系如图甲:
的平衡转化率关系如图甲:

①投料比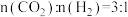 的曲线为
的曲线为_______ (填“a”、“b”或“c”)。
②该反应压强平衡常数的表达式
_______ 0(用平衡分压代替平衡浓度)。
③已知540K下该反应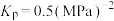 ,某时刻测得某容器内
,某时刻测得某容器内 ,
, ,
,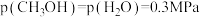 ,此时v(正)
,此时v(正)_______ v(逆)(填“>”、“=”或“<”)。
(4)目前,科研人员在研究光电催化 还原为甲醇的领域也取得了一定的进展,其原理如图乙所示,则生成甲醇的电极反应式为
还原为甲醇的领域也取得了一定的进展,其原理如图乙所示,则生成甲醇的电极反应式为_______ 。

 ,为推进“碳达峰”和“碳中和”目标实现的技术路线提供了一种新思路。
,为推进“碳达峰”和“碳中和”目标实现的技术路线提供了一种新思路。(1)计算机模拟该反应的反应历程如下图所示,其中吸附在催化剂上面的物质用“*”标注,“TS”表示过渡状态。

①


 。
。②该反应历程中反应速率最快步骤的化学方程式为
(2)实验研究表明,其他条件相同时,使用分子筛(分子筛能选择性分离出水蒸气)能有效提高甲醇的平衡产率,其原因是
(3)540K下,分别按初始投料比
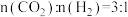 ,
,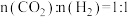 ,
, 进行该反应,得到不同压强下
进行该反应,得到不同压强下 的平衡转化率关系如图甲:
的平衡转化率关系如图甲:
①投料比
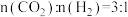 的曲线为
的曲线为②该反应压强平衡常数的表达式

③已知540K下该反应
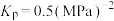 ,某时刻测得某容器内
,某时刻测得某容器内 ,
, ,
,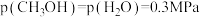 ,此时v(正)
,此时v(正)(4)目前,科研人员在研究光电催化
 还原为甲醇的领域也取得了一定的进展,其原理如图乙所示,则生成甲醇的电极反应式为
还原为甲醇的领域也取得了一定的进展,其原理如图乙所示,则生成甲醇的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】CO2的利用是国际社会普遍关注的问题。
(1)CO2的电子式是__________
(2)CO2在催化剂作用下可以直接转化为乙二醇和甲醇,但若反应温度过高,乙二醇会深度加氢生成乙醇。

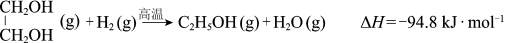
获取乙二醇的反应历程可分为如下2步:
I.
II.EC加氢能生成乙二醇与甲醇。
①步骤II的热化学方程式是__________ ;
②研究反应温度对EC加氢的影响(反应时间均为4小时),实验数据见下表:
由上表可知,温度越高,EC的转化率越高,原因是__________ 。温度升高到220℃时,乙二醇的产率反而降低,原因是__________
(3)用稀硫酸作电解质溶液,电解CO2可制取甲醇,装置如下图所示,电极 a 接电源的__________ 极(填“正”或“负”),生成甲醇的电极反应式是__________

(4)CO2较稳定、能量低。为实现CO2的高效使用,下列研究方向合理的是__________ (填序号)。
a.降低CO2参与反应的速率和比例
b.利用电能、光能或热能预先活化CO2分子
c.选择高效的催化剂降低反应条件
(1)CO2的电子式是
(2)CO2在催化剂作用下可以直接转化为乙二醇和甲醇,但若反应温度过高,乙二醇会深度加氢生成乙醇。

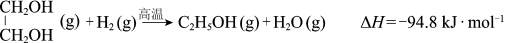
获取乙二醇的反应历程可分为如下2步:
I.

II.EC加氢能生成乙二醇与甲醇。
①步骤II的热化学方程式是
②研究反应温度对EC加氢的影响(反应时间均为4小时),实验数据见下表:
| 反应温度/℃ | EC转化率/ % | 产率/% | |
| 乙二醇 | 甲醇 | ||
| 160 | 23.8 | 23.2 | 12.9 |
| 180 | 62.1 | 60.9 | 31.5 |
| 200 | 99.9 | 94.7 | 62.3 |
| 220 | 99.9 | 92.4 | 46.1 |
(3)用稀硫酸作电解质溶液,电解CO2可制取甲醇,装置如下图所示,电极 a 接电源的

(4)CO2较稳定、能量低。为实现CO2的高效使用,下列研究方向合理的是
a.降低CO2参与反应的速率和比例
b.利用电能、光能或热能预先活化CO2分子
c.选择高效的催化剂降低反应条件
您最近一年使用:0次



