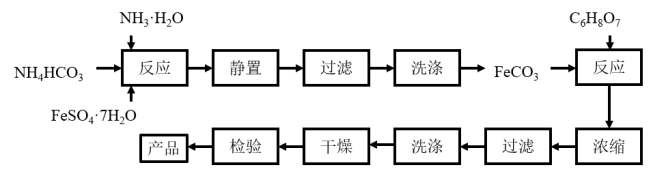
柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,某研究团队制备柠檬酸亚铁的流程如图:
已知:
I.第一步化学反应原理为: FeSO4+ NH4HCO3+ NH3·H2O=FeCO3↓+ (NH)2SO4+ H2O
II.几种多元弱酸的电离常数见表1 (25℃)
Ⅲ.相关金属离子生成氢氧化物沉淀的pH见表2 (开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)
下列说法正确的是

已知:
I.第一步化学反应原理为: FeSO4+ NH4HCO3+ NH3·H2O=FeCO3↓+ (NH)2SO4+ H2O
II.几种多元弱酸的电离常数见表1 (25℃)
Ⅲ.相关金属离子生成氢氧化物沉淀的pH见表2 (开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)
| 表1:弱酸电离常数 | |
| 弱酸 | 电离常数 |
| 碳酸H2CO3 | Kal=4.4 ×10-7,Ka2=4.7 ×10-11 |
| 柠檬酸C6H8O7 | Ka1=7.4 ×10-4,Ka2= 1.73 ×10-5, Ka3=4 ×10-7 |
| 表2:金属离子沉淀的pH | ||
| 金属离子 | 开始沉淀的 pH | 沉淀 完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
| A.将FeSO4·7H2O加入NH4HCO3、氨水碱性混合液中制得FeCO3 |
B.可用NH4HCO3溶液洗涤滤渣,以除去FeCO3表面的SO |
| C.生成柠檬酸亚铁的反应为FeCO3 + C6H8O7= FeC6H6O7+ CO2↑+ H2O |
| D.柠檬酸亚铁是正盐 |
更新时间:2021-07-15 17:48:13
|
【知识点】 酸碱理论和水溶液中的离子平衡
相似题推荐
多选题
|
较难
(0.4)
【推荐1】已知25°C时,Ksp[Mg(OH)2]=5.61×10 -12, Ksp[Al(OH)3]= 1.3×10 -33,Al(OH)3+H2O =Al(OH) +H+,Ka=6.31 ×10-13.某溶液中可能含有H+、Na+、 Mg2+、 Al3+、C1-、HCO
+H+,Ka=6.31 ×10-13.某溶液中可能含有H+、Na+、 Mg2+、 Al3+、C1-、HCO 等离子。向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示。下列有关说法正确的是
等离子。向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示。下列有关说法正确的是
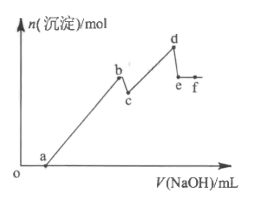
 +H+,Ka=6.31 ×10-13.某溶液中可能含有H+、Na+、 Mg2+、 Al3+、C1-、HCO
+H+,Ka=6.31 ×10-13.某溶液中可能含有H+、Na+、 Mg2+、 Al3+、C1-、HCO 等离子。向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示。下列有关说法正确的是
等离子。向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示。下列有关说法正确的是
| A.各点的化学成分: b点沉淀-Al(OH)3; d点沉淀 - Al(OH)3和Mg(OH)2; e点溶质- NaCl 和NaAl(OH)4 |
B.各段只发生如下反应: ab段: A13++3OH-=Al(OH)3↓;cd段;Mg2++2OH-=Mg(OH)2↓; de段: Al(OH)3+OH-=Al(OH) |
| C.依题意,用NaOH不能完全分离Al3+和Mg2+离子 |
| D.bc段Al(OH)3部分溶解 |
您最近一年使用:0次
多选题
|
较难
(0.4)
【推荐2】常温下,H2C2O4 的电离常数: Ka1=5.4 ×10-2, Ka2=5.4 ×10-5. 在Vm mL0.1 mol·L-1H2C2O4 溶液中滴加0.1 mol·L-1 KOH溶液,混合溶液中水电离的c 水(H+)与KOH溶液体积V的关系如图所示。下列说法正确的是
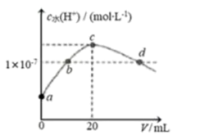

| A.Vm=10 |
B.d点对应的溶液中存在: c(K+)= c(HC2O ) + 2c(C2O ) + 2c(C2O ) ) |
| C.常温下加水稀释b点对应的溶液,稀释后溶液pH < 7 |
D.常温下,C2O + H2O= HC2O + H2O= HC2O + OH-的Kh1≈2 × 10-10 + OH-的Kh1≈2 × 10-10 |
您最近一年使用:0次
多选题
|
较难
(0.4)
名校
解题方法
【推荐3】经测定某溶液中离子只有Na+、Ac-、H+、OH―四种,且离子浓度大小的排列顺序为:c(Ac-)>c(Na+)>c(H+)>c(OH-)。其可能的情形是
| A.该溶液由pH=3的HAc与pH=11的NaOH溶液等体积混合而成 |
| B.0.2mol/L的HAc溶液与0.1mol/L的NaOH溶液等体积混合 |
| C.在上述溶液中加入适量NaOH,可能使溶液中离子浓度大小改变为:c(Ac-)>c(Na+) >c(OH-) >c(H+) |
| D.该溶液由0.1mol/L的HAc溶液与等物质的量浓度等体积的NaOH溶液混合而成 |
您最近一年使用:0次



