现有一瓶澄清溶液,其中可能含有H+、NH 、Mg2+、Ba2+、Al3+、I-、NO
、Mg2+、Ba2+、Al3+、I-、NO 、CO
、CO 、SO
、SO 、AlO
、AlO 等。取该溶液进行以下实验:
等。取该溶液进行以下实验:
(1)取pH试纸检验,溶液呈酸性,可以排除___________ 的存在。
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,充分振荡后CCl4层呈紫色,可以排除___________ 的存在,用离子方程式说明原因___________ 。
(3)另取出部分溶液,逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,反应过程中均无沉淀产生,又可排除___________ 的存在。
(4)取出部分上述碱性溶液,加Na2CO3溶液后,有白色沉淀生成,证明有___________ 的存在,又可以排除___________ 的存在。
(5)根据上述实验事实,还不能确定是否存在的离子是___________ 。
 、Mg2+、Ba2+、Al3+、I-、NO
、Mg2+、Ba2+、Al3+、I-、NO 、CO
、CO 、SO
、SO 、AlO
、AlO 等。取该溶液进行以下实验:
等。取该溶液进行以下实验:(1)取pH试纸检验,溶液呈酸性,可以排除
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,充分振荡后CCl4层呈紫色,可以排除
(3)另取出部分溶液,逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,反应过程中均无沉淀产生,又可排除
(4)取出部分上述碱性溶液,加Na2CO3溶液后,有白色沉淀生成,证明有
(5)根据上述实验事实,还不能确定是否存在的离子是
更新时间:2021-07-23 08:30:14
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】(1)某学习小组通过实验研究Na2O2与水的反应。
①Na2O2的电子式为____________ ,它与水反应的离子方程式是_____________ 。
②甲同学认为ⅱ中溶液褪色是溶液a中存在较多的H2O2,H2O2与酚酞发生了反应,并实验证实了H2O2的存在:取少量溶液a,加入试剂_________ (填化学式),有气体产生。
(2)有一瓶澄清的溶液,可有含有大量的NO3-、Fe3+、NH4+、H+、K+、Mg2+、Al3+、SO42-、Ba2+、CO32-、Cl-、I-,现进行如下实验:
①测知溶液显酸性;
②取样加少量四氯化碳和数滴新制氯水,四氯化碳层溶液呈紫红色;
③另取样滴加稀NaOH溶液,使深液变为碱性,此过程中无沉淀生成;
④取少量上述碱性溶液,加Na2CO3溶液出现白色沉淀;
⑤将实验③中的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
由此可以推断:
溶液中肯定存在的离子有________________ 。溶液中不能确定是否存在的离子有_____________ 。
| 操作 | 现象 |
| 向盛有4.0g Na2O2的烧杯中加入50mL蒸馏水 | 剧烈反应,产生能使带火星木条复燃的气体,得到的无色溶液a |
| 向溶液a中滴入两滴酚酞 | ⅰ.溶液变红 ⅱ.10分钟后溶液颜色明显变浅,稍后,溶液变为无色 |
②甲同学认为ⅱ中溶液褪色是溶液a中存在较多的H2O2,H2O2与酚酞发生了反应,并实验证实了H2O2的存在:取少量溶液a,加入试剂
(2)有一瓶澄清的溶液,可有含有大量的NO3-、Fe3+、NH4+、H+、K+、Mg2+、Al3+、SO42-、Ba2+、CO32-、Cl-、I-,现进行如下实验:
①测知溶液显酸性;
②取样加少量四氯化碳和数滴新制氯水,四氯化碳层溶液呈紫红色;
③另取样滴加稀NaOH溶液,使深液变为碱性,此过程中无沉淀生成;
④取少量上述碱性溶液,加Na2CO3溶液出现白色沉淀;
⑤将实验③中的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
由此可以推断:
溶液中肯定存在的离子有
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】现有300mL某无色溶液,可能含有以下离子中的若干种:K+、 、Fe2+、Ba2+、Cl-、
、Fe2+、Ba2+、Cl-、 、
、 ,将该溶液分为三等份进行以下实验:
,将该溶液分为三等份进行以下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加足量NaOH溶液加热后,收集到672mL(已转化为标况下的体积)气体;
第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。
根据上述实验,回答以下问题。
(1)肯定不存在的离子有_____________________ 。
(2)可能存在的离子是_____________ ,判断该离子存在与否的操作是__________________ 。
(3)计算肯定存在的阳离子在原溶液中的物质的量浓度________________ 。
 、Fe2+、Ba2+、Cl-、
、Fe2+、Ba2+、Cl-、 、
、 ,将该溶液分为三等份进行以下实验:
,将该溶液分为三等份进行以下实验:第一份加入AgNO3溶液有沉淀产生;
第二份加足量NaOH溶液加热后,收集到672mL(已转化为标况下的体积)气体;
第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。
根据上述实验,回答以下问题。
(1)肯定不存在的离子有
(2)可能存在的离子是
(3)计算肯定存在的阳离子在原溶液中的物质的量浓度
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】Ⅰ.现有以下物质:①NaOH 溶液②液氨③BaCO3 固体④熔融 K2SO4⑤氢氧化铁胶体⑥铜⑦CO2⑧冰醋酸 CH3COOH⑨饱和 NaHCO3 溶液⑩蔗糖。按要求回答问题:
(1)非电解质的是___________ (填序号),强电解质的是___________ (填序号)
(2)写出⑨和⑧的水溶液反应的离子方程式___________ 。
(3)⑤的实验室制备方法:向沸水中滴加几滴饱和 FeCl3 溶液,加热至液体呈红褐色,停止加热;其化学方程式为___________ 。
Ⅱ.有一瓶澄清的溶液其中可能含 H+ 、Mg2+、Na+、Ba2+、NO 、CO
、CO 、SO
、SO 有取该溶液进行以下实验:
有取该溶液进行以下实验:
①用 pH 试纸检验,表明溶液呈强酸性。
②取出部分溶液逐滴加入 NaOH 溶液,使溶液从酸性逐渐变为碱性,继续滴加 NaOH 溶液, 有白色沉淀产生。
③取部分上述碱性溶液加 Na2CO3 溶液,有白色沉淀生成。
(4)根据上述实验事实还能确定溶液中肯定不存在的离子是___________ ,不能确定是否存在的离子为___________ ,检验该离子的方法名称为___________ 。
(1)非电解质的是
(2)写出⑨和⑧的水溶液反应的离子方程式
(3)⑤的实验室制备方法:向沸水中滴加几滴饱和 FeCl3 溶液,加热至液体呈红褐色,停止加热;其化学方程式为
Ⅱ.有一瓶澄清的溶液其中可能含 H+ 、Mg2+、Na+、Ba2+、NO
 、CO
、CO 、SO
、SO 有取该溶液进行以下实验:
有取该溶液进行以下实验:①用 pH 试纸检验,表明溶液呈强酸性。
②取出部分溶液逐滴加入 NaOH 溶液,使溶液从酸性逐渐变为碱性,继续滴加 NaOH 溶液, 有白色沉淀产生。
③取部分上述碱性溶液加 Na2CO3 溶液,有白色沉淀生成。
(4)根据上述实验事实还能确定溶液中肯定不存在的离子是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】加碘食盐中加入的KIO3是一种白色晶体,常温下很稳定,加热至560℃才开始分解。工业生产碘酸钾的流程如下:

(1)已知“反应”的化学方程式为6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑,用单线桥标出该反应中电子转移的方向和数目______ 。
(2)由KClO3固体配制0.050 mol·L-1 KClO3溶液,下列操作可能使所配KClO3溶液浓度偏小的是______ (填写字母)。

a.稀释和转移用的烧杯、玻璃棒未洗涤
b.如图所示,定容时俯视容量瓶的刻度线
c.配溶液前容量瓶中有少量蒸馏水
d.加水时超过刻度线,用胶头滴管吸出多余的液体
(3)某加碘盐用KI代替KIO3,请设计检验加碘盐中含有I-的实验方案:______ 。实验中可供选择的试剂:淀粉溶液、FeCl3溶液。
(4)为测定某加碘盐中碘元素的含量,实验过程为:称取加碘盐20.00 g于锥形瓶中,加水溶解,向其中加入过量的KI溶液和适量的稀硫酸,充分反应,用0.0010 mol·L-1 Na2S2O3溶液滴定,恰好完全反应时消耗Na2S2O3溶液体积为30.00 mL。计算20.00 g该加碘盐中碘元素的质量______ (质量单位以mg记,并写出计算过程)。测定过程中发生的反应为:5KI+KIO3+3H2SO4=3I2+3K2SO4+3H2O;I2+2Na2S2O3=2NaI+Na2S4O6

(1)已知“反应”的化学方程式为6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑,用单线桥标出该反应中电子转移的方向和数目
(2)由KClO3固体配制0.050 mol·L-1 KClO3溶液,下列操作可能使所配KClO3溶液浓度偏小的是

a.稀释和转移用的烧杯、玻璃棒未洗涤
b.如图所示,定容时俯视容量瓶的刻度线
c.配溶液前容量瓶中有少量蒸馏水
d.加水时超过刻度线,用胶头滴管吸出多余的液体
(3)某加碘盐用KI代替KIO3,请设计检验加碘盐中含有I-的实验方案:
(4)为测定某加碘盐中碘元素的含量,实验过程为:称取加碘盐20.00 g于锥形瓶中,加水溶解,向其中加入过量的KI溶液和适量的稀硫酸,充分反应,用0.0010 mol·L-1 Na2S2O3溶液滴定,恰好完全反应时消耗Na2S2O3溶液体积为30.00 mL。计算20.00 g该加碘盐中碘元素的质量
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】某固体物质可能由K2SO4、KI、NaCl、CuCl2、CaCl2、Na2CO3中的一种或几种组成。依次进行下列五步实验。观察到的现象如下:
①混合物加水得无色透明溶液
②向上述溶液中滴加BaCl2溶液,有白色沉淀生成,将该沉淀滤出,并将滤液分成两份;
③上述白色沉淀可完全溶于稀盐酸;
④往一份滤液中滴加氯水并加入CCl4,振荡后静置CCl4层呈无色;(已知氯水能将I—氧化为I2)
⑤往另一份滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀硝酸.
由此可推断出:
(1)写出③中白色沉淀可完全溶于稀盐酸的离子反应方程式______________ 。
(2)该固体中一定含有______________ ;无法确定是否含有的是__________________ 。
(3)确定该物质是否存在的方法是______________ 。
①混合物加水得无色透明溶液
②向上述溶液中滴加BaCl2溶液,有白色沉淀生成,将该沉淀滤出,并将滤液分成两份;
③上述白色沉淀可完全溶于稀盐酸;
④往一份滤液中滴加氯水并加入CCl4,振荡后静置CCl4层呈无色;(已知氯水能将I—氧化为I2)
⑤往另一份滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀硝酸.
由此可推断出:
(1)写出③中白色沉淀可完全溶于稀盐酸的离子反应方程式
(2)该固体中一定含有
(3)确定该物质是否存在的方法是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】某溶液中只含有Ba2+、Mg2+、Ag+三种阳离子,现用适量的NaOH溶液、稀盐酸和Na2SO4溶液将这三种离子逐一沉淀分离,其流程如图所示:

(1)沉淀1的化学式为__________ ,生成该沉淀的离子方程式为_______________ 。
(2)若试剂B为Na2SO4溶液,则沉淀2化学式为_______________ 。对于反应后的溶液2,怎样检验 已除去
已除去_______________ 。
(3)若试剂B为NaOH溶液,则生成沉淀2的离子方程式为_______________ 。
(4)如果原溶液中Ba2+、Mg2+、Ag+的浓度均为0.1 mol·L-1,且溶液中含有的阴离子只有 ,则溶液中
,则溶液中 浓度为
浓度为________ mol·L-1。

(1)沉淀1的化学式为
(2)若试剂B为Na2SO4溶液,则沉淀2化学式为
 已除去
已除去(3)若试剂B为NaOH溶液,则生成沉淀2的离子方程式为
(4)如果原溶液中Ba2+、Mg2+、Ag+的浓度均为0.1 mol·L-1,且溶液中含有的阴离子只有
 ,则溶液中
,则溶液中 浓度为
浓度为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐1】某蓝色溶液 中含有
中含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 离子中的若干种。某学习小组开展探究
离子中的若干种。某学习小组开展探究 成分的实验如下:
成分的实验如下:
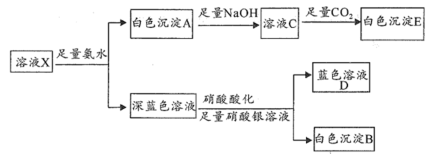
(1) 溶液中一定含有的离子是
溶液中一定含有的离子是___________ ,可能含有的离子是___________ 。
(2)写出生成沉淀 的离子方程式
的离子方程式___________ 。
(3)蓝色溶液 与
与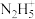 作用,生成一种气体单质,溶液蓝色褪去,同时生成易溶于硝酸的白色沉淀。
作用,生成一种气体单质,溶液蓝色褪去,同时生成易溶于硝酸的白色沉淀。
①写出该反应的离子方程式___________ 。
②设计实验验证该白色沉淀的组成元素___________ 。
 中含有
中含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 离子中的若干种。某学习小组开展探究
离子中的若干种。某学习小组开展探究 成分的实验如下:
成分的实验如下:
(1)
 溶液中一定含有的离子是
溶液中一定含有的离子是(2)写出生成沉淀
 的离子方程式
的离子方程式(3)蓝色溶液
 与
与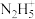 作用,生成一种气体单质,溶液蓝色褪去,同时生成易溶于硝酸的白色沉淀。
作用,生成一种气体单质,溶液蓝色褪去,同时生成易溶于硝酸的白色沉淀。①写出该反应的离子方程式
②设计实验验证该白色沉淀的组成元素
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】雾霾严重影响人们的生活与健康,某地区的雾霾中可能含有如下离子中的若干种:NH4+、Ba2+、Fe2+、Cl-、NO3-、CO32- 、SO42-.某同学收集了该地区的雾霾,经必要的预处理后得到试样溶液,设计并完成如下实验:

试回答下列问题:
(1)实验①中加入稀盐酸后,有无色气体A生成,溶液B依然澄清,且溶液中阴离子种类不变,据此可知原溶液中一定不含__________ 。(填离子符号)
(2)实验①中发生反应的离子方程式为__________________________________________ 。
(3)实验②中逐滴加入碳酸氢钠溶液,立即有气泡产生,一段时间后又有沉淀出现,这时的离子方程式为_______________________________________________ 。
(4)气体F的成分为______________ 。(填化学式)
(5)根据实验③现象该同学认为原溶液中一定含有SO42-,有其他同学认为其结论不合理,又进行了后续实验 ④,最终确认原溶液中含有SO42-,试写出实验④可行的操作方法及现象________________ 。

试回答下列问题:
(1)实验①中加入稀盐酸后,有无色气体A生成,溶液B依然澄清,且溶液中阴离子种类不变,据此可知原溶液中一定不含
(2)实验①中发生反应的离子方程式为
(3)实验②中逐滴加入碳酸氢钠溶液,立即有气泡产生,一段时间后又有沉淀出现,这时的离子方程式为
(4)气体F的成分为
(5)根据实验③现象该同学认为原溶液中一定含有SO42-,有其他同学认为其结论不合理,又进行了后续实验 ④,最终确认原溶液中含有SO42-,试写出实验④可行的操作方法及现象
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】(1)实验室有一包明矾,某同学拟通过实验检验明矾中含有K+、Al3+、SO42-等3种离子。请按要求回答以下问题:
该同学将适量明矾溶于水制成溶液,并把溶液分成三份。他用第1份溶液来检验K+的操作方法是用洁净的铂丝蘸取待测溶液,在酒精灯火焰上灼烧,透过蓝色钴玻璃观察其焰色为____________ 色。
(2)他用第2份溶液来检验Al3+,则他可选用的反应试剂为______________ ,判断含有Al3+存在的现象为_____ ,沉淀溶解的化学方程式为______________ 。在检验SO42-时,该同学可选用的试剂为_________ 。
该同学将适量明矾溶于水制成溶液,并把溶液分成三份。他用第1份溶液来检验K+的操作方法是用洁净的铂丝蘸取待测溶液,在酒精灯火焰上灼烧,透过蓝色钴玻璃观察其焰色为
(2)他用第2份溶液来检验Al3+,则他可选用的反应试剂为
您最近一年使用:0次



