用50mL0.50mol/L的盐酸与50mL0.55mol/L的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答问题:
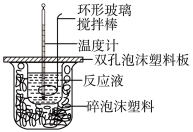
(1)烧杯间填满碎泡沫塑料的作用是___________ ;
(2)实验中若改用60mL0.50mol/L的盐酸与50mL0.55mol/L的氢氧化钠溶液进行反应,与上述实验相比,所放出的热量___________ (填“相等”或“不相等”),若实验操作均正确,则所求中和热___________ (填“相等”或“不相等”);
(3)已知在稀溶液中,强酸和强碱发生中和反应生成1mol水时,放出57.3kJ的热量,则上述反应的热化学方程式为:___________ 。
(4)倒入NaOH溶液的正确操作是___________ 。(填字母)
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(5)某同学利用实验数据计算出的中和热与57.3kJ/mol有偏差,产生偏差的原因可能是___________ 。(填字母)
a.实验装置保温、隔热效果差;
b.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度;
c.量取NaOH溶液的体积时仰视读数;
d.倒完NaOH溶液后,发现装NaOH烧杯内有极少量残留液。

(1)烧杯间填满碎泡沫塑料的作用是
(2)实验中若改用60mL0.50mol/L的盐酸与50mL0.55mol/L的氢氧化钠溶液进行反应,与上述实验相比,所放出的热量
(3)已知在稀溶液中,强酸和强碱发生中和反应生成1mol水时,放出57.3kJ的热量,则上述反应的热化学方程式为:
(4)倒入NaOH溶液的正确操作是
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(5)某同学利用实验数据计算出的中和热与57.3kJ/mol有偏差,产生偏差的原因可能是
a.实验装置保温、隔热效果差;
b.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度;
c.量取NaOH溶液的体积时仰视读数;
d.倒完NaOH溶液后,发现装NaOH烧杯内有极少量残留液。
20-21高二上·广东揭阳·阶段练习 查看更多[6]
浙江省海盐第二高级中学2022-2023学年高二上学期10月第一阶段检测化学试题云南省昆明师范专科学校附属中学2022-2023学年高二上学期期中考试化学试题安徽省肥东凯悦中学2021-2022学年高二上学期第一次月考化学试题(已下线)选择性必修1 综合检测(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)江苏省海安市南莫中学2021-2022学年高二上学期第一次月考备考金卷A卷化学试题广东省揭阳市揭西县河婆中学2020-2021学年高二上学期第一次月考化学试题
更新时间:2021-07-27 23:02:04
|
【知识点】 中和热的测定与误差分析解读
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】(1)已知乙醇的燃烧热为﹣1366.8 kJ/mol,写出相应的热化学方程式_____________ 。
(2)已知强酸强碱的中和热为﹣57.3kJ/mol,写出稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式:___________________________________ 。
(3)已知16g硫固体完全燃烧时放出148.4kJ的热量,则硫的燃烧热的热化学方程式:_____________ 。
(4)已知:101 kPa时,2C(s)+O2(g)═2CO(g)ΔH=﹣221 kJ/mol,则碳的燃烧热数值___ 110.5 kJ/mol(填>,<,=)。
(5)已知:稀溶液中,H+(aq)+OH﹣(aq)═H2O(l)ΔH=﹣57.3 kJ/mol,则浓硫酸与稀NaOH溶液反应生成1 mol水,放出的热量___ 57.3 kJ(填>,<,=)。
(2)已知强酸强碱的中和热为﹣57.3kJ/mol,写出稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式:
(3)已知16g硫固体完全燃烧时放出148.4kJ的热量,则硫的燃烧热的热化学方程式:
(4)已知:101 kPa时,2C(s)+O2(g)═2CO(g)ΔH=﹣221 kJ/mol,则碳的燃烧热数值
(5)已知:稀溶液中,H+(aq)+OH﹣(aq)═H2O(l)ΔH=﹣57.3 kJ/mol,则浓硫酸与稀NaOH溶液反应生成1 mol水,放出的热量
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】I.按要求完成下列问题:
(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的△H(化学计量数相同)分别为△H1、△H2,△H1_______ △H2(填“>”“<”或“=”)。
(2)有机物M经过太阳光光照可转化成N,转化过程如下:
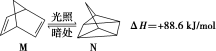
则M、N相比,较稳定的是_______ 。
(3)已知N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ·mol-1
则N2H4(g)与NO2(g)完全反应生成N2(g)和H2O(g)的热化学方程式为_______ 。
II.利用如图装置测定中和热的实验步骤如下:

①用量筒量取50mL0.25mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL0.55mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(4)从实验装置上看,图中尚缺少的一种玻璃仪器是_______ 。
(5)倒入NaOH溶液的正确操作是_______ (从下列选项中选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(6)实验数据如表:
近似认为0.55mol·L-1NaOH溶液和0.25mol·L-1硫酸溶液的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18J·g-1·℃-1。则中和热ΔH=_______ (取小数点后一位)。
(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的△H(化学计量数相同)分别为△H1、△H2,△H1
(2)有机物M经过太阳光光照可转化成N,转化过程如下:

则M、N相比,较稳定的是
(3)已知N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ·mol-1
则N2H4(g)与NO2(g)完全反应生成N2(g)和H2O(g)的热化学方程式为
II.利用如图装置测定中和热的实验步骤如下:

①用量筒量取50mL0.25mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL0.55mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(4)从实验装置上看,图中尚缺少的一种玻璃仪器是
(5)倒入NaOH溶液的正确操作是
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(6)实验数据如表:
| 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | ||
| H2SO4 | NaOH | 平均值 | ||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 |
近似认为0.55mol·L-1NaOH溶液和0.25mol·L-1硫酸溶液的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18J·g-1·℃-1。则中和热ΔH=
您最近半年使用:0次
【推荐3】化学反应伴随能量变化,获取反应能量变化有多种途径。
(1)下列反应中,属于吸热反应的是___________(填字母)。
(2)获取能量变化的途径
①通过化学键的键能计算。已知:
则2H2(g)+O2(g)=2H2O(g)ΔH=___________ kJ·mol-1。
②通过物质所含能量计算。
已知反应A+B=C+D中A、B、C、D所含能量依次可表示为EA、EB、EC、ED,该反应ΔH=___________ 。
③通过盖斯定律计算。已知在25℃、101kPa时:
Ⅰ.2Na(s)+ O2(g)=Na2O(s)ΔH=-414kJ·mol-1
O2(g)=Na2O(s)ΔH=-414kJ·mol-1
Ⅱ.2Na(s)+O2(g)=Na2O2(s)ΔH=-511kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式:___________ 。
④利用实验装置测量。测量盐酸与NaOH溶液反应的热量变化的过程中,若取50mL0.50mol·L-1盐酸,则还需加入___________ (填字母)。
A.50mL0.50mol·L-1NaOH溶液
B.50mL0.55mol·L-1NaOH溶液
C.1.0gNaOH固体
(1)下列反应中,属于吸热反应的是___________(填字母)。
| A.Na2O与水反应 | B.甲烷的燃烧反应 | C.CaCO3受热分解 | D.锌与盐酸反应 |
①通过化学键的键能计算。已知:
| 化学键 | H—H | O=O | O—H |
| 键能/(kJ·mol-1) | 436 | 498 | 463.4 |
②通过物质所含能量计算。
已知反应A+B=C+D中A、B、C、D所含能量依次可表示为EA、EB、EC、ED,该反应ΔH=
③通过盖斯定律计算。已知在25℃、101kPa时:
Ⅰ.2Na(s)+
 O2(g)=Na2O(s)ΔH=-414kJ·mol-1
O2(g)=Na2O(s)ΔH=-414kJ·mol-1Ⅱ.2Na(s)+O2(g)=Na2O2(s)ΔH=-511kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式:
④利用实验装置测量。测量盐酸与NaOH溶液反应的热量变化的过程中,若取50mL0.50mol·L-1盐酸,则还需加入
A.50mL0.50mol·L-1NaOH溶液
B.50mL0.55mol·L-1NaOH溶液
C.1.0gNaOH固体
您最近半年使用:0次



