某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1 H2SO4溶液进行中和热的测定。测定稀硫酸和稀氢氧化钠反应的中和热的实验装置如图所示:
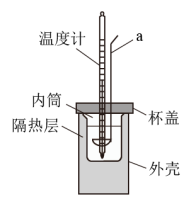
(1)仪器a的名称为___________ 。
(2)写出表示该反应中和热的热化学方程式:___________ 。
(3)步骤三中倒入NaOH溶液的正确操作是___________ 。
A. 沿玻璃棒缓慢倒入 B. 分三次少量倒入 C. 一次迅速倒入
(4)使硫酸与NaOH溶液混合均匀的正确操作是___________(填序号)。
(5)取50 mL NaOH溶液和30 mL H2SO4溶液进行实验,实验数据如下表。
①温度差的平均值为___________ ℃。
②近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1 H2SO4溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·(g·℃)-1.则测得的中和热ΔH=___________ (取小数点后一位)。
③上述结果与57.3 kJ·mol-1有偏差,产生此偏差的原因可能是___________ (填字母)。
a. 实验装置保温、隔热效果差
b. 量取NaOH溶液的体积时仰视读数
c. 一次性把NaOH溶液倒入盛有H2SO4溶液的小烧杯中
d. 用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度

(1)仪器a的名称为
(2)写出表示该反应中和热的热化学方程式:
(3)步骤三中倒入NaOH溶液的正确操作是
A. 沿玻璃棒缓慢倒入 B. 分三次少量倒入 C. 一次迅速倒入
(4)使硫酸与NaOH溶液混合均匀的正确操作是___________(填序号)。
| A.轻轻地振荡烧杯 | B.揭开硬纸片用玻璃棒搅拌 |
| C.用温度计小心搅拌 | D.用套在温度计上的a轻轻地搅动 |
| 实验 次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.6 | 26.6 | 26.6 | 29.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1 H2SO4溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·(g·℃)-1.则测得的中和热ΔH=
③上述结果与57.3 kJ·mol-1有偏差,产生此偏差的原因可能是
a. 实验装置保温、隔热效果差
b. 量取NaOH溶液的体积时仰视读数
c. 一次性把NaOH溶液倒入盛有H2SO4溶液的小烧杯中
d. 用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
更新时间:2021-10-23 11:02:21
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
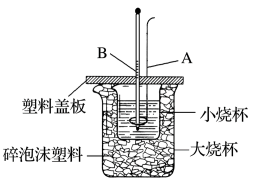
【推荐1】利用如图所示装置测定中和热的实验步骤如图:
①用量筒量取50mL050mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50mL0.55mol·L-1NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)写出A的名称A:___
(2)现将一定量的稀氢氧化钠溶液、稀氢氧化钡溶液、稀氨水分别和1L1mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为___
(3)假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·C-1。为了计算中和热,某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热ΔH___ (结果保留一位小数)。
(4)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下2gSiH4自燃放出热量89.2kJ。SiH4自燃的热化学方程式为___ 。

①用量筒量取50mL050mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50mL0.55mol·L-1NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)写出A的名称A:
(2)现将一定量的稀氢氧化钠溶液、稀氢氧化钡溶液、稀氨水分别和1L1mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为
(3)假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·C-1。为了计算中和热,某学生实验记录数据如下:
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
(4)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下2gSiH4自燃放出热量89.2kJ。SiH4自燃的热化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50mL0.50mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50mL0.55mol·L-1NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,使之混合均匀,测得混合溶液最高温度。回答下列问题:
(1)所用NaOH溶液要稍过量,理由是___________ 。
(2)如图装置中碎泡沫塑料及泡沫塑料板的作用是___________ 。
(3)环形玻璃搅拌棒搅拌溶液的操作是___________ 。
(4)假设盐酸和NaOH溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·°C-1。为了计算中和热,某学生实验记录数据如表所示:
依据该学生的实验数据计算,该实验测得的中和热|△H|=___________ (小数点后保留1位数字)。
(5)________ (选填“能”或“不能”)用Ba(OH)2溶液和H2SO4溶液代替NaOH溶液和盐酸,理由是____________ 。
(6)现将一定量的稀NaOH溶液、Ca(OH)2溶液、稀氨水分别和1L1mol·L-1的盐酸恰好完全反应,其反应热分别为△H1、△H2、△H3,则△H1、△H2、△H3的大小关系为___________ 。

①用量筒量取50mL0.50mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50mL0.55mol·L-1NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,使之混合均匀,测得混合溶液最高温度。回答下列问题:
(1)所用NaOH溶液要稍过量,理由是
(2)如图装置中碎泡沫塑料及泡沫塑料板的作用是
(3)环形玻璃搅拌棒搅拌溶液的操作是
(4)假设盐酸和NaOH溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·°C-1。为了计算中和热,某学生实验记录数据如表所示:
| 实验序号 | 起始温度T1/°C | 终止温度T2/°C | |
| 盐酸 | NaOH溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
(5)
(6)现将一定量的稀NaOH溶液、Ca(OH)2溶液、稀氨水分别和1L1mol·L-1的盐酸恰好完全反应,其反应热分别为△H1、△H2、△H3,则△H1、△H2、△H3的大小关系为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】(1)某小组拟用酸性KMnO4溶液与H2C2O4溶液的反应(此反应为放热反应)来探究“条件对化学反应速率的影响,并设计了如下的方案记录实验结果(忽略溶液混合体积变化)。
限选试剂和仪器:0.20 mol/L H2C2O4溶液、0.010 mol/L KMnO4溶液(酸性)、MnSO4、蒸馏水、试管、量筒、秒表、恒温水浴槽。
回答下列问题:
①写出上述反应的离子方程式:________________________ 。
②上述实验①②是探究____________ 对化学反应速率的影响;上述实验②④是探究____________ 对化学反应速率
影响。若上述实验②③是探究浓度对化学反应速率的影响,则a为______________ ;表格中的“乙”填写t/s,其测量的是______________________ 。
③实验①中对“乙”重复测量三次,所得数值分别13.6,13.5,13.4。忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=___________ 。
④已知实验①50℃时c(MnO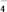 )~反应时间t的变化曲线如图I。若保持其他条件不变,请在坐标图中,画出实验②25℃时c(MnO
)~反应时间t的变化曲线如图I。若保持其他条件不变,请在坐标图中,画出实验②25℃时c(MnO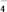 )~t的变化曲线示意图。
)~t的变化曲线示意图。______________

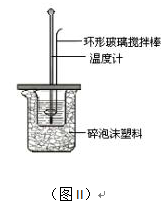
(2)测定中和热的实验装置如图II所示。
①写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式_______________________ (中和热数值为57.3 kJ/mol):
②取60mL0.50mol/L NaOH溶液和50mL0.50mol/L硫酸溶液进行实验,实验数据如下表。
近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热△H=________________________ kJ/mol(列出计算式)。
③能引起中和热偏高的原因是(填字母)__________ 。
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.用50mL0.50mol/L醋酸代替了硫酸进行反应,
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
E. 量取硫酸溶液的体积时仰视读数
限选试剂和仪器:0.20 mol/L H2C2O4溶液、0.010 mol/L KMnO4溶液(酸性)、MnSO4、蒸馏水、试管、量筒、秒表、恒温水浴槽。
物理量 编号 | V(0.20 mol/L H2C2O4溶液)/mL | V(蒸馏水)/mL | V(0.010 mol/L酸性KMnO4溶液)/mL | m(MnSO4)/g | T/℃ | 乙 |
| ① | 2.0 | 0 | 4.0 | 0 | 50 | |
| ② | 2.0 | 0 | 4.0 | 0 | 25 | |
| ③ | 1.5 | a | 4.0 | 0 | 25 | |
| ④ | 2.0 | 0 | 4.0 | 0.1 | 25 |
①写出上述反应的离子方程式:
②上述实验①②是探究
影响。若上述实验②③是探究浓度对化学反应速率的影响,则a为
③实验①中对“乙”重复测量三次,所得数值分别13.6,13.5,13.4。忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=
④已知实验①50℃时c(MnO
 )~反应时间t的变化曲线如图I。若保持其他条件不变,请在坐标图中,画出实验②25℃时c(MnO
)~反应时间t的变化曲线如图I。若保持其他条件不变,请在坐标图中,画出实验②25℃时c(MnO )~t的变化曲线示意图。
)~t的变化曲线示意图。

(2)测定中和热的实验装置如图II所示。
①写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式
②取60mL0.50mol/L NaOH溶液和50mL0.50mol/L硫酸溶液进行实验,实验数据如下表。
| 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.9 | |
| 2 | 26.2 | 26.4 | 26.3 | 30.6 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.5 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.0 | |
③能引起中和热偏高的原因是(填字母)
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.用50mL0.50mol/L醋酸代替了硫酸进行反应,
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
E. 量取硫酸溶液的体积时仰视读数
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】实验室利用如下图装置进行中和热的测定,请回答下列问题:
(1)该图中有两处未画出,它们是;____ 、_____ 。

(2)在操作正确的前提下,提高中和热测定准确性的关键是___ 。
(3)做一次完整的中和热测定实验,温度计需使用___ 次。
(4)把温度为13℃,浓度为1.0mol/L的酸溶液和1.1mol/L的碱溶液各50mL混合[溶液密度均为1g/mL,生成溶液的比热容[c=4.184J/(g‧℃)],测得酸碱混合液的温度变化数据如下:
试计算上述两组实验测出的中和热:∆H1=___ kJ/mol;∆H2=____ kJ/mol。
(1)该图中有两处未画出,它们是;

(2)在操作正确的前提下,提高中和热测定准确性的关键是
(3)做一次完整的中和热测定实验,温度计需使用
(4)把温度为13℃,浓度为1.0mol/L的酸溶液和1.1mol/L的碱溶液各50mL混合[溶液密度均为1g/mL,生成溶液的比热容[c=4.184J/(g‧℃)],测得酸碱混合液的温度变化数据如下:
反应物 | 起始温度t1/℃ | 终了温度t2/℃ | 中和热 |
| HCl+NaOH | 13 | 19.8 | ∆H1 |
| HCl+NH3‧H2O | 13 | 19.3 | ∆H2 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某实验小组用 溶液与
溶液与 硫酸溶液进行中和热的测定,装置如图所示。回答下列问题:
硫酸溶液进行中和热的测定,装置如图所示。回答下列问题:
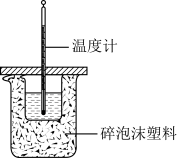
(1)从如图实验装置可知,缺少的一种仪器名称是___________ 。
(2)碎泡沫塑料的作用___________
(3)若实验共需要 溶液,实验室在配制该溶液时,则需要用托盘天平称量
溶液,实验室在配制该溶液时,则需要用托盘天平称量 固体
固体___________ g。
(4)某小组测得数据如下:
①计算出表中的平均温度差为___________ ℃
②近似认为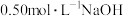 溶液与
溶液与 硫酸溶液的密度都是
硫酸溶液的密度都是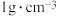 ,中和后生成溶液的比热容
,中和后生成溶液的比热容 ,则上述实验测得的中和热
,则上述实验测得的中和热
___________  。
。
(5)写出用稀 和稀氢氧化钠溶液的反应表示中和热的热化学方程式(中和热数值为
和稀氢氧化钠溶液的反应表示中和热的热化学方程式(中和热数值为 ):
):___________ 。
(6)上述实验测得中和热的数值小于 ,产生偏差的原因可能是___________。
,产生偏差的原因可能是___________。
 溶液与
溶液与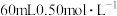 硫酸溶液进行中和热的测定,装置如图所示。回答下列问题:
硫酸溶液进行中和热的测定,装置如图所示。回答下列问题:
(1)从如图实验装置可知,缺少的一种仪器名称是
(2)碎泡沫塑料的作用
(3)若实验共需要
 溶液,实验室在配制该溶液时,则需要用托盘天平称量
溶液,实验室在配制该溶液时,则需要用托盘天平称量 固体
固体(4)某小组测得数据如下:
| 实验序号 | 起始温度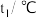 | 终止温度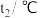 | 平均温度差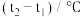 | ||
 |  | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | ___________ |
| 2 | 26.3 | 26.5 | 26.4 | 30.3 | |
| 3 | 26.0 | 26.0 | 26.0 | 30.1 | |
| 4 | 25.9 | 26.1 | 26.0 | 30.8 | |
②近似认为
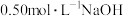 溶液与
溶液与 硫酸溶液的密度都是
硫酸溶液的密度都是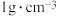 ,中和后生成溶液的比热容
,中和后生成溶液的比热容 ,则上述实验测得的中和热
,则上述实验测得的中和热
 。
。(5)写出用稀
 和稀氢氧化钠溶液的反应表示中和热的热化学方程式(中和热数值为
和稀氢氧化钠溶液的反应表示中和热的热化学方程式(中和热数值为 ):
):(6)上述实验测得中和热的数值小于
 ,产生偏差的原因可能是___________。
,产生偏差的原因可能是___________。| A.量取硫酸体积时仰视读数 | B.配制 溶液定容时俯视 溶液定容时俯视 |
| C.实验装置保温效果差 | D.向酸溶液中分多次加入碱溶液 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】取40ml,0.50mol/L的盐酸与40ml,0.55mol/L的NaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)中和热测定的实验中,用到的玻璃仪器有烧杯、量筒、_______________________ 。
(2)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g•℃)。实验时,还需测量的数据有________ (填选项字母)。
A.反应前盐酸溶液的温度
B.反应前盐酸溶液的质量
C.反应前氢氧化钠溶液的温度
D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度
F.反应后混合溶液的质量
某学生实验记录数据如下表:
依据该学生的实验数据计算,该实验测得的中和热△H=_____ (保留三位有效数字)。
(3)假定该学生的操作完全同上,实验中改用100mL0.50mol/L的盐酸与100mL0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量___________ (填“相等”或“不相等”),所求中和热___________ (填“相等”或“不相等”)。
(1)中和热测定的实验中,用到的玻璃仪器有烧杯、量筒、
(2)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g•℃)。实验时,还需测量的数据有
A.反应前盐酸溶液的温度
B.反应前盐酸溶液的质量
C.反应前氢氧化钠溶液的温度
D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度
F.反应后混合溶液的质量
某学生实验记录数据如下表:
| 实验序号 | 起始温度t1℃ | 终止温度t2℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
(3)假定该学生的操作完全同上,实验中改用100mL0.50mol/L的盐酸与100mL0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量
您最近一年使用:0次



