Ⅰ.某学生用 溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
①移取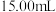 待测的盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞
待测的盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞
②用标准溶液润洗碱式滴定管2~3次
③把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴部分充满溶液
④取标准 溶液注入碱式滴定管至0刻度以上
溶液注入碱式滴定管至0刻度以上
⑤调节液面至0或0刻度以下,记下读数
⑥把锥形瓶放在滴定管的下面,用标准 溶液滴定至终点,记下滴定管液面的刻度
溶液滴定至终点,记下滴定管液面的刻度
回答以下填空:
(1)正确操作的顺序是(填序号)②___________ →___________ →___________ →①→___________ 。
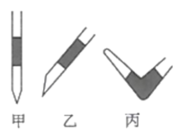
(2)盛 标准液的滴定管尖嘴部分留有气泡,排除气泡的方法应采用如图中的
标准液的滴定管尖嘴部分留有气泡,排除气泡的方法应采用如图中的___________ 操作(填“甲”、“乙”、“丙”)。
(3)下列情况可能造成测定结果偏高的是___________ (填标号)。
A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.碱式滴定管用蒸馏水洗净后,未用标准液润洗
E.配制标准溶液所用 固体中含少量
固体中含少量 杂质
杂质
Ⅱ.与酸碱中和滴定类似,氧化还原滴定也是测定样品含量常用方法。
(4)某实验室有瓶混有泥沙的乙二酸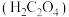 样品,欲测定样品中乙二酸的含量。准确称量
样品,欲测定样品中乙二酸的含量。准确称量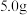 乙二酸样品,配成
乙二酸样品,配成 溶液。量取
溶液。量取 所配溶液于锥形瓶中,加少量硫酸酸化,将
所配溶液于锥形瓶中,加少量硫酸酸化,将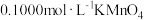 溶液装入
溶液装入___________ (填“酸式”或“碱式”)滴定管,进行滴定操作,当___________ 时,证明达到滴定终点。
(5)滴定过程中发生反应的离子方程式为___________ 。
(6)计算再重复上述操作2次,记录实验数据如下:
则此样品的纯度为___________ 。
 溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
溶液滴定未知浓度的盐酸,其操作可分解为如下几步:①移取
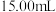 待测的盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞
待测的盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞②用标准溶液润洗碱式滴定管2~3次
③把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴部分充满溶液
④取标准
 溶液注入碱式滴定管至0刻度以上
溶液注入碱式滴定管至0刻度以上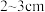
⑤调节液面至0或0刻度以下,记下读数
⑥把锥形瓶放在滴定管的下面,用标准
 溶液滴定至终点,记下滴定管液面的刻度
溶液滴定至终点,记下滴定管液面的刻度回答以下填空:
(1)正确操作的顺序是(填序号)②
(2)盛
 标准液的滴定管尖嘴部分留有气泡,排除气泡的方法应采用如图中的
标准液的滴定管尖嘴部分留有气泡,排除气泡的方法应采用如图中的
(3)下列情况可能造成测定结果偏高的是
A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.碱式滴定管用蒸馏水洗净后,未用标准液润洗
E.配制标准溶液所用
 固体中含少量
固体中含少量 杂质
杂质Ⅱ.与酸碱中和滴定类似,氧化还原滴定也是测定样品含量常用方法。
(4)某实验室有瓶混有泥沙的乙二酸
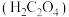 样品,欲测定样品中乙二酸的含量。准确称量
样品,欲测定样品中乙二酸的含量。准确称量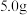 乙二酸样品,配成
乙二酸样品,配成 溶液。量取
溶液。量取 所配溶液于锥形瓶中,加少量硫酸酸化,将
所配溶液于锥形瓶中,加少量硫酸酸化,将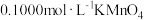 溶液装入
溶液装入(5)滴定过程中发生反应的离子方程式为
(6)计算再重复上述操作2次,记录实验数据如下:
| 序号 | 滴定前读数( ) ) | 滴定后读数( ) ) |
| 1 | 0.00 | 20.10 |
| 2 | 1.00 | 20.90 |
| 3 | 0.00 | 22.10 |
更新时间:2021-11-12 18:03:16
|
【知识点】 酸碱中和滴定
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】加碘食盐中碘元素以KIO3形式存在,KIO3是一种白色粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下KIO3是一种较强的氧化剂,与HI、H2O2等作用,被还原为碘单质。某化学兴趣小组对加碘食盐中的KIO3含量进行探究。
(1)学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
a.称取wg加碘盐,加适量蒸馏水溶解;
b.用稀硫酸酸化,再加入过量KI溶液;
c.以淀粉为指示剂,用物质的量浓度为1.0×10-3mol/L的Na2S2O3溶液进行滴定(滴定时的反应方程式:I2+2S2O =2I-+S4O
=2I-+S4O )。
)。
操作b涉及的主要反应的离子方程式为_____ ;滴定时,Na2S2O3溶液应放在_____ (填“酸式滴定管”或“碱式滴定管”),滴定至终点时消耗Na2S2O3溶液20.00mL,其终点颜色变化为________ ;加碘食盐样品中的碘元素含量是________ mg/kg(以含w的代数式表示)。
(2)学生乙对纯净的NaCl(不含KIO3)进行了下列实验:
请推测实验③中产生蓝色现象的可能原因是(用离子方程式表示):________ 。由学生乙的实验结果推知,学生甲的实验结果将_______ (填“偏大”、“偏小”或“无影响”)。
(1)学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
a.称取wg加碘盐,加适量蒸馏水溶解;
b.用稀硫酸酸化,再加入过量KI溶液;
c.以淀粉为指示剂,用物质的量浓度为1.0×10-3mol/L的Na2S2O3溶液进行滴定(滴定时的反应方程式:I2+2S2O
 =2I-+S4O
=2I-+S4O )。
)。操作b涉及的主要反应的离子方程式为
(2)学生乙对纯净的NaCl(不含KIO3)进行了下列实验:
| 顺序 | 步骤 | 实验现象 |
| ① | 取少量纯净的NaCl,加蒸馏水溶解 | 溶液无变化 |
| ② | 滴入淀粉-KI溶液,振荡 | 溶液无变化 |
| ③ | 放置片刻,再滴加稀H2SO4,振荡 | 溶液变蓝色 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】请回答下列问题。
(1)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.01000mol•L-1的K2Cr2O7标准溶液240mL,应准确称取K2Cr2O7的质量是___________ g[保留4位有效数字,已知M(K2Cr2O7)=294.0g•mol-1]。
(2)金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性高,更易被人体吸收且在体内蓄积。工业上处理酸性含Cr2O 废水的方法如下:
废水的方法如下:
①向含Cr2O 的酸性废水中加入FeSO4溶液,使Cr2O
的酸性废水中加入FeSO4溶液,使Cr2O 全部转化为Cr3+。写出该反应的离子方程式:
全部转化为Cr3+。写出该反应的离子方程式:___________ 。
②调节溶液的pH,使Cr3+完全沉淀。实验室粗略测定溶液pH的方法为___________ ;25℃,若调节溶液的pH=8,则溶液中残余Cr3+的物质的量浓度为___________ mol/L。(已知25℃时,Ksp[Cr(OH)3]=6.3×10-31)
(3)Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
测定产品(Na2S2O3•5H2O)纯度
准确称取Wg产品,用适量蒸馏水溶解,以淀粉做指示剂,用0.1000mol/L碘的标准溶液滴定,反应原理为:2S2O +I2=S4O
+I2=S4O +2I-。
+2I-。
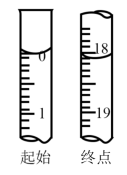
①滴定至终点时,溶液颜色的变化:由___________ 色变为___________ 色。
②滴定起始和终点的液面位置如图,则消耗点的标准溶液体积为18.10mL,产品的纯度为(设Na2S2O3•5H2O的相对分子质量为M)___________ 。
(1)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.01000mol•L-1的K2Cr2O7标准溶液240mL,应准确称取K2Cr2O7的质量是
(2)金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性高,更易被人体吸收且在体内蓄积。工业上处理酸性含Cr2O
 废水的方法如下:
废水的方法如下:①向含Cr2O
 的酸性废水中加入FeSO4溶液,使Cr2O
的酸性废水中加入FeSO4溶液,使Cr2O 全部转化为Cr3+。写出该反应的离子方程式:
全部转化为Cr3+。写出该反应的离子方程式:②调节溶液的pH,使Cr3+完全沉淀。实验室粗略测定溶液pH的方法为
(3)Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
测定产品(Na2S2O3•5H2O)纯度
准确称取Wg产品,用适量蒸馏水溶解,以淀粉做指示剂,用0.1000mol/L碘的标准溶液滴定,反应原理为:2S2O
 +I2=S4O
+I2=S4O +2I-。
+2I-。
①滴定至终点时,溶液颜色的变化:由
②滴定起始和终点的液面位置如图,则消耗点的标准溶液体积为18.10mL,产品的纯度为(设Na2S2O3•5H2O的相对分子质量为M)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】水合肼(N2H4·H2O)又名水合联氨,无色透明,具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂,利用尿素法生产水合肼的原理为:CO(NH2)2+2NaOH+NaClO=Na2CO3+ N2H4·H2O +NaCl
实验一:制备NaClO溶液。(实验装置如右图所示)

(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有_________(填标号)。
(2)锥形瓶中发生反应的离子方程式是______________________ 。
(3)设计实验方案:用中和滴定原理测定反应后锥形瓶中剩余NaOH的浓度(实验提供的试剂:H2O2溶液、FeCl2溶液、0.10 mol·L-1盐酸、酚酞试液):_______ 。
实验二:制取水合肼。(实验装置如右图所示)

(4)控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。分液漏斗中的溶液是______ (填标号)。
(5)称取馏分5.0g,加入适量NaHCO3固体,加水配成250mL溶液,移出25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.10mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。(已知:N2H4·H2O + 2I2 = N2↑+ 4HI + H2O)
①滴定时,碘的标准溶液盛放在________ (填“酸式”或“碱式”)滴定管中;本实验滴定终点的现象为__________ 。
②实验测得消耗I2溶液的平均值为18.00mL,馏分中水合肼(N2H4·H2O)的质量分数为______________ 。
实验一:制备NaClO溶液。(实验装置如右图所示)

(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有_________(填标号)。
| A.容量瓶 | B.烧杯 | C.烧瓶 | D.玻璃棒 |
(3)设计实验方案:用中和滴定原理测定反应后锥形瓶中剩余NaOH的浓度(实验提供的试剂:H2O2溶液、FeCl2溶液、0.10 mol·L-1盐酸、酚酞试液):
实验二:制取水合肼。(实验装置如右图所示)

(4)控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。分液漏斗中的溶液是
| A.CO (NH2) 2溶液 | B.NaOH和NaClO混合溶液 |
①滴定时,碘的标准溶液盛放在
②实验测得消耗I2溶液的平均值为18.00mL,馏分中水合肼(N2H4·H2O)的质量分数为
您最近一年使用:0次



