碘( Godine)是人体必需的微量元素,是维持人体甲状腺正常功能所必需的元素, 人体缺碘时就会患甲状腺肿大,人们主要从饮水、粮食、蔬菜和周围环境中获取碘。多食海带,海鱼等含碘丰富的食品,对于防治甲状腺肿大很有效。某化学课外活动小组在实验室以海带为原料获得少量碘水,并以四氯化碳(沸点76.8℃)为溶剂将碘从碘水中提取出来,甲同学设计实验流程如图所示。请回答下列问题:
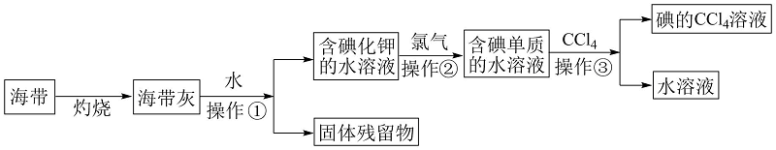
(1)上述流程中灼烧时必须用到最主要 的实验仪器有酒精灯、泥三角和___________ (填名称)。
(2)操作①的名称为___________ ;
(3)操作②中发生反应的离子方程式为______________________ ,乙同学对操作②进行了改进,用绿色氧化剂H2O2代替氯气并加适量稀盐酸,则所发生的离子反应方程式是____________________________________ 。
(4)操作③的实验名称为___________ ,最主要的 实验仪器的名称为___________ ;
(5)丙同学补充增加了一步操作:从碘的CCl4溶液中经过___________ 提取了碘单质并回收CCl4(填该操作名称)
(6)目前,我国推行全民食用的加碘盐是在食盐中加入___________ 这一物质(填写化学式)。

(1)上述流程中灼烧时
(2)操作①的名称为
(3)操作②中发生反应的离子方程式为
(4)操作③的实验名称为
(5)丙同学补充增加了一步操作:从碘的CCl4溶液中经过
(6)目前,我国推行全民食用的加碘盐是在食盐中加入
更新时间:2021-12-03 11:19:19
|
【知识点】 海带中碘的提取及检验解读
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】当今世界各国充分认识到海洋资源的重要性,海水的综合利用是当今的热点话题之一、
I.利用海水脱硫可以有效地解决煤燃烧过程中排放的SO2造成的一系列环境问题。其工艺流程如图所示:
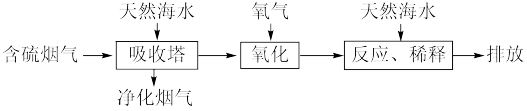
(1)天然海水(pH≈8)吸收含硫的烟气后,会溶有H2SO3、 等分子或离子,需要用氧气进行氧化处理,写出
等分子或离子,需要用氧气进行氧化处理,写出 参加反应的离子方程式
参加反应的离子方程式_______ 。
(2)氧化后的海水需要用大量的天然海水与之混合后才能排放。该操作的主要目的是_______ 。
II.从海水中提纯粗盐后的母液中含有K+、Na+和Mg2+等阳离子。对母液进行一系列的加工可制得金属镁。
(3)从离子反应的角度思考,在母液中加入石灰乳所起的作用是_______ 。
(4)电解熔融的无水氯化镁所得的镁蒸气在特定的环境中冷却后即为固体镁。下列物质中可以用作镁蒸气的冷却剂的是_______(填字母)。
III.海带中含有碘元素。从海带中提取碘的实验过程如下图:

(5)灼烧海带时盛装海带的仪器名称是_______ 。
(6)海带灰中含有硫酸镁、碳酸钠等,在实验步骤_______ (填序号)中实现与碘分离。
(7)写出步骤④反应的离子方程式_______ 。
I.利用海水脱硫可以有效地解决煤燃烧过程中排放的SO2造成的一系列环境问题。其工艺流程如图所示:

(1)天然海水(pH≈8)吸收含硫的烟气后,会溶有H2SO3、
 等分子或离子,需要用氧气进行氧化处理,写出
等分子或离子,需要用氧气进行氧化处理,写出 参加反应的离子方程式
参加反应的离子方程式(2)氧化后的海水需要用大量的天然海水与之混合后才能排放。该操作的主要目的是
II.从海水中提纯粗盐后的母液中含有K+、Na+和Mg2+等阳离子。对母液进行一系列的加工可制得金属镁。
(3)从离子反应的角度思考,在母液中加入石灰乳所起的作用是
(4)电解熔融的无水氯化镁所得的镁蒸气在特定的环境中冷却后即为固体镁。下列物质中可以用作镁蒸气的冷却剂的是_______(填字母)。
| A.O2 | B.N2 | C.Ar | D.水蒸气 |
III.海带中含有碘元素。从海带中提取碘的实验过程如下图:

(5)灼烧海带时盛装海带的仪器名称是
(6)海带灰中含有硫酸镁、碳酸钠等,在实验步骤
(7)写出步骤④反应的离子方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】海洋资源的利用具有广阔前景。
(1)下列不属于海水淡化的方法___________ (填序号)。
A.蒸馏法 B.离子交换法 C.过滤法 D.电渗析法
(2)下图是从海水中提取镁的简单流程。

①试剂B是________ (填化学式)。
②由无水MgCl2制取Mg的化学方程式是________________________ 。
(3)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:

I:下列不属于步骤①操作所用的仪器是_________ (填序号)。
A.酒精灯 B.漏斗 C.坩埚 D.泥三角
II:步骤③的实验操作名称是__________ 。
III:④步骤反应的离子方程式________ 。
IV:请设计一种检验提取碘后的水溶液中是否含有碘单质的简单方法___________ 。
(1)下列不属于海水淡化的方法
A.蒸馏法 B.离子交换法 C.过滤法 D.电渗析法
(2)下图是从海水中提取镁的简单流程。

①试剂B是
②由无水MgCl2制取Mg的化学方程式是
(3)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:

I:下列不属于步骤①操作所用的仪器是
A.酒精灯 B.漏斗 C.坩埚 D.泥三角
II:步骤③的实验操作名称是
III:④步骤反应的离子方程式
IV:请设计一种检验提取碘后的水溶液中是否含有碘单质的简单方法
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下:

(1)指出提取碘的过程中有关的实验操作名称:①_______ ;②_______ ;若碘中混有食盐,最简单的方法分离是_______ 。
(2)提取碘的过程中,可供选择的有关试剂是_______。
(3)要测量含碘离子的溶液中I-的浓度,取25mL该溶液,先加几滴_______ ,再逐滴滴入0.1mol/LFeCl3溶液,当溶液颜色变为_______ 时I-被全部氧化:2I-+2Fe3+=I2+2Fe2+。
(4)①若实验室只有FeCl3固体,要配制500mL0.1mol/L的FeCl3溶液,所需仪器有:托盘天平、药匙、烧杯、玻璃棒、_______ 、胶头滴管。在配制过程中未洗涤烧杯和玻璃棒,则FeCl3溶液浓度会_______ ,(填“偏低”、“偏高”、“无影响”,下同):在定容时俯视刻度线和液面,则浓度会_______ 。
②若消耗FeCl3溶液22.5mL,则含碘离子的溶液中I-的浓度为:_______ 。
(5)碘单质与浓NaOH溶液发生的反应为:3I2+6NaOH=5NaI+NaIO3+3H2O,像这种将富集在四氯化碳中的碘单质利用化学转化法重新富集在水中的方法即为反萃取法。指出上述反应中氧化剂与还原剂的物质的量之比为_______ 。

(1)指出提取碘的过程中有关的实验操作名称:①
(2)提取碘的过程中,可供选择的有关试剂是_______。
| A.酒精 | B.四氯化碳 | C.醋酸 | D.甘油(易溶于水) |
(4)①若实验室只有FeCl3固体,要配制500mL0.1mol/L的FeCl3溶液,所需仪器有:托盘天平、药匙、烧杯、玻璃棒、
②若消耗FeCl3溶液22.5mL,则含碘离子的溶液中I-的浓度为:
(5)碘单质与浓NaOH溶液发生的反应为:3I2+6NaOH=5NaI+NaIO3+3H2O,像这种将富集在四氯化碳中的碘单质利用化学转化法重新富集在水中的方法即为反萃取法。指出上述反应中氧化剂与还原剂的物质的量之比为
您最近一年使用:0次



