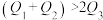已知N≡N键的键能是946kJ•mol-1,H-H键的键能是436kJ•mol-1,N-H键的键能是391kJ•mol-1,则N2(g)+3H2(g)=2NH3(g)的△H为
| A.209kJ•mol-1 | B.-209kJ•mol-1 | C.92kJ•mol-1 | D.-92kJ•mol-1 |
更新时间:2022-11-25 13:59:38
|
相似题推荐
【推荐1】利用含碳化合物合成燃料是解决能源危机的重要方法,已知 反应过程中的能量变化情况如图所示,曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是
反应过程中的能量变化情况如图所示,曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是

 反应过程中的能量变化情况如图所示,曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是
反应过程中的能量变化情况如图所示,曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是
| A.该反应的逆反应为吸热反应,升高温度活化分子的百分数不变 |
B.加入催化剂,改变活化能,该反应的 变小 变小 |
| C.反应物的总键能大于生成物的总键能 |
D.如果该反应生成液态 ,则 ,则 减少 减少 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】已知: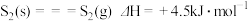 。某些化学键的键能数据如表所示:
。某些化学键的键能数据如表所示:
下列说法正确的是
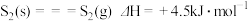 。某些化学键的键能数据如表所示:
。某些化学键的键能数据如表所示:化学键 |
|
|
|
|
|
键能/ | 436 | 243 | 432 | 255 | 339 |
A. 与 与 反应生成 反应生成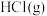 时放出 时放出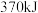 热量 热量 |
B. 与 与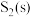 反应生成 反应生成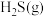 的热化学方程式为 的热化学方程式为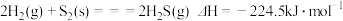 |
C.反应的焓变 生成物的键能之和-反应物的键能之和 生成物的键能之和-反应物的键能之和 |
D.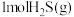 分解吸收的热量比 分解吸收的热量比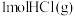 分解吸收的热量多,所以 分解吸收的热量多,所以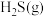 比 比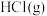 稳定 稳定 |
您最近一年使用:0次




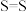

 在
在 中燃烧的化学方程式为
中燃烧的化学方程式为 ,已知在相同条件下,有如图所示的能量变化,下列说法正确的是(
,已知在相同条件下,有如图所示的能量变化,下列说法正确的是(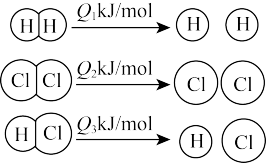
 与
与 的总能量小于
的总能量小于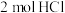 的总能量
的总能量