利用 与
与 发生的氧化还原反应设计一个能产生电流的装置,画出简单的装置示意图,标明使用的用品
发生的氧化还原反应设计一个能产生电流的装置,画出简单的装置示意图,标明使用的用品_______ 。
供选择的实验用品: 溶液、
溶液、 溶液、
溶液、 溶液、
溶液、 溶液、
溶液、 溶液、铜片、锌片、铁片、碳棒、滤纸、导线
溶液、铜片、锌片、铁片、碳棒、滤纸、导线

 与
与 发生的氧化还原反应设计一个能产生电流的装置,画出简单的装置示意图,标明使用的用品
发生的氧化还原反应设计一个能产生电流的装置,画出简单的装置示意图,标明使用的用品供选择的实验用品:
 溶液、
溶液、 溶液、
溶液、 溶液、
溶液、 溶液、
溶液、 溶液、铜片、锌片、铁片、碳棒、滤纸、导线
溶液、铜片、锌片、铁片、碳棒、滤纸、导线
更新时间:2022-11-26 17:41:21
|
【知识点】 原电池原理的应用
相似题推荐
解答题-原理综合题
|
较易
(0.85)
名校
【推荐1】原电池是将化学能转化为电能的装置。如图,烧杯中是稀硫酸溶液

(1)当开关K断开时产生的现象为___________ 。
A.铜片不断溶解 B.锌片不断溶解 C.铜片上产生气泡 D.锌片上产生气泡 E.溶液逐渐变蓝
(2)闭合开关K,经过一段时间后,若导线中转移了0.4mol电子,则产生的气体在标况下的体积为___________ 。
(3)如果反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,该同学在烧杯中分别加入等体积的下列液体,你认为可行的是___________ (填序号)。
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
(4)FeCl3常用于腐蚀印刷电路铜板(2FeCl3+Cu=2FeCl2+CuCl2)请将此反应设计成原电池,该原电池负极的电极材料为___________ ,负极的电极反应式为___________ ,正极的电极反应式为___________ 。

(1)当开关K断开时产生的现象为
A.铜片不断溶解 B.锌片不断溶解 C.铜片上产生气泡 D.锌片上产生气泡 E.溶液逐渐变蓝
(2)闭合开关K,经过一段时间后,若导线中转移了0.4mol电子,则产生的气体在标况下的体积为
(3)如果反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,该同学在烧杯中分别加入等体积的下列液体,你认为可行的是
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
(4)FeCl3常用于腐蚀印刷电路铜板(2FeCl3+Cu=2FeCl2+CuCl2)请将此反应设计成原电池,该原电池负极的电极材料为
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐2】某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。回答下列问题:
(1)上述实验中主要发生两个反应,化学方程式分别为 和
和_______ 。
(2)已知硫酸铜在反应中不会做催化剂,则加入硫酸铜溶液可以加快氢气生成速率的原因是_______ 。
(3)实验室中现有 、
、 、
、 、
、 等4种稀溶液,可与实验中
等4种稀溶液,可与实验中 溶液起相似作用的是
溶液起相似作用的是_______ 。
(4)要加快上述实验中气体产生的速率,还可采取的措施有_______ (任写一种即可)。
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
①请完成此实验设计,其中:
_______ ,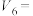
_______ ;
②该同学最后得出的结论为:当加入少量 溶液时,生成氢气的速率会大大提高。但当加入的
溶液时,生成氢气的速率会大大提高。但当加入的 溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因
溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因_______ 。
(1)上述实验中主要发生两个反应,化学方程式分别为
 和
和(2)已知硫酸铜在反应中不会做催化剂,则加入硫酸铜溶液可以加快氢气生成速率的原因是
(3)实验室中现有
 、
、 、
、 、
、 等4种稀溶液,可与实验中
等4种稀溶液,可与实验中 溶液起相似作用的是
溶液起相似作用的是(4)要加快上述实验中气体产生的速率,还可采取的措施有
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
实验 混合溶液 | A | B | C | D | E | F |
 | 30 |  |  |  |  | 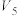 |
饱和 溶液/mL 溶液/mL | 0 | 0.5 | 2.5 | 5 |  | 20 |
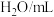 | 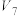 | 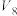 |  | 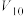 | 10 | 0 |

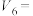
②该同学最后得出的结论为:当加入少量
 溶液时,生成氢气的速率会大大提高。但当加入的
溶液时,生成氢气的速率会大大提高。但当加入的 溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因
溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐3】Ⅰ.如图所示的是探究金属腐蚀条件的实验装置图,请分析实验并回答下列问题:
(1)若起始时甲、乙、丙3套装置的导管中液面高度相同,过一段时间后液面最高的是________ 。
(2)通过甲、乙装置的对比说明钢铁中碳的含量越________ (填“高”或“低”),钢铁越易腐蚀。
(3)乙装置中发生电化学腐蚀时正极的电极反应式为_________________________________ 。
Ⅱ.利用化学反应:2FeCl3+Cu=2FeCl2+CuCl2,请你选择合适的电极材料和电解质溶液,设计一个原电池。可供选择的电极材料:铁棒、铜棒、石墨棒。可供选择的电解质溶液:CuCl2溶液、FeCl2溶液、FeCl3溶液。
请填写下列空白:
(1)选择________ 作正极材料,________ 作负极材料;选择________ 作电解质溶液。
(2)写出有关的电极反应式:正极:__________________ ;负极:_______________________ 。

(1)若起始时甲、乙、丙3套装置的导管中液面高度相同,过一段时间后液面最高的是
(2)通过甲、乙装置的对比说明钢铁中碳的含量越
(3)乙装置中发生电化学腐蚀时正极的电极反应式为
Ⅱ.利用化学反应:2FeCl3+Cu=2FeCl2+CuCl2,请你选择合适的电极材料和电解质溶液,设计一个原电池。可供选择的电极材料:铁棒、铜棒、石墨棒。可供选择的电解质溶液:CuCl2溶液、FeCl2溶液、FeCl3溶液。
请填写下列空白:
(1)选择
(2)写出有关的电极反应式:正极:
您最近一年使用:0次



