50mL 0.50 盐酸与50mL 0.55
盐酸与50mL 0.55 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应的反应热。回答下列问题:
NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应的反应热。回答下列问题:

(1)写出该反应的热化学方程式_______ 。(中和反应的反应热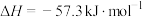 )
)
(2)若将装置中的玻璃搅拌器换成环形铜丝搅拌棒,实验数值结果与57.3 相比
相比_______ (填“偏大”或“偏小”),产生偏差的原因可能是_______ 。
(3)实验操作过程中,实验数据如下表:
上述实验中温度变化的平均值为_______ ℃,若近似认为0.50 稀盐酸与0.55
稀盐酸与0.55 NaOH溶液的密度均为1
NaOH溶液的密度均为1 ,反应所得溶液的比热容
,反应所得溶液的比热容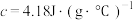 ,则中和热△H的数值为
,则中和热△H的数值为_______  (保留1位小数)。
(保留1位小数)。
(4)如果用0.50 的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”的数值将
的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”的数值将_______ (填“偏大”、“偏小”、“不变”),原因是_______ 。
(5)实验中改用60mL 0.5 盐酸跟50mL 0.55
盐酸跟50mL 0.55 NaOH溶液进行反应,调整反应物用量后所放出的热量与原实验
NaOH溶液进行反应,调整反应物用量后所放出的热量与原实验_______ (填“相等”或“不相等”,下同),所求中和反应反应热与原实验_______ ,简述理由:_______ 。
 盐酸与50mL 0.55
盐酸与50mL 0.55 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应的反应热。回答下列问题:
NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应的反应热。回答下列问题:
(1)写出该反应的热化学方程式
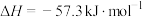 )
)(2)若将装置中的玻璃搅拌器换成环形铜丝搅拌棒,实验数值结果与57.3
 相比
相比(3)实验操作过程中,实验数据如下表:
| 温度 实验次数 | 起始温度 /℃ /℃ | 终止温度 /℃ /℃ | ||
| HCl | NaOH | 平均值 | ||
| 1 | 26.2 | 26.0 | 26.1 | 29.4 |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 |
| 3 | 25.9 | 25.9 | 25.9 | 29.4 |
| 4 | 26.4 | 26.2 | 26.3 | 29.7 |
 稀盐酸与0.55
稀盐酸与0.55 NaOH溶液的密度均为1
NaOH溶液的密度均为1 ,反应所得溶液的比热容
,反应所得溶液的比热容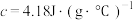 ,则中和热△H的数值为
,则中和热△H的数值为 (保留1位小数)。
(保留1位小数)。(4)如果用0.50
 的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”的数值将
的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”的数值将(5)实验中改用60mL 0.5
 盐酸跟50mL 0.55
盐酸跟50mL 0.55 NaOH溶液进行反应,调整反应物用量后所放出的热量与原实验
NaOH溶液进行反应,调整反应物用量后所放出的热量与原实验
更新时间:2023-06-17 17:08:16
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】工厂烟气(主要含SO2、NO)直接排放会造成空气污染,需处理后才能排放。
(1)O3氧化。
O3氧化过程中部分反应的能量变化如图所示,Ea1是反应的活化能,一定条件下,活化能越大反应速率越慢,反应越困难。
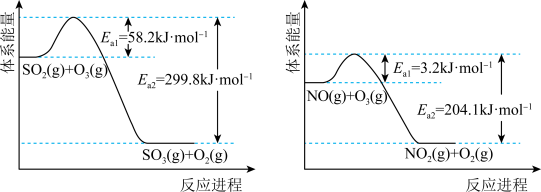
①写出SO2与O3反应的热化学方程式:____ 。
②在相同条件下,O3与NO反应的速率____ O3与SO2的反应速率。(填>、=、<)
③其他条件不变时,工厂烟气处理主要发生NO与O3反应,即使增加n(O3),O3氧化SO2的反应几乎不受影响,可能原因是____ 。
(2)NaClO氧化。
40℃时向一定量NaClO溶液中按一定流速持续通入工厂烟气,溶液的pH与ORP值(氧化还原电位)随时间变化如图所示。
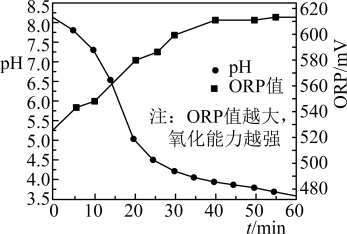
①写出5min时溶液中NO与ClO-反应生成 和Cl-的离子方程式:
和Cl-的离子方程式:____ 。
②烟气中含有少量SO2,NO的脱除率比不含SO2的烟气高,可能原因是____ 。
(1)O3氧化。
O3氧化过程中部分反应的能量变化如图所示,Ea1是反应的活化能,一定条件下,活化能越大反应速率越慢,反应越困难。

①写出SO2与O3反应的热化学方程式:
②在相同条件下,O3与NO反应的速率
③其他条件不变时,工厂烟气处理主要发生NO与O3反应,即使增加n(O3),O3氧化SO2的反应几乎不受影响,可能原因是
(2)NaClO氧化。
40℃时向一定量NaClO溶液中按一定流速持续通入工厂烟气,溶液的pH与ORP值(氧化还原电位)随时间变化如图所示。

①写出5min时溶液中NO与ClO-反应生成
 和Cl-的离子方程式:
和Cl-的离子方程式:②烟气中含有少量SO2,NO的脱除率比不含SO2的烟气高,可能原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】(1)甲醇是可再生能源,具有开发应用的广阔前景,回答下列问题:
一定温度下,在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)
①下列情形不能说明该反应已达到平衡状态的是________ (填序号).
A.每消耗1mol CO的同时生成2molH2 B.混合气体总物质的量不变
C.CH3OH、CO、H2的浓度都不再发生变化 D.生成CH3OH的速率与消耗CO的速率相等
②CO的平衡转化率(α)与温度、压强的关系如图所示.A、B两点的平衡常数K(A)________ K(B)(填“>”、“=”或“<”).

(2)已知25℃合成氨反应中,1mol N2完全转化为NH3时释放的能量为92.4 kJ。现将1mol N2和3mol H2混合置于2L密闭容器中,反应进行到2s末测得NH3为0.4mol。回答下列问题:
① 该反应的热化学方程式是________ ;
② 该反应达到平衡后,升高温度平衡向________ (填“正反应方向”、“逆反应方向”)移动;加入催化剂平衡________ (填“正”、“逆”、 “不”)移动;
③ 前2s内v(H2)是________ 。
一定温度下,在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)
①下列情形不能说明该反应已达到平衡状态的是
A.每消耗1mol CO的同时生成2molH2 B.混合气体总物质的量不变
C.CH3OH、CO、H2的浓度都不再发生变化 D.生成CH3OH的速率与消耗CO的速率相等
②CO的平衡转化率(α)与温度、压强的关系如图所示.A、B两点的平衡常数K(A)

(2)已知25℃合成氨反应中,1mol N2完全转化为NH3时释放的能量为92.4 kJ。现将1mol N2和3mol H2混合置于2L密闭容器中,反应进行到2s末测得NH3为0.4mol。回答下列问题:
① 该反应的热化学方程式是
② 该反应达到平衡后,升高温度平衡向
③ 前2s内v(H2)是
您最近一年使用:0次
【推荐3】已知含铜离子的颜色主要有Cu(H2O)42+(蓝色)、CuCl42−(黄色)、Cu(NH3)42+(深蓝色)等。
(1)16g铜在足量的氯气中燃烧生成固体产物放出的热量为56.8kJ。写出铜在氯气中燃烧的热化学方程式为______________________________________ 。
(2)向氯化铜溶液中滴加氨水至过量,最终生成Cu(NH3)42+,观察到的现象是________ 。
(3)CuCl2溶液中的铜主要以Cu(H2O)42+、CuCl42−形式存在,将CuCl2溶于浓盐酸中,存在下列平衡:Cu(H2O)42+ (aq)+4Cl− (aq) CuCl42− (aq)+4H2O(l) △H<0
CuCl42− (aq)+4H2O(l) △H<0
①该反应的平衡常数表达式为____________ 。
②常温下,测定平衡体系中:Cu(H2O)42+浓度为a mol·L−1、Cl−浓度为b mol·L−1、CuCl42−浓度为c mol·L−1,Cl−的转化率为____________ (用含a、b、c的字母表示)。
③将c1 mol·L−1CuCl2溶液和c2 mol·L−1 HCl溶液等体积混合,测得混合溶液中c(Cl−)与温度T的关系如右图所示。简述温度高于T1 K时,随着温度升高,c(Cl−)增大的原因___________ 。
④用惰性电极电解浓度较大CuCl2溶液,阳极的电极反应式为_________________ ,当电解到一定程度,阴极附近出现蓝色Cu(OH)2絮状物。常温下,经测定阴极附近溶液的pH=m,
此时阴极附近c(Cu2+)=___________ mol·L−1 (已知:Cu(OH)2的Ksp=2.2×10−20)。
(1)16g铜在足量的氯气中燃烧生成固体产物放出的热量为56.8kJ。写出铜在氯气中燃烧的热化学方程式为
(2)向氯化铜溶液中滴加氨水至过量,最终生成Cu(NH3)42+,观察到的现象是
(3)CuCl2溶液中的铜主要以Cu(H2O)42+、CuCl42−形式存在,将CuCl2溶于浓盐酸中,存在下列平衡:Cu(H2O)42+ (aq)+4Cl− (aq)
 CuCl42− (aq)+4H2O(l) △H<0
CuCl42− (aq)+4H2O(l) △H<0①该反应的平衡常数表达式为
②常温下,测定平衡体系中:Cu(H2O)42+浓度为a mol·L−1、Cl−浓度为b mol·L−1、CuCl42−浓度为c mol·L−1,Cl−的转化率为
③将c1 mol·L−1CuCl2溶液和c2 mol·L−1 HCl溶液等体积混合,测得混合溶液中c(Cl−)与温度T的关系如右图所示。简述温度高于T1 K时,随着温度升高,c(Cl−)增大的原因

④用惰性电极电解浓度较大CuCl2溶液,阳极的电极反应式为
此时阴极附近c(Cu2+)=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某化学兴趣小组用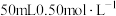 盐酸与
盐酸与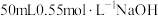 溶液进行中和反应反应热的测定实验,实验装置如图所示。试回答下列问题:
溶液进行中和反应反应热的测定实验,实验装置如图所示。试回答下列问题:

(1)实验时玻璃搅拌器的使用方法是___________ ;不能用铜质搅拌器代替玻璃搅拌器的理由是___________ 。
(2)NaOH溶液稍过量的原因是___________ 。
(3)某同学记录的实验数据如表所示。(已知:实验中盐酸和氢氧化钠溶液的密度均为 ,中和反应后溶液的比热容
,中和反应后溶液的比热容 )
)
依据该同学的实验数据计算,该实验测得反应放出的热量为___________ J。
(4)下列操作会导致实验结果出现偏差的是___________ (填字母)。
a.用量筒量取盐酸的体积时仰视读数
b.把量筒中的氢氧化钠溶液分多次倒入盐酸中
c.将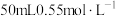 氢氧化钠溶液取成了
氢氧化钠溶液取成了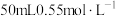 氢氧化钾溶液
氢氧化钾溶液
d.做本实验的当天室温较高
(5)如果将NaOH溶液换成等量的NaOH固体,那么实验中测得的中和反应反应热( )
)___________ (填“偏大”、“偏小”或“不变”)。
(6)如果用 盐酸与
盐酸与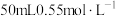 溶液进行实验,与上述实验相比,二者所放出的热量
溶液进行实验,与上述实验相比,二者所放出的热量___________ (填“相等”或“不相等”,下同),所求的中和反应反应热( )
)___________
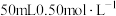 盐酸与
盐酸与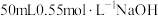 溶液进行中和反应反应热的测定实验,实验装置如图所示。试回答下列问题:
溶液进行中和反应反应热的测定实验,实验装置如图所示。试回答下列问题:
(1)实验时玻璃搅拌器的使用方法是
(2)NaOH溶液稍过量的原因是
(3)某同学记录的实验数据如表所示。(已知:实验中盐酸和氢氧化钠溶液的密度均为
 ,中和反应后溶液的比热容
,中和反应后溶液的比热容 )
)| 实验序号 | 起始温度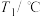 | 终止温度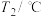 | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.2 | 23.3 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.4 | 20.6 | 23.8 |
(4)下列操作会导致实验结果出现偏差的是
a.用量筒量取盐酸的体积时仰视读数
b.把量筒中的氢氧化钠溶液分多次倒入盐酸中
c.将
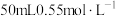 氢氧化钠溶液取成了
氢氧化钠溶液取成了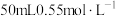 氢氧化钾溶液
氢氧化钾溶液d.做本实验的当天室温较高
(5)如果将NaOH溶液换成等量的NaOH固体,那么实验中测得的中和反应反应热(
 )
)(6)如果用
 盐酸与
盐酸与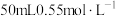 溶液进行实验,与上述实验相比,二者所放出的热量
溶液进行实验,与上述实验相比,二者所放出的热量 )
)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】同学们用0.50 mol/L NaOH溶液和0.50 mol/L硫酸进行中和反应反应热的测定。
I.配制溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体___________ g。
(2)配制硫酸溶液的实验方案中出现图标 和
和 ,前者提示实验中会用到温度较高的设备,后者要求实验者
,前者提示实验中会用到温度较高的设备,后者要求实验者___________ (填防护措施)。
II.取50 mL NaOH溶液和30 mL硫酸进行实验,实验数据如下表。测定稀硫酸和稀氢氧化钠溶液中和反应反应热的实验装置如图所示:

(3)仪器A的名称为___________ 。
(4)假设稀硫酸和稀氢氧化钠溶液的密度都是1 g/mL,又知中和反应后生成溶液的比热容 。为了计算中和热(稀溶液中,酸和碱发生中和反应生成1 mol液态水放出的热量),某学生实验记录数据如下:
。为了计算中和热(稀溶液中,酸和碱发生中和反应生成1 mol液态水放出的热量),某学生实验记录数据如下:
①依据该学生的实验数据计算,该实验测得的中和热
___________ (结果保留一位小数)。
②已知强酸强碱的稀溶液反应生成1 mol液态H2O时反应放出的热量为57.3 kJ,上述实验产生偏差的原因可能是___________ (填字母)。
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定 溶液的温度
溶液的温度
I.配制溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体
(2)配制硫酸溶液的实验方案中出现图标
 和
和 ,前者提示实验中会用到温度较高的设备,后者要求实验者
,前者提示实验中会用到温度较高的设备,后者要求实验者II.取50 mL NaOH溶液和30 mL硫酸进行实验,实验数据如下表。测定稀硫酸和稀氢氧化钠溶液中和反应反应热的实验装置如图所示:

(3)仪器A的名称为
(4)假设稀硫酸和稀氢氧化钠溶液的密度都是1 g/mL,又知中和反应后生成溶液的比热容
 。为了计算中和热(稀溶液中,酸和碱发生中和反应生成1 mol液态水放出的热量),某学生实验记录数据如下:
。为了计算中和热(稀溶液中,酸和碱发生中和反应生成1 mol液态水放出的热量),某学生实验记录数据如下:| 温度实验次数 | 起始温度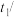 ℃ ℃ | 终止温度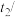 ℃ ℃ | ||
 | NaOH | 平均值 | ||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 |

②已知强酸强碱的稀溶液反应生成1 mol液态H2O时反应放出的热量为57.3 kJ,上述实验产生偏差的原因可能是
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定
 溶液的温度
溶液的温度
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】某实验小组用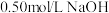 溶液和
溶液和 溶液进行中和热的测定。
溶液进行中和热的测定。
Ⅰ.配制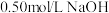 溶液
溶液
(1)若实验中大约要使用 溶液,则至少需要称量
溶液,则至少需要称量 固体
固体_______ g。
(2)从下图中选择称量 固体所需要的仪器(填序号)
固体所需要的仪器(填序号)_______ .

Ⅱ.测定中和热的实验装置如下图所示。

(3)写出表示稀硫酸和稀氢氧化钠溶液反应中和热的热化学方程式(中和热数值为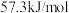 ):
):_______ 。
(4)取 溶液和
溶液和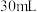 硫酸进行实验,实验数据如下表。
硫酸进行实验,实验数据如下表。
①请填写下表中的空白:
②近似认为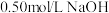 溶液和
溶液和 溶液的密度都是
溶液的密度都是 ,中和后生成溶液的比热容
,中和后生成溶液的比热容 .则中和热
.则中和热
_______ (保留小数点后一位)。
③上述实验结果的数值比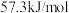 偏小,产生偏小的原因可能是(填序号)
偏小,产生偏小的原因可能是(填序号)_______ 。
a.实验装置保温、隔热效果差
b.在量取 溶液的体积时仰视读数
溶液的体积时仰视读数
c.分多次把 溶液倒入盛有稀硫酸的小烧杯中
溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定 溶液起始温度后直接测定
溶液起始温度后直接测定 溶液的温度
溶液的温度
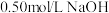 溶液和
溶液和 溶液进行中和热的测定。
溶液进行中和热的测定。Ⅰ.配制
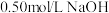 溶液
溶液(1)若实验中大约要使用
 溶液,则至少需要称量
溶液,则至少需要称量 固体
固体(2)从下图中选择称量
 固体所需要的仪器(填序号)
固体所需要的仪器(填序号)
Ⅱ.测定中和热的实验装置如下图所示。

(3)写出表示稀硫酸和稀氢氧化钠溶液反应中和热的热化学方程式(中和热数值为
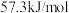 ):
):(4)取
 溶液和
溶液和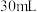 硫酸进行实验,实验数据如下表。
硫酸进行实验,实验数据如下表。①请填写下表中的空白:
| 温度 实验次数 | 起始温度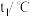 | 终止温度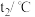 | 平均温度差 | ||
 溶液 溶液 |  溶液 溶液 | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
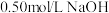 溶液和
溶液和 溶液的密度都是
溶液的密度都是 ,中和后生成溶液的比热容
,中和后生成溶液的比热容 .则中和热
.则中和热
③上述实验结果的数值比
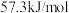 偏小,产生偏小的原因可能是(填序号)
偏小,产生偏小的原因可能是(填序号)a.实验装置保温、隔热效果差
b.在量取
 溶液的体积时仰视读数
溶液的体积时仰视读数c.分多次把
 溶液倒入盛有稀硫酸的小烧杯中
溶液倒入盛有稀硫酸的小烧杯中d.用温度计测定
 溶液起始温度后直接测定
溶液起始温度后直接测定 溶液的温度
溶液的温度
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】实验室利用如图装置进行中和热的测定,请回答下列问题:
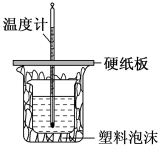
(1)从实验装置上看,图中尚缺少的玻璃用品是___________ 。
(2)在操作正确的前提下,提高中和热测定准确性的关键是___________ ;
(3)把温度为13℃,浓度为1.0mol/L的酸溶液和1.1mol/L的碱溶液各50mL混合[溶液密度均为1g/mL,生成溶液的比热容c=4.184J/(g·℃)],轻轻搅动,测得酸碱混合液的温度变化数据如表:
①计算上述两组实验测出的中和热:提示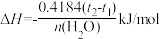 。△H1=
。△H1=___________ kJ/mol;△H2=___________ kJ/mol。
②两组实验结果差异的原因是___________ 。

(1)从实验装置上看,图中尚缺少的玻璃用品是
(2)在操作正确的前提下,提高中和热测定准确性的关键是
(3)把温度为13℃,浓度为1.0mol/L的酸溶液和1.1mol/L的碱溶液各50mL混合[溶液密度均为1g/mL,生成溶液的比热容c=4.184J/(g·℃)],轻轻搅动,测得酸碱混合液的温度变化数据如表:
| 反应物 | 起始温度t1/℃ | 终了温度t2/℃ | 中和热 |
| HCl+NaOH | 13 | 19.8 | △H1 |
| HCl+NH3·H2O | 13 | 19.3 | △H2 |
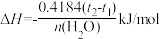 。△H1=
。△H1=②两组实验结果差异的原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】 溶液与
溶液与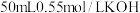 溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题
溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题

(1)从实验装置上看,图中尚缺少的一种玻璃仪器是__________________ 。
(2)烧杯间填满碎纸条的作用是__________________ 。
(3)实验数据如下表:
 本次实验的温度差的平均值
本次实验的温度差的平均值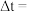
_________  。
。
 近似地认为
近似地认为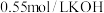 溶液和
溶液和 溶液的密度都是
溶液的密度都是 ,中和后生成溶液的比热容
,中和后生成溶液的比热容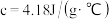 ,则中和热
,则中和热
_________  数值精确到
数值精确到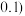 。
。
 中和热测定实验中,下列操作一定会降低实验准确性的是
中和热测定实验中,下列操作一定会降低实验准确性的是_________ 。
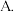 用滴定管
用滴定管 精量仪器,读数保留到
精量仪器,读数保留到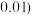 取所用酸碱溶液的体积
取所用酸碱溶液的体积
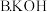 溶液在倒入小烧杯时,有少量溅出
溶液在倒入小烧杯时,有少量溅出
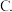 大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多
大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多
 测量
测量 溶液的温度计用水洗净后才用来测KOH溶液的温度
溶液的温度计用水洗净后才用来测KOH溶液的温度
(4)实验中改用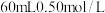 盐酸跟
盐酸跟 溶液进行反应,与上述实验相比,所放出的热量
溶液进行反应,与上述实验相比,所放出的热量_________  填“相等”或“不相等”
填“相等”或“不相等” ,所求中和热
,所求中和热_________  填“相等”或“不相等”
填“相等”或“不相等” 。
。
(5)若用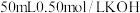 溶液进行上述实验,测得的中和热的数值会
溶液进行上述实验,测得的中和热的数值会_________  填“偏大”、“偏小”或“无影响”
填“偏大”、“偏小”或“无影响” 。
。
 溶液与
溶液与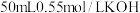 溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题
溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题 
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是
(2)烧杯间填满碎纸条的作用是
(3)实验数据如下表:
| 温度 实验 次数 | 起始温度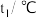 | 终止温度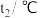 | 温度差平均值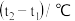 | ||
 | KOH | 平均值 | |||
| 1 | 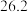 |  |  |  | |
| 2 | 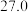 | 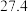 | 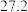 | 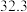 | |
| 3 | 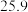 | 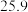 | 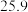 | 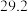 | |
| 4 |  | 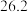 |  | 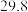 | |
 本次实验的温度差的平均值
本次实验的温度差的平均值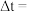
 。
。 近似地认为
近似地认为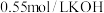 溶液和
溶液和 溶液的密度都是
溶液的密度都是 ,中和后生成溶液的比热容
,中和后生成溶液的比热容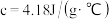 ,则中和热
,则中和热
 数值精确到
数值精确到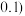 。
。 中和热测定实验中,下列操作一定会降低实验准确性的是
中和热测定实验中,下列操作一定会降低实验准确性的是 用滴定管
用滴定管 精量仪器,读数保留到
精量仪器,读数保留到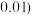 取所用酸碱溶液的体积
取所用酸碱溶液的体积 溶液在倒入小烧杯时,有少量溅出
溶液在倒入小烧杯时,有少量溅出 大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多
大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多 测量
测量 溶液的温度计用水洗净后才用来测KOH溶液的温度
溶液的温度计用水洗净后才用来测KOH溶液的温度(4)实验中改用
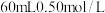 盐酸跟
盐酸跟 溶液进行反应,与上述实验相比,所放出的热量
溶液进行反应,与上述实验相比,所放出的热量 填“相等”或“不相等”
填“相等”或“不相等” ,所求中和热
,所求中和热 填“相等”或“不相等”
填“相等”或“不相等” 。
。(5)若用
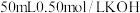 溶液进行上述实验,测得的中和热的数值会
溶液进行上述实验,测得的中和热的数值会 填“偏大”、“偏小”或“无影响”
填“偏大”、“偏小”或“无影响” 。
。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、量筒、泡沫塑料、泡沫塑料板、胶头滴管、0.5 mol·L-1盐酸、0.55 mol·L-1NaOH溶液,实验尚缺少的玻璃用品是______ 、_______________ 。他们记录的实验数据如下:
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1 g·cm-3。
(2)NaOH用量比HCl用量稍多的原因是_________________________________ 。
(3)根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:___________________ 。
(4)若用KOH代替NaOH,对测定结果________ (填“有”或 “无”)影响;若用醋酸代替HCl做实验,对测定结果__________ (填“有”或“无”)影响。
(5)两溶液混合后,怎样搅拌溶液_________________________________ 。
(1)实验桌上备有大、小两个烧杯、量筒、泡沫塑料、泡沫塑料板、胶头滴管、0.5 mol·L-1盐酸、0.55 mol·L-1NaOH溶液,实验尚缺少的玻璃用品是
| 实验用品 | 溶液温度 | 中和热 | |||
| t1 | t2 | ΔH | |||
| ① | 50 mL0.55 mol·L-1NaOH溶液 | 50 mL0.5mol·L-1HCl溶液 | 20 ℃ | 23.3 ℃ | |
| ② | 50 mL0.55 mol·L-1NaOH溶液 | 50 mL0.5 mol·L-1 HCl溶液 | 20 ℃ | 23.5 ℃ | |
(2)NaOH用量比HCl用量稍多的原因是
(3)根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:
(4)若用KOH代替NaOH,对测定结果
(5)两溶液混合后,怎样搅拌溶液
您最近一年使用:0次



