1.某课外小组同学对不同条件下铁钉的锈蚀进行了如图实验:
(1)一周后观察,铁钉被腐蚀程度最大的是___________ (填实验序号)。
(2)实验③中主要发生的是___________ (填“化学腐蚀”或“电化学腐蚀”)。
(3)铁发生电化学腐蚀的负极反应式为___________ 。
(4)钢铁表面常电镀一层铬(Cr)达到防腐蚀的目的,这是由于铬具有优良的抗腐蚀性能。电镀时,把待镀的金属制品与直流电源的___________ 极(填“正”或“负”)相连,把镀层金属铬作___________ 极(填“阳”或“阴”)。
(5)利用如图装置,可以模拟铁的电化学保护。
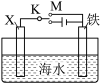
若X为碳棒,为减缓铁的腐蚀,开关K应置于N处,该电化学保护法称为___________ 若X为锌,开关K置于M处,铁棒上发生的电极反应式___________
| 实验序号 | ① | ② | ③ | ④ |
| 实验内容 | 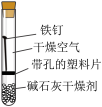 |  |  | 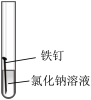 |
(1)一周后观察,铁钉被腐蚀程度最大的是
(2)实验③中主要发生的是
(3)铁发生电化学腐蚀的负极反应式为
(4)钢铁表面常电镀一层铬(Cr)达到防腐蚀的目的,这是由于铬具有优良的抗腐蚀性能。电镀时,把待镀的金属制品与直流电源的
(5)利用如图装置,可以模拟铁的电化学保护。

若X为碳棒,为减缓铁的腐蚀,开关K应置于N处,该电化学保护法称为
更新时间:2023-08-31 17:44:42
|
【知识点】 金属的电化学腐蚀与防护
相似题推荐
填空题
|
适中
(0.65)
【推荐1】电化学与我们的生活有着密切的联系,请结合电化学知识回答下列有关问题。
(1)炒过菜的铁锅未及时洗净(残液中含有NaCl),不久便会因腐蚀而出现红棕色锈斑。试回答:
铁锅的锈蚀应属于________________ (填“析氢腐蚀”或“吸氧腐蚀”),铁锅锈蚀的负极反应式为:__________________ ;正负极反应产物会继续发生反应,最终生成的红棕色锈斑的主要成分是________________ (填化学式)。
(2)下图是一个电化学过程的示意图。
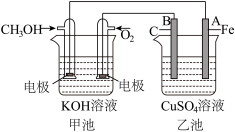
已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O
①甲池是_______ 装置,通O2一极的电极反应式为____________________ 。
②乙池中反应的化学方程式为_____________________________ 。如果开始加入的CuSO4溶液足量,当乙池中A(Fe)极的质量增加3.2 g时,甲池中消耗O2_________ mL(标准状况下)。
(1)炒过菜的铁锅未及时洗净(残液中含有NaCl),不久便会因腐蚀而出现红棕色锈斑。试回答:
铁锅的锈蚀应属于
(2)下图是一个电化学过程的示意图。

已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O
①甲池是
②乙池中反应的化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】铁及其化合物在工农业生产和人们的日常生活中具有广泛的用途。请回答下列与铁有关的化学反应原理问题:
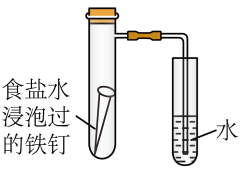
(1)铁制品暴露在潮湿的空气中容易发生腐蚀,通过如图所示装置可验证铁钉是否发生电化学腐蚀,该电化学腐蚀的类型是__ ,正极反应是__ 。
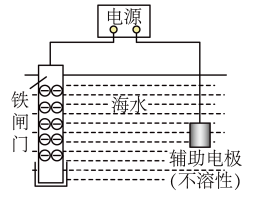
(2)利用电化学方法可对钢铁的腐蚀进行防护,如图装置为采用外加电流法保护铁闸门的示意图,铁闸门接电源___ (填“正极”或“负极”)。
(3)图丙装置可模拟工业生产高铁酸盐(FeO ),阳极反应为
),阳极反应为___ ,阴极区溶液的pH___ (填“增大”“减小”或“不变”)。

(4)利用高铁酸盐可制作新型可充电电池,该电池的总反应3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。充电时阳极反应为
3Zn(OH)2+2Fe(OH)3+4KOH。充电时阳极反应为__ ,放电时每转移0.3mol电子,正极有__ gK2FeO4被还原。
(1)铁制品暴露在潮湿的空气中容易发生腐蚀,通过如图所示装置可验证铁钉是否发生电化学腐蚀,该电化学腐蚀的类型是

(2)利用电化学方法可对钢铁的腐蚀进行防护,如图装置为采用外加电流法保护铁闸门的示意图,铁闸门接电源

(3)图丙装置可模拟工业生产高铁酸盐(FeO
 ),阳极反应为
),阳极反应为
(4)利用高铁酸盐可制作新型可充电电池,该电池的总反应3Zn+2K2FeO4+8H2O
 3Zn(OH)2+2Fe(OH)3+4KOH。充电时阳极反应为
3Zn(OH)2+2Fe(OH)3+4KOH。充电时阳极反应为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】铁及其化合物是中学化学中常见的物质。
(1)Fe基态原子核外电子排布式为____________________ 。
(2)钢铁生锈在生产和生活中比较普遍,可在钢铁设备上(如锅炉的内壁、船舶的外壳等)装上若干镁合金或锌块,以防止钢铁设备的腐蚀,这种方法通常被称为____________ 。
(3)铁件表面镀铜可有效防止铁被腐蚀,电镀时,以CuSO4溶液为电解液,阴极的电极反应式为________ 。
(4)实验室中可用铁氰化钾溶液检验Fe2+,该反应的离子方程式为________________ 。
(5)常温时,FeCl3溶液pH<7,原因是(用离子方程式表示)____________________ 。
(6)FeCl3溶液加热蒸干并灼烧,所得到的固体物质是_____________ 。
(7)将0.1mol·L−1 FeCl3溶液滴加到Mg(OH)2悬浊液中,有红褐色沉淀产生。该反应的离子方程式为________________ 。
(1)Fe基态原子核外电子排布式为
(2)钢铁生锈在生产和生活中比较普遍,可在钢铁设备上(如锅炉的内壁、船舶的外壳等)装上若干镁合金或锌块,以防止钢铁设备的腐蚀,这种方法通常被称为
(3)铁件表面镀铜可有效防止铁被腐蚀,电镀时,以CuSO4溶液为电解液,阴极的电极反应式为
(4)实验室中可用铁氰化钾溶液检验Fe2+,该反应的离子方程式为
(5)常温时,FeCl3溶液pH<7,原因是(用离子方程式表示)
(6)FeCl3溶液加热蒸干并灼烧,所得到的固体物质是
(7)将0.1mol·L−1 FeCl3溶液滴加到Mg(OH)2悬浊液中,有红褐色沉淀产生。该反应的离子方程式为
您最近一年使用:0次



