Na2CO3和NaHCO3是两种常见的钠盐。
(1)下列关于Na2CO3和NaHCO3的说法中,正确的是___________ (填字母)。
a.Na2CO3和NaHCO3的溶液均显碱性
b.相同温度下,NaHCO3的溶解度大于Na2CO3
c.向等质量的Na2CO3和NaHCO3固体中分别滴加足量的盐酸,相同条件下产生CO2的体积也相同
(2)按下图所示装置实验,可得到“Na2CO3的热稳定性比NaHCO3强”的结论,证据是___________ 。

(3)写出B中反应的化学方程式___________ 。
(1)下列关于Na2CO3和NaHCO3的说法中,正确的是
a.Na2CO3和NaHCO3的溶液均显碱性
b.相同温度下,NaHCO3的溶解度大于Na2CO3
c.向等质量的Na2CO3和NaHCO3固体中分别滴加足量的盐酸,相同条件下产生CO2的体积也相同
(2)按下图所示装置实验,可得到“Na2CO3的热稳定性比NaHCO3强”的结论,证据是

(3)写出B中反应的化学方程式
更新时间:2023-09-30 17:01:15
|
相似题推荐
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐1】 和
和 是厨房中常见的两种盐。
是厨房中常见的两种盐。
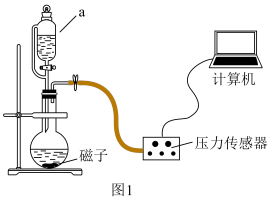
Ⅰ.某学生使用传感器进行如下实验(装置如图1),实验数据如图2:

i.向反应器中加入 的
的 溶液,逐滴滴加
溶液,逐滴滴加  的盐酸溶液。
的盐酸溶液。
ii.向反应器中加入 溶液,逐滴滴加一定体积的
溶液,逐滴滴加一定体积的  的盐酸溶液。
的盐酸溶液。
(1)若用无水碳酸钠来配制 的
的 溶液,需在
溶液,需在___________ (填仪器名称)上称取___________  无水碳酸钠。
无水碳酸钠。
(2)配制上述溶液用到的“容量瓶”是___________。
(3)定容操作时:沿着玻璃棒向容量瓶中加水至___________ 处,改用胶头滴管继续滴加水至凹液面最低处与刻度线相平,盖好瓶塞,颠倒摇匀。
(4)实验i中,当碳酸钠溶液与盐酸开始发生反应,压力传感器前 采集的数据如图所示,结合离子方程式用文字表述原因
采集的数据如图所示,结合离子方程式用文字表述原因___________ 。
(5)实验ii为实验i的对照实验,根据图2信息,反应器中加入 溶液,其体积和浓度对应数值最合适的是
溶液,其体积和浓度对应数值最合适的是___________ 。
A.40、0.4 B.20、0.4 C.20、0.2
(6)利用如图3实验比较碳酸钠和碳酸氢钠的热稳定性,则物质甲的为___________ 。

a. B.NaHCO3
B.NaHCO3
Ⅱ.如图4所示,此装置可用来制备 并验证其还原性,填写下列空白:
并验证其还原性,填写下列空白:
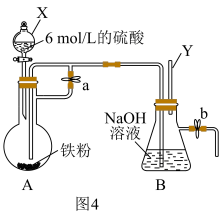
(7)检验反应后圆底烧瓶中是否有 生成所需试剂为
生成所需试剂为___________
(8)实验完毕,B瓶中产生 ,为验证其还原性,打开b处止水夹,充入一段时间空气,此时B瓶中发生的反应为(写化学方程式)
,为验证其还原性,打开b处止水夹,充入一段时间空气,此时B瓶中发生的反应为(写化学方程式)___________ ,现象:___________ 。
 和
和 是厨房中常见的两种盐。
是厨房中常见的两种盐。Ⅰ.某学生使用传感器进行如下实验(装置如图1),实验数据如图2:


i.向反应器中加入
 的
的 溶液,逐滴滴加
溶液,逐滴滴加  的盐酸溶液。
的盐酸溶液。ii.向反应器中加入
 溶液,逐滴滴加一定体积的
溶液,逐滴滴加一定体积的  的盐酸溶液。
的盐酸溶液。(1)若用无水碳酸钠来配制
 的
的 溶液,需在
溶液,需在 无水碳酸钠。
无水碳酸钠。(2)配制上述溶液用到的“容量瓶”是___________。
A. | B. | C.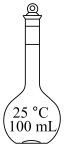 | D.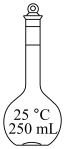 |
(3)定容操作时:沿着玻璃棒向容量瓶中加水至
(4)实验i中,当碳酸钠溶液与盐酸开始发生反应,压力传感器前
 采集的数据如图所示,结合离子方程式用文字表述原因
采集的数据如图所示,结合离子方程式用文字表述原因(5)实验ii为实验i的对照实验,根据图2信息,反应器中加入
 溶液,其体积和浓度对应数值最合适的是
溶液,其体积和浓度对应数值最合适的是A.40、0.4 B.20、0.4 C.20、0.2
(6)利用如图3实验比较碳酸钠和碳酸氢钠的热稳定性,则物质甲的为

a.
 B.NaHCO3
B.NaHCO3Ⅱ.如图4所示,此装置可用来制备
 并验证其还原性,填写下列空白:
并验证其还原性,填写下列空白:
(7)检验反应后圆底烧瓶中是否有
 生成所需试剂为
生成所需试剂为(8)实验完毕,B瓶中产生
 ,为验证其还原性,打开b处止水夹,充入一段时间空气,此时B瓶中发生的反应为(写化学方程式)
,为验证其还原性,打开b处止水夹,充入一段时间空气,此时B瓶中发生的反应为(写化学方程式)
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐2】Na2CO3可用于纺织、制肥皂、造纸、制玻璃等,NaHCO3可用于制药、焙制糕点等,两者都是白色固体;某实验小组通过以下实验来探究Na2CO3和NaHCO3两种物质的性质。
(1)称取两种固体各2g,分别放入两个小烧杯中,再各滴加10mL蒸馏水,振荡,测量温度变化;待固体充分溶解,并恢复至室温后,向所得溶液中各滴加2滴酚酞试液。
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得到结论:溶解性:Na2CO3_________ NaHCO3(填“大于”“小于”或“等于”)。
②同学们在两烧杯中还观察到了其它现象。其中,盛放Na2CO3的烧杯中出现的现象:Ⅰ溶液温度升高;Ⅱ_________ (填字母序号)。
a.滴入酚酞后呈无色 b.滴入酚酞后呈红色
(2)“套管实验”的实验装置如图所示,整个实验过程中,能观察到烧杯B中的现象是澄清石灰水变_________ (填“浑浊”“澄清”)。

(3)写出实验过程中试管中发生反应的化学方程式:_________ 。
(4)该实验可证明NaHCO3的热稳定性_________ (填“强于”“弱于”或“等于”)Na2CO3;证明热稳定性的实验装置中,能否将NaHCO3、Na2CO3的位置互换?________ (填“能”或“不能”)。
(5)等质量的Na2CO3和NaHCO3分别与同体积同浓度的盐酸反应的剧烈程度:Na2CO3_________ NaHCO3(填“大于”“小于”或“等于”)。能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作是_________ 。
a.将Na2CO3和NaHCO3配制成同浓度的溶液,用pH试纸测定pH值并做比较
b.分别在这两种物质的溶液中,加入少量CaCl2溶液
c.分别在这两种物质的溶液中,加入少量Ca(OH)2溶液
(1)称取两种固体各2g,分别放入两个小烧杯中,再各滴加10mL蒸馏水,振荡,测量温度变化;待固体充分溶解,并恢复至室温后,向所得溶液中各滴加2滴酚酞试液。
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得到结论:溶解性:Na2CO3
②同学们在两烧杯中还观察到了其它现象。其中,盛放Na2CO3的烧杯中出现的现象:Ⅰ溶液温度升高;Ⅱ
a.滴入酚酞后呈无色 b.滴入酚酞后呈红色
(2)“套管实验”的实验装置如图所示,整个实验过程中,能观察到烧杯B中的现象是澄清石灰水变

(3)写出实验过程中试管中发生反应的化学方程式:
(4)该实验可证明NaHCO3的热稳定性
(5)等质量的Na2CO3和NaHCO3分别与同体积同浓度的盐酸反应的剧烈程度:Na2CO3
a.将Na2CO3和NaHCO3配制成同浓度的溶液,用pH试纸测定pH值并做比较
b.分别在这两种物质的溶液中,加入少量CaCl2溶液
c.分别在这两种物质的溶液中,加入少量Ca(OH)2溶液
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐3】Ⅰ.Na2CO3和NaHCO3是厨房中常见的两种盐,可用化学性质的差异进行鉴别。回答下列问题:
(1)热稳定性差异。乙组设计如图装置进行实验(加热及夹持装置省略)。

将分别装有Na2CO3和NaHCO3的试管同时放入甘油浴加热(甘油沸点为290℃)。该实验用饱和碳酸钠溶液检验反应的产物,b试管中的实验现象为:___________ ,试管b中发生反应的化学方程式为___________ 。
(2)取一定质量的Na2CO3和NaHCO3混合物灼烧至恒重,冷却至室温,共收集到4.4g气体。加热后剩余的固体物质与足量盐酸反应,共收集到8.8g气体。请分别求出原固体混合物中Na2CO3和NaHCO3的质量分别为___________ g、___________ g。
(3)有同学提出:取一定质量的Na2CO3和NaHCO3混合物灼烧至恒重,将产生的气体通入足量Ba(OH)2溶液中,通过生成的沉淀质量计算碳酸钠的含量,发现测量值明显偏大,可能的原因是___________ 。
Ⅱ.我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献,下图为联合制碱法的主要过程(部分物质已略去)。

已知:i.NH3极易溶于水并生成碱,与酸反应生成盐,如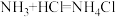 。
。
ii.有关物质的溶解度(20℃)
(4)沉淀池中主要沉淀物___________ (化学式),发生反应的化学方程式为___________ 。
(1)热稳定性差异。乙组设计如图装置进行实验(加热及夹持装置省略)。

将分别装有Na2CO3和NaHCO3的试管同时放入甘油浴加热(甘油沸点为290℃)。该实验用饱和碳酸钠溶液检验反应的产物,b试管中的实验现象为:
(2)取一定质量的Na2CO3和NaHCO3混合物灼烧至恒重,冷却至室温,共收集到4.4g气体。加热后剩余的固体物质与足量盐酸反应,共收集到8.8g气体。请分别求出原固体混合物中Na2CO3和NaHCO3的质量分别为
(3)有同学提出:取一定质量的Na2CO3和NaHCO3混合物灼烧至恒重,将产生的气体通入足量Ba(OH)2溶液中,通过生成的沉淀质量计算碳酸钠的含量,发现测量值明显偏大,可能的原因是
Ⅱ.我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献,下图为联合制碱法的主要过程(部分物质已略去)。

已知:i.NH3极易溶于水并生成碱,与酸反应生成盐,如
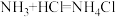 。
。ii.有关物质的溶解度(20℃)
| 物质 | NaCl |  |  |  |
| 溶解度/g | 36.0 | 21.7 | 9.6 | 37.2 |
(4)沉淀池中主要沉淀物
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
解题方法
【推荐1】A、B、C、D、E、X是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。

Ⅰ.若A为一种淡黄色粉末,且A为化合物,回答下列问题:
(1)A与H2O反应的化学方程式为_________ ;
(2)若X为具有较强还原性的非金属单质,通常为黑色粉末,写出E的化学式_________ ;
(3)若X为一种造成温室效应的气体,则鉴别等浓度的D、E两种溶液,可选择的试剂为_________;
Ⅱ若A为黄绿色气体,具有很强的氧化性。
(4)若C溶液显强酸性,则 的化学式为
的化学式为_________ ;向B溶液中滴加石蕊试液,出现的现象为_________ ;
Ⅲ.若A为一种金属单质,其焰色试验为黄色。
(5)A通常保存在_________ 中,A与H2O反应的离子方程式为_________ 。

Ⅰ.若A为一种淡黄色粉末,且A为化合物,回答下列问题:
(1)A与H2O反应的化学方程式为
(2)若X为具有较强还原性的非金属单质,通常为黑色粉末,写出E的化学式
(3)若X为一种造成温室效应的气体,则鉴别等浓度的D、E两种溶液,可选择的试剂为_________;
| A.NaCl溶液 | B.盐酸溶液 | C.Ca(OH)2溶液 | D.酚酞溶液 |
Ⅱ若A为黄绿色气体,具有很强的氧化性。
(4)若C溶液显强酸性,则
 的化学式为
的化学式为Ⅲ.若A为一种金属单质,其焰色试验为黄色。
(5)A通常保存在
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐2】化学是人类进步的阶梯.了解物质的组成和性质,并合理使用会在一定程度上改善我们的生活.通过对下列几种生活中常见物质的分析,回答下列问题:
①纯碱;②铁红;③“84”消毒液;④小苏打;⑤食盐;⑥烧碱.
(1)上述物质中属于碱的是______ (填序号).
(2)上述物质能漂白有色鲜花的是______ (填序号),利用了该物质的______ (填“氧化性”“还原性”“酸性”或“碱性”).
(3)铁红与稀盐酸反应的离子方程式为______ .
(4)工业上可利用电解NaCl溶液的方法制备 ,同时生成NaOH和
,同时生成NaOH和 ,该反应的化学方程式为
,该反应的化学方程式为______ ;利用该方法每制备71g ,理论上转移电子的物质的量为
,理论上转移电子的物质的量为______ .
(5)请设计实验,鉴别固体①和④:______ .
①纯碱;②铁红;③“84”消毒液;④小苏打;⑤食盐;⑥烧碱.
(1)上述物质中属于碱的是
(2)上述物质能漂白有色鲜花的是
(3)铁红与稀盐酸反应的离子方程式为
(4)工业上可利用电解NaCl溶液的方法制备
 ,同时生成NaOH和
,同时生成NaOH和 ,该反应的化学方程式为
,该反应的化学方程式为 ,理论上转移电子的物质的量为
,理论上转移电子的物质的量为(5)请设计实验,鉴别固体①和④:
您最近一年使用:0次



