实验室用固体KCl配制0.5mol/L的KCl溶液450mL,有以下仪器:①烧杯②胶头滴管③1000mL容量瓶④500mL容量瓶⑤玻璃棒⑥托盘天平(带砝码)⑦酒精灯⑧药匙
(1)配制时时使用的仪器有_______ (填代号)。
(2)该实验两次用到玻璃棒,其作用分别是_______ 、_______ 。
(3)配制时一般可分为以下几个步骤:①称量②计算③转移④溶解⑤摇匀⑥定容⑦洗涤⑧冷却。其正确的操作顺序为_______
(4)试计算应称取的KCl固体的质量为_______  。取出配制后的该KCl溶液10mL加水稀释到100mL,稀释后溶液中KCl的物质的量浓度是
。取出配制后的该KCl溶液10mL加水稀释到100mL,稀释后溶液中KCl的物质的量浓度是_______ 。
(5)下列操作对KCl溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)。
①摇匀后发现液面低于刻度线再加水_______ ;
②定容时俯视观察液面_______ 。
(1)配制时时使用的仪器有
(2)该实验两次用到玻璃棒,其作用分别是
(3)配制时一般可分为以下几个步骤:①称量②计算③转移④溶解⑤摇匀⑥定容⑦洗涤⑧冷却。其正确的操作顺序为
(4)试计算应称取的KCl固体的质量为
 。取出配制后的该KCl溶液10mL加水稀释到100mL,稀释后溶液中KCl的物质的量浓度是
。取出配制后的该KCl溶液10mL加水稀释到100mL,稀释后溶液中KCl的物质的量浓度是(5)下列操作对KCl溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)。
①摇匀后发现液面低于刻度线再加水
②定容时俯视观察液面
更新时间:2023-12-21 10:51:11
|
相似题推荐
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐1】实验室需要0.1 mol·L-1NaOH溶液450 mL和0.5 mol·L-1硫酸溶液 500 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是___________ (填字母),配制上述溶液还需用到的玻璃仪器是___________ (填仪器名称)。
A. B.
B.  C.
C.  D.
D.  E.
E. 
(2)下列操作中,容量瓶所不具备的功能是___________ (填字母)。
A.配制一定体积准确浓度的标准溶液 B.长时间贮存溶液
C.测量容量瓶规格以下的任意体积的液体 D.直接用来准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为___________ g.溶解时需要使用玻璃棒,目的是___________ 。
(4)转移、洗涤。在转移时应使用玻璃棒引流,需要洗涤烧杯和玻璃棒2~3次是为了___________ 。
(5)向容量瓶中加水至液面接近刻度线___________ 处,改用___________ 加水,使溶液凹液面与刻度线相
(6)在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度___________ 0.1 mol·L-1(填“大于”“等于”或“小于”,下同)。若NaOH溶液在转移至容量瓶时未经冷却,则所得溶液浓度___________ 0.1 mol·L-1。
(7)根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为___________ mL(计算结果保留一位小数)。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是___________ 。
(1)如图所示的仪器中配制溶液肯定不需要的是
A.
 B.
B.  C.
C.  D.
D.  E.
E. 
(2)下列操作中,容量瓶所不具备的功能是
A.配制一定体积准确浓度的标准溶液 B.长时间贮存溶液
C.测量容量瓶规格以下的任意体积的液体 D.直接用来准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为
(4)转移、洗涤。在转移时应使用玻璃棒引流,需要洗涤烧杯和玻璃棒2~3次是为了
(5)向容量瓶中加水至液面接近刻度线
(6)在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度
(7)根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐2】为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据,回答下列问题:
(已知:c=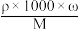 ;ω—质量分数;ρ一溶液的密度,单位g/cm3;c—物质的量浓度单位mol/L;M—摩尔质量,单位g/mol)
;ω—质量分数;ρ一溶液的密度,单位g/cm3;c—物质的量浓度单位mol/L;M—摩尔质量,单位g/mol)
(1)该浓盐酸中HCl的物质的量浓度为___________
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是___________ 。
A.溶液中HCl的物质的量 B.溶液的浓度 C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.400mol·L-1的稀盐酸。可供选用的仪器有:①胶头滴管;②玻璃棒;③烧杯④药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
①配制稀盐酸时,还缺少的仪器有___________ (写仪器名称)
②该学生需要用量筒量取___________ mL上述浓盐酸进行配制。
(4)该同学用配制的盐酸浓度偏小,则可能的原因是___________ 。
A.容量瓶未干燥
B.配制溶液时,未洗涤烧杯2~3次
C.配制溶液时,俯视容量瓶刻度线
D.加水时超过刻度线,用胶头滴管吸出
(5)假设该同学成功配制了0.400mol·L-1的盐酸,他又用该盐酸中和含0.4gNaOH的NaOH溶液,则该同学需用量筒量___________ mL0.400mol·L-1盐酸。
(已知:c=
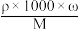 ;ω—质量分数;ρ一溶液的密度,单位g/cm3;c—物质的量浓度单位mol/L;M—摩尔质量,单位g/mol)
;ω—质量分数;ρ一溶液的密度,单位g/cm3;c—物质的量浓度单位mol/L;M—摩尔质量,单位g/mol)| 盐酸 分子式:HCl 相对分子质量:36.5 密度:1.19g·cm-3 HCl的质量分数:36.5% |
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是
A.溶液中HCl的物质的量 B.溶液的浓度 C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.400mol·L-1的稀盐酸。可供选用的仪器有:①胶头滴管;②玻璃棒;③烧杯④药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
①配制稀盐酸时,还缺少的仪器有
②该学生需要用量筒量取
(4)该同学用配制的盐酸浓度偏小,则可能的原因是
A.容量瓶未干燥
B.配制溶液时,未洗涤烧杯2~3次
C.配制溶液时,俯视容量瓶刻度线
D.加水时超过刻度线,用胶头滴管吸出
(5)假设该同学成功配制了0.400mol·L-1的盐酸,他又用该盐酸中和含0.4gNaOH的NaOH溶液,则该同学需用量筒量
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐3】某实验小组用( 溶液和
溶液和 硫酸溶液进行中和热的测定。 回答下列问题:
硫酸溶液进行中和热的测定。 回答下列问题:
Ⅰ.配制 硫酸溶液:
硫酸溶液:
(1)若配制 500 mL 0.50 mol·L⁻¹硫酸溶液,则需用量筒量取密度为
 溶质质量分数为98%的浓硫酸
溶质质量分数为98%的浓硫酸___________ mL(保留1位小数)。
Ⅱ.测定稀硫酸和稀氢氧化钠溶液反应的中和热的实验装置如图所示:
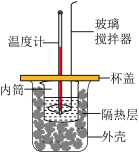
(2)玻璃搅拌器的作用为___________ 。可否将玻璃搅拌器换为环形铜丝搅拌器并写出理由:___________ 。
(3)装置中隔热层的作用是___________ 。
(4)写出表示该反应中和热的热化学方程式(中和热△H=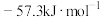 )
)__________ 。
(5)取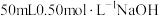 溶液和
溶液和 硫酸溶液进行实验,实验数据如下表。
硫酸溶液进行实验,实验数据如下表。
①温度差平均值为___________ ℃。
②近似认为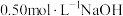 溶液和
溶液和  硫酸溶液的密度都是
硫酸溶液的密度都是  ,中和后生成的溶液的比热容
,中和后生成的溶液的比热容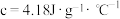 。则中和热△H=
。则中和热△H=__________  (保留1位小数)。
(保留1位小数)。
③上述结果与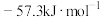 有偏差,产生此偏差的原因可能是
有偏差,产生此偏差的原因可能是____ (填标号)。
a.用量筒量取 NaOH 溶液的体积时仰视读数
b.分多次将 NaOH 溶液倒入盛有硫酸溶液的量热计的内筒中
c.用温度计测定硫酸起始温度后直接测定 NaOH溶液的温度
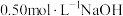 溶液和
溶液和 硫酸溶液进行中和热的测定。 回答下列问题:
硫酸溶液进行中和热的测定。 回答下列问题:Ⅰ.配制
 硫酸溶液:
硫酸溶液:(1)若配制 500 mL 0.50 mol·L⁻¹硫酸溶液,则需用量筒量取密度为

 溶质质量分数为98%的浓硫酸
溶质质量分数为98%的浓硫酸Ⅱ.测定稀硫酸和稀氢氧化钠溶液反应的中和热的实验装置如图所示:

(2)玻璃搅拌器的作用为
(3)装置中隔热层的作用是
(4)写出表示该反应中和热的热化学方程式(中和热△H=
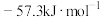 )
)(5)取
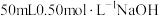 溶液和
溶液和 硫酸溶液进行实验,实验数据如下表。
硫酸溶液进行实验,实验数据如下表。| 实验次数 | 起始温度 t1/℃ | 终止温度 t2/℃ | 温度差(t2-t1)/℃ | ||
| H2SO4溶液 | NaOH 溶液 | 平均值 | |||
| 1 | 27.1 | 27.3 | 27.2 | 31.2 | |
| 2 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 3 | 26.3 | 26.3 | 26.3 | 30.4 | |
②近似认为
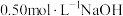 溶液和
溶液和  硫酸溶液的密度都是
硫酸溶液的密度都是  ,中和后生成的溶液的比热容
,中和后生成的溶液的比热容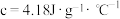 。则中和热△H=
。则中和热△H= (保留1位小数)。
(保留1位小数)。③上述结果与
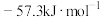 有偏差,产生此偏差的原因可能是
有偏差,产生此偏差的原因可能是a.用量筒量取 NaOH 溶液的体积时仰视读数
b.分多次将 NaOH 溶液倒入盛有硫酸溶液的量热计的内筒中
c.用温度计测定硫酸起始温度后直接测定 NaOH溶液的温度
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐1】现有以下8种物质:
①熔融状态的NaCl、②NO2、③NaHCO3、④铜、⑤AgCl、⑥酒精、⑦稀H2SO4、⑧FeCl3溶液。
(1)上述物质中能导电的是_______ (填序号),属于电解质的是_______ (填序号)。
(2)要配制100mL2.0mol/L的NaCl溶液,主要仪器有托盘天平、药匙、量筒、烧杯、玻璃棒、胶头滴管和容量瓶等;转移溶液时,若不慎洒落少许溶液,则所得溶液浓度_______ (填“偏大”、“偏小”或“无影响”),用少量蒸馏水洗涤烧杯内壁和玻璃棒2-3次,洗涤液全部注入容量瓶,当液面离容量瓶刻度线下1-2厘米时,改用_______ (填仪器名称)定容。
(3)下列描述的分别是胶体的性质或现象,请按要求填空:
A.胶体的聚沉 B.胶体的电泳 C.丁达尔效应
①“卤水点豆腐,一物降一物”,这里说到的是豆腐的制作,利用的胶体性质是_______ (填字母,下同)。
②当光束通过蓝墨水时,在与光束垂直的方向可看到一条光亮的“通路”,这种现象称为_______ 。
③工厂采用高压静电除尘,利用的胶体性质是_______ 。
①熔融状态的NaCl、②NO2、③NaHCO3、④铜、⑤AgCl、⑥酒精、⑦稀H2SO4、⑧FeCl3溶液。
(1)上述物质中能导电的是
(2)要配制100mL2.0mol/L的NaCl溶液,主要仪器有托盘天平、药匙、量筒、烧杯、玻璃棒、胶头滴管和容量瓶等;转移溶液时,若不慎洒落少许溶液,则所得溶液浓度
(3)下列描述的分别是胶体的性质或现象,请按要求填空:
A.胶体的聚沉 B.胶体的电泳 C.丁达尔效应
①“卤水点豆腐,一物降一物”,这里说到的是豆腐的制作,利用的胶体性质是
②当光束通过蓝墨水时,在与光束垂直的方向可看到一条光亮的“通路”,这种现象称为
③工厂采用高压静电除尘,利用的胶体性质是
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐2】某实验需要用1.0 mol·L-1 NaOH溶液450 mL。
(1)配制该溶液的实验操作步骤有:
a.在托盘天平上称量________ g NaOH固体放入烧杯中,加适量蒸馏水溶解,冷却至室温。
b.把烧杯中的溶液小心地注入__________ 中。
c.将蒸馏水注入容量瓶,液面离容量瓶颈刻度线下1~2 cm处,改用________ 加蒸馏水至液面与刻度线相切。
d.用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,并将洗涤液转入容量瓶中。轻轻摇动容量瓶,使溶液混合均匀。
e.将瓶塞塞紧,充分摇匀。
(2)操作步骤的正确顺序为________ 。
(3)该配制过程中两次用到玻璃棒,其作用分别是________________ 、________________ 。
(4)在进行b步操作时,不慎有液体溅出,下列处理措施正确的是________ (填序号)。
A 继续进行实验
B 添加部分NaOH溶液
C 倒掉溶液,重新配制
D 倒掉溶液,洗净容量瓶后重新配制
(1)配制该溶液的实验操作步骤有:
a.在托盘天平上称量
b.把烧杯中的溶液小心地注入
c.将蒸馏水注入容量瓶,液面离容量瓶颈刻度线下1~2 cm处,改用
d.用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,并将洗涤液转入容量瓶中。轻轻摇动容量瓶,使溶液混合均匀。
e.将瓶塞塞紧,充分摇匀。
(2)操作步骤的正确顺序为
(3)该配制过程中两次用到玻璃棒,其作用分别是
(4)在进行b步操作时,不慎有液体溅出,下列处理措施正确的是
A 继续进行实验
B 添加部分NaOH溶液
C 倒掉溶液,重新配制
D 倒掉溶液,洗净容量瓶后重新配制
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐3】实验室需要450ml 0.12mol/L的NaOH溶液,有如下操作:
①把称好的NaOH放入小烧杯中,加适量蒸馏水溶解
②根据计算用托盘天平称取NaOH
③把①所得溶液小心转入一定容积的容量瓶中
④继续向容量瓶中加蒸馏水至液面距刻度线1cm-2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切
⑤用少量蒸馏水洗涤烧杯和玻璃棒2-3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀。
⑥将容量瓶瓶塞塞紧,充分摇匀。
请填写下列空白:
(1)上述步骤中要称量的NaOH固体为_______ 克
(2)操作步骤的正确顺序为(填序号)_______ 。
(3)实验室有如下规格的容量瓶:①100mL ②250mL ③500mL ④1000mL,本实验选用_______ mL(填序号)。
(4)本实验用到的基本实验仪器除托盘天平,药匙以外还有:_______ 。
(5)误差分析:(填“偏高”、“偏低”或“无影响”)
①称量NaOH固体时,物码倒置(1克以下用游码)_______
②没有进行操作步骤⑤_______
③没有将溶解好的液体冷却就直接倒入容量瓶中_______
④容量瓶中原来有少量水_______
⑤某同学定容时仰视容量瓶刻度线_______
⑥定容,摇匀后发现液面低于刻度线,拿胶头滴管又加入蒸馏水使液体凹液面再次与刻度线相切_______ 。
①把称好的NaOH放入小烧杯中,加适量蒸馏水溶解
②根据计算用托盘天平称取NaOH
③把①所得溶液小心转入一定容积的容量瓶中
④继续向容量瓶中加蒸馏水至液面距刻度线1cm-2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切
⑤用少量蒸馏水洗涤烧杯和玻璃棒2-3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀。
⑥将容量瓶瓶塞塞紧,充分摇匀。
请填写下列空白:
(1)上述步骤中要称量的NaOH固体为
(2)操作步骤的正确顺序为(填序号)
(3)实验室有如下规格的容量瓶:①100mL ②250mL ③500mL ④1000mL,本实验选用
(4)本实验用到的基本实验仪器除托盘天平,药匙以外还有:
(5)误差分析:(填“偏高”、“偏低”或“无影响”)
①称量NaOH固体时,物码倒置(1克以下用游码)
②没有进行操作步骤⑤
③没有将溶解好的液体冷却就直接倒入容量瓶中
④容量瓶中原来有少量水
⑤某同学定容时仰视容量瓶刻度线
⑥定容,摇匀后发现液面低于刻度线,拿胶头滴管又加入蒸馏水使液体凹液面再次与刻度线相切
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐1】根据所做实验,回答以下问题:
Ⅰ.实验室需配置使用480mL0.5mol·L-1的NaCl溶液,有如下操作步骤:
①把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶液;
②把①所得溶液小心转入容量瓶中;
③继续向容量瓶中加蒸馏水至液面距刻度2cm~3cm处,改用胶头滴管小心滴加蒸馏水至溶液凹面底部与
刻度线相切;
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液体都小心转入容量瓶,并轻轻摇匀;
⑤将容量瓶塞塞紧,充分摇匀。请填写下列空白:
(1)操作步骤的正确顺序为(填序号)__ 。其中第①步需要称取的NaCl为_ g(精确到小数点后三位)。
(2)本实验用到的基本玻璃仪器有胶头滴管,烧杯和、__ 、__ 。
(3)实验操作中,下列操作会使所配溶液浓度偏低的是__ 。
a.没有进行操作步骤④
b.容量瓶中原残留少量蒸馏水
c.摇匀后液面低于刻度线,又加水定容到刻度线
d.使用热水加速固体溶解,并立即进行下一步操作
e.定容时,俯视刻度线
Ⅰ.实验室需配置使用480mL0.5mol·L-1的NaCl溶液,有如下操作步骤:
①把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶液;
②把①所得溶液小心转入容量瓶中;
③继续向容量瓶中加蒸馏水至液面距刻度2cm~3cm处,改用胶头滴管小心滴加蒸馏水至溶液凹面底部与
刻度线相切;
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液体都小心转入容量瓶,并轻轻摇匀;
⑤将容量瓶塞塞紧,充分摇匀。请填写下列空白:
(1)操作步骤的正确顺序为(填序号)
(2)本实验用到的基本玻璃仪器有胶头滴管,烧杯和、
(3)实验操作中,下列操作会使所配溶液浓度偏低的是
a.没有进行操作步骤④
b.容量瓶中原残留少量蒸馏水
c.摇匀后液面低于刻度线,又加水定容到刻度线
d.使用热水加速固体溶解,并立即进行下一步操作
e.定容时,俯视刻度线
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐2】黑木耳中含有丰富的人体所必需的铁元素。某研究小组测定黑木耳中铁元素含量,实验方案如下。回答下列问题:
(1)配制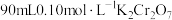 溶液
溶液
①选择仪器:所必需的玻璃仪器除烧杯、胶头滴管外,还有___________ 、___________ 。
②计算,称量:需用天平称量___________ 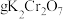 固体(
固体(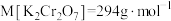 )。
)。
③溶解,恢复到室温、转移、洗涤、定容。
定容的操作是:将蒸馏水注入容量瓶,先___________ ,再改用胶头滴管加水至溶液凹液面最低处与刻度线相切。
④下列操作使结果偏低的是___________ 。
A.定容时,加水超过刻度线,用胶头滴管吸取多余的液体
B.容量瓶未干燥即用来配制溶液
C.定容时,俯视刻度线 D.未用蒸馏水洗涤烧杯和玻璃棒
(2)测定黑木耳中铁元素含量(已知黑木耳提取液中铁元素以Fe2+和Fe3+的形式存在)
①“步骤一”中加入过量铜粉的目的是___________ 。
②请配平步骤②中发生反应的离子反应方程式:___________
6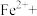 1
1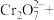 □
□ =□
=□ □
□ □
□ 。
。
③实验测得黑木耳中铁元素的质量分数为___________ 。
(1)配制
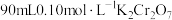 溶液
溶液①选择仪器:所必需的玻璃仪器除烧杯、胶头滴管外,还有
②计算,称量:需用天平称量
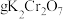 固体(
固体(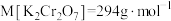 )。
)。③溶解,恢复到室温、转移、洗涤、定容。
定容的操作是:将蒸馏水注入容量瓶,先
④下列操作使结果偏低的是
A.定容时,加水超过刻度线,用胶头滴管吸取多余的液体
B.容量瓶未干燥即用来配制溶液
C.定容时,俯视刻度线 D.未用蒸馏水洗涤烧杯和玻璃棒
(2)测定黑木耳中铁元素含量(已知黑木耳提取液中铁元素以Fe2+和Fe3+的形式存在)
| 步骤一 | 取112g黑木耳,经灼烧、酸浸制得提取液,加入过量的铜粉 |
| 步骤二 | 过滤,向滤液中加入0.10mol/L酸性 溶液10mL时,恰好完全反应 溶液10mL时,恰好完全反应 |
②请配平步骤②中发生反应的离子反应方程式:
6
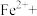 1
1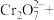 □
□ =□
=□ □
□ □
□ 。
。③实验测得黑木耳中铁元素的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐3】Ⅰ.实验室配制480mL 0.2mol•L﹣1的Na2SO4溶液,实验操作步骤有:
A.在托盘天平上称出________g硫酸钠固体,把它放在烧杯中,用适量的蒸馏水使它完全溶解并冷却至室温。
B.把制得的溶液小心地转移到容量瓶中。
C.继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,改用_______________小心滴加蒸馏水至溶液凹液面最低处与刻度线相切。
D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心注入容量瓶,并轻轻振荡。
E.将容量瓶瓶塞塞紧,充分摇匀。
请填写下列空白:
(1)操作步骤的正确顺序为(填序号):_______________ 。
(2)所用硫酸钠固体的质量是___________ g。
(3)本实验用到的基本仪器已有烧杯、天平(带砝码、镊子)、玻璃棒、药匙,C步骤空白处的仪器是_________________ ,还缺少的仪器是____________________ 。
(4)下列情况会使所配溶液浓度偏高的是(填序号)_______________ 。
a.定容时俯视刻度线
b.没进行上述的操作步骤D
c.摇匀后发现液面低于刻度线
d.砝码上沾有杂质
e.容量瓶使用前内壁沾有水珠
Ⅱ.掌握仪器名称、组装及使用方法是中学化学实验的基础。
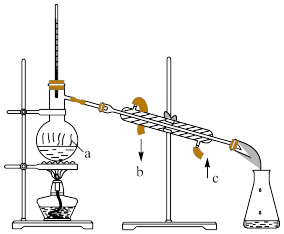
(1)写出仪器a名称:________________
(2)可用该方法分离的组合是____________
a.食盐和沙子
b.硝酸钾和氯化钠的混合溶液
c.四氯化碳和水
d.水和酒精
(3)冷凝水的通向是:_____ 口进_____ 口出(填图片上对应的字母)
A.在托盘天平上称出________g硫酸钠固体,把它放在烧杯中,用适量的蒸馏水使它完全溶解并冷却至室温。
B.把制得的溶液小心地转移到容量瓶中。
C.继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,改用_______________小心滴加蒸馏水至溶液凹液面最低处与刻度线相切。
D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心注入容量瓶,并轻轻振荡。
E.将容量瓶瓶塞塞紧,充分摇匀。
请填写下列空白:
(1)操作步骤的正确顺序为(填序号):
(2)所用硫酸钠固体的质量是
(3)本实验用到的基本仪器已有烧杯、天平(带砝码、镊子)、玻璃棒、药匙,C步骤空白处的仪器是
(4)下列情况会使所配溶液浓度偏高的是(填序号)
a.定容时俯视刻度线
b.没进行上述的操作步骤D
c.摇匀后发现液面低于刻度线
d.砝码上沾有杂质
e.容量瓶使用前内壁沾有水珠
Ⅱ.掌握仪器名称、组装及使用方法是中学化学实验的基础。

(1)写出仪器a名称:
(2)可用该方法分离的组合是
a.食盐和沙子
b.硝酸钾和氯化钠的混合溶液
c.四氯化碳和水
d.水和酒精
(3)冷凝水的通向是:
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐1】现用 固体配制
固体配制 溶液,可供选择的仪器有:玻璃棒、烧杯、电子天平、药匙、量筒。回答下列问题:
溶液,可供选择的仪器有:玻璃棒、烧杯、电子天平、药匙、量筒。回答下列问题:
(1)上述仪器中,还缺少的仪器是_______ ;
(2)经计算,需称取 固体质量为
固体质量为_______ g;
(3)将图中的实验步骤A~F按实验过程先后次序排列_______ →B→_______ →F→_______ →_______ ;

(4)将所配制的 溶液进行测定,发现浓度偏大,可能的原因是
溶液进行测定,发现浓度偏大,可能的原因是_______ ;
a.称量的 固体有杂质
固体有杂质
b.称量的 固体已经部分失去结晶水
固体已经部分失去结晶水
c.转移时没有洗涤烧杯和玻璃棒
d.定容时,加蒸馏水未到刻度线就停止滴加蒸馏水
e.定容时仰视刻度线
(5)下列溶液中,与 溶液中的
溶液中的 物质的量浓度相同的是
物质的量浓度相同的是_______ ;
a. 溶液 b.
溶液 b.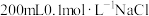 溶液
溶液
c. 溶液 d.
溶液 d. 溶液
溶液
 固体配制
固体配制 溶液,可供选择的仪器有:玻璃棒、烧杯、电子天平、药匙、量筒。回答下列问题:
溶液,可供选择的仪器有:玻璃棒、烧杯、电子天平、药匙、量筒。回答下列问题:(1)上述仪器中,还缺少的仪器是
(2)经计算,需称取
 固体质量为
固体质量为(3)将图中的实验步骤A~F按实验过程先后次序排列

(4)将所配制的
 溶液进行测定,发现浓度偏大,可能的原因是
溶液进行测定,发现浓度偏大,可能的原因是a.称量的
 固体有杂质
固体有杂质b.称量的
 固体已经部分失去结晶水
固体已经部分失去结晶水c.转移时没有洗涤烧杯和玻璃棒
d.定容时,加蒸馏水未到刻度线就停止滴加蒸馏水
e.定容时仰视刻度线
(5)下列溶液中,与
 溶液中的
溶液中的 物质的量浓度相同的是
物质的量浓度相同的是a.
 溶液 b.
溶液 b.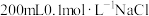 溶液
溶液c.
 溶液 d.
溶液 d. 溶液
溶液
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐2】实验室制配0.5 mol/L的NaOH溶液500 mL,有以下仪器:①烧杯 ②100 mL量筒 ③1000 mL容量瓶 ④500 mL容量瓶 ⑤玻璃棒 ⑥试管 ⑦药匙
(1) 配制时,必须使用的仪器有______ (填代号),还缺少的仪器是______ 。
(2) 实验两次用到玻璃棒,其作用分别是:______ 、______ 。
(3) 配制时,一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀⑤转移 ⑥洗涤 ⑦定容 ⑧冷却。其正确的操作顺序为______ 。
(4) 试分析下列操作对所配溶液的浓度有何影响。(填“偏高”、“偏低”或“无影响” )
①定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度,对所配溶液浓度的影响______ 。
②某同学观察液面的情况如图所示,则所配置的溶液的浓度______ 。

(5) 取出其中50ml溶液加水稀释到100ml,稀释后溶液中NaCl的物质的量浓度为______ 。
(1) 配制时,必须使用的仪器有
(2) 实验两次用到玻璃棒,其作用分别是:
(3) 配制时,一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀⑤转移 ⑥洗涤 ⑦定容 ⑧冷却。其正确的操作顺序为
(4) 试分析下列操作对所配溶液的浓度有何影响。(填“偏高”、“偏低”或“无影响” )
①定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度,对所配溶液浓度的影响
②某同学观察液面的情况如图所示,则所配置的溶液的浓度

(5) 取出其中50ml溶液加水稀释到100ml,稀释后溶液中NaCl的物质的量浓度为
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐3】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
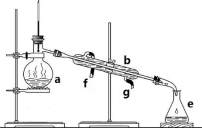

(1)写出下列仪器的名称:a.____________ ,b.___________ ,c.__________ 。
(2)仪器a~e中,使用前必须检查是否漏水的有___________ 。(填序号)
(3)若利用装置分离四氯化碳和酒精的混合物,还缺少的仪器是__________ ,将仪器补充完整后进行实验,温度计水银球的位置在_______ 处。冷凝水由____ 口流出(填f或g)。
(4)现需配制0.1mol/LNaOH溶液450mL,装置是某同学转移溶液的示意图。
①图中的错误是_____________________________ 。
②根据计算得知,所需NaOH的质量为_______ 。
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)_____________ 。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
(5)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)。若没有进行A操作___________ ;容量瓶用蒸馏洗涤后残留有少量的水_____________ ;若定容时俯视刻度线__________ 。


(1)写出下列仪器的名称:a.
(2)仪器a~e中,使用前必须检查是否漏水的有
(3)若利用装置分离四氯化碳和酒精的混合物,还缺少的仪器是
(4)现需配制0.1mol/LNaOH溶液450mL,装置是某同学转移溶液的示意图。
①图中的错误是
②根据计算得知,所需NaOH的质量为
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
(5)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)。若没有进行A操作
您最近一年使用:0次



