A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处在同一周期,A、C处在同一主族。C原子核内质子数等于A、B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍。试回答:
(1)这四种元素分别是:A____ ,B___ ,C___ ,D____ 。
(2)这四种元素中在常温常压下的液态或气态氢化物的稳定性由大而小的顺序是_____ 。
(3)A与B形成的三原子分子的电子式是___ ,B与D形成原子个数比为1∶1的化合物的电子式是_____ 。
(4)A元素某氧化物与D元素某氧化物反应生成单质的化学方程式是_______ 。
(1)这四种元素分别是:A
(2)这四种元素中在常温常压下的液态或气态氢化物的稳定性由大而小的顺序是
(3)A与B形成的三原子分子的电子式是
(4)A元素某氧化物与D元素某氧化物反应生成单质的化学方程式是
13-14高一·全国·课时练习 查看更多[4]
(已下线)2014学年高一化学人教版必修2 1章物质结构 元素周期律练习卷(已下线)2013-2014黑龙江省大庆铁人中学高一下学期期末考试化学试卷黑龙江省齐齐哈尔市第八中学2018-2019学年高一6月月考化学试题云南省广南二中2018-2019学年高一6月份考试化学试题
更新时间:2014/09/03 14:54:26
|
【知识点】 元素周期表 元素周期律
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】磷和砷是同主族的非金属元素。
(1)砷(As)元素位于元素周期表第____ 列;As原子能量最高的3个轨道在空间相互____ ;1个黄砷(As4)分子中含有_____ 个As﹣As键,键角_____ 度.
(2)黑磷的结构与石墨相似.最近中国科学家将黑磷“撕”成了二维结构,硬度和导电能力都大大提高,这种二维结构属于____ (选填编号).
a.离子晶体 b.原子晶体 c.分子晶体 d.其它类型
(3)与硫元素的相关性质比,以下不能说明P的非金属性比S弱的是_____ (选填编号).
a.磷难以与氢气直接化合 b.白磷易自燃 c.P﹣H的键能更小 d.H3PO4酸性更弱
(4)次磷酸钠(NaH2PO2)可用于化学镀镍,即通过化学反应在塑料镀件表面沉积镍﹣磷合金.
化学镀镍的溶液中含有Ni2+和H2PO2﹣,在酸性条件下发生以下镀镍反应:
___ Ni2++___ H2PO2﹣+___ H2O →____ Ni+____ H2PO3﹣+___ H+
①请配平上述化学方程式。
②上述反应中,若生成1mol H2PO3﹣,反应中转移电子的物质的量为______ 。
(5)NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示。
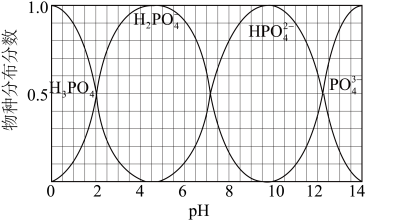
①pH=8时,溶液中主要含磷物种浓度大小关系为_________________ 。
②为获得尽可能纯的NaH2PO4,pH应控制在______________________________ 。
(1)砷(As)元素位于元素周期表第
(2)黑磷的结构与石墨相似.最近中国科学家将黑磷“撕”成了二维结构,硬度和导电能力都大大提高,这种二维结构属于
a.离子晶体 b.原子晶体 c.分子晶体 d.其它类型
(3)与硫元素的相关性质比,以下不能说明P的非金属性比S弱的是
a.磷难以与氢气直接化合 b.白磷易自燃 c.P﹣H的键能更小 d.H3PO4酸性更弱
(4)次磷酸钠(NaH2PO2)可用于化学镀镍,即通过化学反应在塑料镀件表面沉积镍﹣磷合金.
化学镀镍的溶液中含有Ni2+和H2PO2﹣,在酸性条件下发生以下镀镍反应:
①请配平上述化学方程式。
②上述反应中,若生成1mol H2PO3﹣,反应中转移电子的物质的量为
(5)NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示。

①pH=8时,溶液中主要含磷物种浓度大小关系为
②为获得尽可能纯的NaH2PO4,pH应控制在
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】I.2020年12月17日,我国“嫦娥五号”返回器携月壤成功着陆。研究发现,月壤中存在天然的铁、金、银、铅、锌、铜、锑、铼等矿物颗粒。
(1)写出铜的基态原子的电子排布式:______ 。
(2)基态Fe原子有______ 个未成对电子,Fe3+的电子排布式为______ 。
(3)Fe在周期表中位于第______ 周期第______ 族,属于______ 区。
Ⅱ.回答下列问题:
(4)p电子的原子轨道呈______ 形。
(5)基态Al3+核外共有______ 种不同运动状态的电子。
(6)钒(V)元素广泛用于催化及钢铁工业,其价层电子的轨道表示式为_______ 。
(1)写出铜的基态原子的电子排布式:
(2)基态Fe原子有
(3)Fe在周期表中位于第
Ⅱ.回答下列问题:
(4)p电子的原子轨道呈
(5)基态Al3+核外共有
(6)钒(V)元素广泛用于催化及钢铁工业,其价层电子的轨道表示式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】砷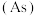 及其化合物与生产、生活密切相关,广泛应用在杀虫剂以及药物中。回答下列问题:
及其化合物与生产、生活密切相关,广泛应用在杀虫剂以及药物中。回答下列问题:
(1)砷是第四周期第ⅤA族元素。下列关于第ⅤA族元素及其化合物的说法不正确的是_______ (填字母)。
a.沸点: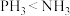
b.酸性: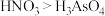
c. 的氧化物的水化物是强碱
的氧化物的水化物是强碱
d.形成的简单离子半径随着原子序数递增而增大
(2)工业生产中常用“古氏试砷法”检验微量砷,其反应原理如下:
①将含砷化合物转化为具有极强还原性的 。
。
② 与
与 溶液反应产生
溶液反应产生 与另一种固体,该反应的离子方程式:
与另一种固体,该反应的离子方程式:_______ 。
(3)砷及其化合物几乎都有毒,通常 价砷化合物的毒性强于
价砷化合物的毒性强于 价砷化合物。海产品中含有微量
价砷化合物。海产品中含有微量 价砷化合物,食用海鲜后不能马上进食水果的原因是
价砷化合物,食用海鲜后不能马上进食水果的原因是_______ 。
(4)砷酸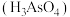 可用于制造杀虫剂、药物。
可用于制造杀虫剂、药物。 溶于稀硝酸中可得砷酸,此反应的化学方程式:
溶于稀硝酸中可得砷酸,此反应的化学方程式:_______ 。
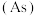 及其化合物与生产、生活密切相关,广泛应用在杀虫剂以及药物中。回答下列问题:
及其化合物与生产、生活密切相关,广泛应用在杀虫剂以及药物中。回答下列问题:(1)砷是第四周期第ⅤA族元素。下列关于第ⅤA族元素及其化合物的说法不正确的是
a.沸点:
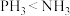
b.酸性:
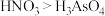
c.
 的氧化物的水化物是强碱
的氧化物的水化物是强碱d.形成的简单离子半径随着原子序数递增而增大
(2)工业生产中常用“古氏试砷法”检验微量砷,其反应原理如下:
①将含砷化合物转化为具有极强还原性的
 。
。②
 与
与 溶液反应产生
溶液反应产生 与另一种固体,该反应的离子方程式:
与另一种固体,该反应的离子方程式:(3)砷及其化合物几乎都有毒,通常
 价砷化合物的毒性强于
价砷化合物的毒性强于 价砷化合物。海产品中含有微量
价砷化合物。海产品中含有微量 价砷化合物,食用海鲜后不能马上进食水果的原因是
价砷化合物,食用海鲜后不能马上进食水果的原因是(4)砷酸
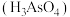 可用于制造杀虫剂、药物。
可用于制造杀虫剂、药物。 溶于稀硝酸中可得砷酸,此反应的化学方程式:
溶于稀硝酸中可得砷酸,此反应的化学方程式:
您最近一年使用:0次



