已知离子反应:RO3n-+6I - +6H +  R - +3I 2 +3H 2 O,试根据离子方程式必须“质量守恒、电荷守恒”等判断:n=
R - +3I 2 +3H 2 O,试根据离子方程式必须“质量守恒、电荷守恒”等判断:n=__________ ,R元素在 RO3n-中的化合价是__________ 。
 R - +3I 2 +3H 2 O,试根据离子方程式必须“质量守恒、电荷守恒”等判断:n=
R - +3I 2 +3H 2 O,试根据离子方程式必须“质量守恒、电荷守恒”等判断:n=
更新时间:2016-12-09 00:41:26
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】按要求填空
(1)写出下列反应的离子方程式
①硫酸与氢氧化钠溶液反应:__________________
②铜与硝酸银溶液反应:______________________
③铁与稀硫酸溶液反应:______________________
(2)分析下列反应的化学方程式,用双线桥法表示电子转移的方向和数目
①Zn+H2SO4 =ZnSO4+H2↑
___________________
②2KClO3 2KCl+3O2↑
2KCl+3O2↑
___________________
(3)分析所给化学方程式,用单线桥法表示电子转移的方向和数目
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
____________________
(1)写出下列反应的离子方程式
①硫酸与氢氧化钠溶液反应:
②铜与硝酸银溶液反应:
③铁与稀硫酸溶液反应:
(2)分析下列反应的化学方程式,用双线桥法表示电子转移的方向和数目
①Zn+H2SO4 =ZnSO4+H2↑
②2KClO3
 2KCl+3O2↑
2KCl+3O2↑(3)分析所给化学方程式,用单线桥法表示电子转移的方向和数目
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
您最近一年使用:0次
【推荐2】二氧化氯 是一种绿色消毒剂,常温常压下为黄绿色气体,易溶于水。常见的化学合成方法有氧化法和还原法。
是一种绿色消毒剂,常温常压下为黄绿色气体,易溶于水。常见的化学合成方法有氧化法和还原法。
(1)过硫酸盐氧化法:用原料亚氯酸钠 和过硫酸钠
和过硫酸钠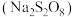 直接反应,操作简单,同时可得到副产品
直接反应,操作简单,同时可得到副产品 。
。
①制备时发生反应的离子方程式为___________ 。
②原料亚氯酸钠的阴离子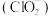 中
中 原子的杂化方式为
原子的杂化方式为___________ ,副产品 中阴离子的空间构型为
中阴离子的空间构型为___________ 。
(2)盐酸还原法:此法制得的二氧化氯消毒液中常含有 和
和 两种主要成分。为测定某二氧化氯消毒液中
两种主要成分。为测定某二氧化氯消毒液中 的浓度,进行如下实验:量取
的浓度,进行如下实验:量取 二氧化氯消毒液于锥形瓶中,加蒸馏水稀释到25.00mL,再向其中加入过量
二氧化氯消毒液于锥形瓶中,加蒸馏水稀释到25.00mL,再向其中加入过量 溶液,充分振荡;用
溶液,充分振荡;用 标准溶液滴定,消耗
标准溶液滴定,消耗 标准溶液5.50mL;加入稀
标准溶液5.50mL;加入稀 调节溶液
调节溶液 ,再用
,再用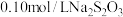 标准溶液滴定,第二次滴定消耗
标准溶液滴定,第二次滴定消耗 溶液20.00mL。
溶液20.00mL。
已知:
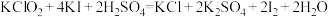

①计算该二氧化氯消毒液中 的物质的量浓度
的物质的量浓度___________ 。(写出计算过程)
②若实验中调节溶液 时稀硫酸用量不足,将导致测得的
时稀硫酸用量不足,将导致测得的 浓度
浓度___________ (填“偏高”、“偏低”或“无影响)。
 是一种绿色消毒剂,常温常压下为黄绿色气体,易溶于水。常见的化学合成方法有氧化法和还原法。
是一种绿色消毒剂,常温常压下为黄绿色气体,易溶于水。常见的化学合成方法有氧化法和还原法。(1)过硫酸盐氧化法:用原料亚氯酸钠
 和过硫酸钠
和过硫酸钠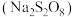 直接反应,操作简单,同时可得到副产品
直接反应,操作简单,同时可得到副产品 。
。①制备时发生反应的离子方程式为
②原料亚氯酸钠的阴离子
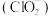 中
中 原子的杂化方式为
原子的杂化方式为 中阴离子的空间构型为
中阴离子的空间构型为(2)盐酸还原法:此法制得的二氧化氯消毒液中常含有
 和
和 两种主要成分。为测定某二氧化氯消毒液中
两种主要成分。为测定某二氧化氯消毒液中 的浓度,进行如下实验:量取
的浓度,进行如下实验:量取 二氧化氯消毒液于锥形瓶中,加蒸馏水稀释到25.00mL,再向其中加入过量
二氧化氯消毒液于锥形瓶中,加蒸馏水稀释到25.00mL,再向其中加入过量 溶液,充分振荡;用
溶液,充分振荡;用 标准溶液滴定,消耗
标准溶液滴定,消耗 标准溶液5.50mL;加入稀
标准溶液5.50mL;加入稀 调节溶液
调节溶液 ,再用
,再用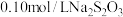 标准溶液滴定,第二次滴定消耗
标准溶液滴定,第二次滴定消耗 溶液20.00mL。
溶液20.00mL。已知:

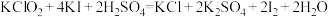

①计算该二氧化氯消毒液中
 的物质的量浓度
的物质的量浓度②若实验中调节溶液
 时稀硫酸用量不足,将导致测得的
时稀硫酸用量不足,将导致测得的 浓度
浓度
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】随着现代科学技术的快速发展,防腐蚀技术也在不断提高。
Ⅰ.金属的腐蚀原理
(1)中性环境中多为吸氧腐蚀,其正极的电极反应为________ 。
(2)析氢腐蚀和吸氧腐蚀的均会导致体系中c(OH-)________ (填“增大”、“不变”或“减小”)。
(3)不同酸性介质中,金属腐蚀原理并不相同。下图是密闭容器中,生铁在pH=2和pH=4的盐酸中压强随时间的变化过程。

图中代表pH=2的曲线是________ (填“a”或“b”)。
Ⅱ.金属的电化学防护
(1) 富锌涂料是使用广泛的防锈底漆,涂层中锌对钢铁保护的原理是________ 。
(2) 缓蚀剂是能明显减缓或阻止金属腐蚀的物质,钼酸钠(Na2MoO4)和磷酸二氢锌[Zn(H2PO4)]2是常用自来水(pH范围6.5~8.8)介质碳钢缓蚀剂。
①钼酸钠(Na2MoO4)在电极表面被还原为MoO2形成保护膜,减缓腐蚀,该电极反应为______ ;同时,MoO42-能与Fe2+反应生成难溶的Fe2O3和MoO2,沉积在碳钢表面减缓腐蚀。写出MoO42-与Fe2+反应的离子反应方程式:_______ 。
②电化学反应可使缓蚀剂成分中的Zn(H2PO4)2转化为难溶性的Zn3(PO4)2,形成保护膜,减缓腐蚀。用平衡移动原理解释发生转化原因________ 。
Ⅰ.金属的腐蚀原理
(1)中性环境中多为吸氧腐蚀,其正极的电极反应为
(2)析氢腐蚀和吸氧腐蚀的均会导致体系中c(OH-)
(3)不同酸性介质中,金属腐蚀原理并不相同。下图是密闭容器中,生铁在pH=2和pH=4的盐酸中压强随时间的变化过程。

图中代表pH=2的曲线是
Ⅱ.金属的电化学防护
(1) 富锌涂料是使用广泛的防锈底漆,涂层中锌对钢铁保护的原理是
(2) 缓蚀剂是能明显减缓或阻止金属腐蚀的物质,钼酸钠(Na2MoO4)和磷酸二氢锌[Zn(H2PO4)]2是常用自来水(pH范围6.5~8.8)介质碳钢缓蚀剂。
①钼酸钠(Na2MoO4)在电极表面被还原为MoO2形成保护膜,减缓腐蚀,该电极反应为
②电化学反应可使缓蚀剂成分中的Zn(H2PO4)2转化为难溶性的Zn3(PO4)2,形成保护膜,减缓腐蚀。用平衡移动原理解释发生转化原因
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】回答下列问题:
(1)三四两月,桃花李花竞相开放,植物长出嫩嫩绿芽,空气清新。花海飘香,使人流连忘返。
①树林中富含抗氧化防衰老的负氧离子。一种负氧离子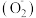 的一个原子团是由一个
的一个原子团是由一个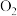 分子俘获了空气中一个自由电子形成的微粒,每个
分子俘获了空气中一个自由电子形成的微粒,每个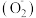 中共含有
中共含有_______ 个电子。
②培育鲜花的某种营养液呈蓝色,可能由 中的一种或几种物质配制而成,其中Ca、N的元素质量比为1:1,则该营养液中含有
中的一种或几种物质配制而成,其中Ca、N的元素质量比为1:1,则该营养液中含有_______ 种溶质。从均衡植物所需营养元素的角度分析,营养液中还需补充_______ (填元素符号)。
(2)分析处理图表中的信息是学习化学的一种重要方法。如表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
①40℃时,氯化钠的溶解度为_______ g
②在20℃时,将100g的水加入30g碳酸钠中,充分搅拌后得到的是_______ (填“饱和溶液”或“不饱和溶液”)
(3)根据所学知识回答下列与金属材料有关的问题。将过量的稀盐酸加入一定量的铁、铜混合物中,反应后溶液中溶质有_______ 种。如图是实验过程生成气体或剩余固体的质量随反应时间的变化关系,其中表示不正确的是_______ (填标号)。
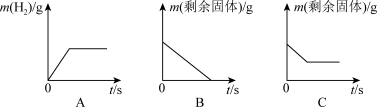
(1)三四两月,桃花李花竞相开放,植物长出嫩嫩绿芽,空气清新。花海飘香,使人流连忘返。
①树林中富含抗氧化防衰老的负氧离子。一种负氧离子
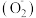 的一个原子团是由一个
的一个原子团是由一个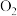 分子俘获了空气中一个自由电子形成的微粒,每个
分子俘获了空气中一个自由电子形成的微粒,每个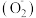 中共含有
中共含有②培育鲜花的某种营养液呈蓝色,可能由
 中的一种或几种物质配制而成,其中Ca、N的元素质量比为1:1,则该营养液中含有
中的一种或几种物质配制而成,其中Ca、N的元素质量比为1:1,则该营养液中含有(2)分析处理图表中的信息是学习化学的一种重要方法。如表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
| 温度/℃ | 10 | 20 | 30 | 40 | |
| 溶解度 | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 |
| 碳酸钠 | 12.2 | 21.8 | 39.7 | 53.2 | |
①40℃时,氯化钠的溶解度为
②在20℃时,将100g的水加入30g碳酸钠中,充分搅拌后得到的是
(3)根据所学知识回答下列与金属材料有关的问题。将过量的稀盐酸加入一定量的铁、铜混合物中,反应后溶液中溶质有

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】I.如图是甲、乙、丙三种固体物质的溶解度曲线,回答下列问题:

(1)A点的含义是_______ 。
(2)在30℃时,向30克甲物质中加入50克水,充分溶解后所得溶液是_______ 溶液(填“饱和”或“不饱和”)。
(3)若乙中混有少量甲,最好采用_______ 的方法提纯乙(填“降温结晶”或“蒸发结晶”)。
(4)将30℃时甲、乙、丙三种物质的饱和溶液降温到10℃,则其溶质质量分数不变的物质是_______ 。
II.如图是甲、乙两种固体的溶解度曲线。

(5)t2℃时,分别用甲、乙的固体配制相同质量甲、乙的饱和溶液,所需要水的质量关系为甲_______ 乙(填“大于”、“小于”或“等于”);t2℃时,将75g甲的饱和溶液与50g水混合后所得溶液中溶质的质量分数为_______ 。

(1)A点的含义是
(2)在30℃时,向30克甲物质中加入50克水,充分溶解后所得溶液是
(3)若乙中混有少量甲,最好采用
(4)将30℃时甲、乙、丙三种物质的饱和溶液降温到10℃,则其溶质质量分数不变的物质是
II.如图是甲、乙两种固体的溶解度曲线。

(5)t2℃时,分别用甲、乙的固体配制相同质量甲、乙的饱和溶液,所需要水的质量关系为甲
您最近一年使用:0次




