取6根铁钉,6支干净的试管及其他材料,如图所示。
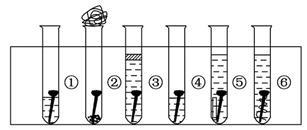
试管①放入一根铁钉,再注入蒸馏水,使铁钉和空气及水接触;
试管②在试管底部放入硅胶(是一种干燥剂),再放入铁钉,用棉花团堵住试管口,使铁钉和干燥空气接触;
试管③先放入一根铁钉,趁热倒入煮沸的蒸馏水(已赶出原先溶解在蒸馏水中的空气)浸没铁钉,再加上一层植物油,使铁钉不能跟空气接触;
试管④中放入铁钉注入食盐水,使铁钉和空气及食盐水接触;Z§X§X§K]
试管⑤放入相连的铁钉和锌片,注入自来水,浸没铁钉和锌片;
试管⑥放入相连的铁钉和铜丝,注入自来水,浸没铁钉和铜丝。
把6支试管放在试管架上,几天后观察铁钉被腐蚀的情况。
(1)上述实验中铁钉发生了电化学腐蚀的是____ (填试管序号);在电化学腐蚀中,负极反应是__________ 。
(2)从铁钉被腐蚀的情况可知引起和促进铁钉被腐蚀的条件是___________ 。
(3)为防止铁的锈蚀,工业上普遍采用的方法是_______ (答两种方法)。

试管①放入一根铁钉,再注入蒸馏水,使铁钉和空气及水接触;
试管②在试管底部放入硅胶(是一种干燥剂),再放入铁钉,用棉花团堵住试管口,使铁钉和干燥空气接触;
试管③先放入一根铁钉,趁热倒入煮沸的蒸馏水(已赶出原先溶解在蒸馏水中的空气)浸没铁钉,再加上一层植物油,使铁钉不能跟空气接触;
试管④中放入铁钉注入食盐水,使铁钉和空气及食盐水接触;Z§X§X§K]
试管⑤放入相连的铁钉和锌片,注入自来水,浸没铁钉和锌片;
试管⑥放入相连的铁钉和铜丝,注入自来水,浸没铁钉和铜丝。
把6支试管放在试管架上,几天后观察铁钉被腐蚀的情况。
(1)上述实验中铁钉发生了电化学腐蚀的是
(2)从铁钉被腐蚀的情况可知引起和促进铁钉被腐蚀的条件是
(3)为防止铁的锈蚀,工业上普遍采用的方法是
更新时间:2016-12-09 10:23:58
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐1】研究金属腐蚀和防腐的原理很有现实意义。
(1)甲图为人教版教材中探究钢铁的吸氧腐蚀的装置。某兴趣小组按该装置实验,导管中液柱的上升缓慢,下列措施可以更快更清晰观察到水柱上升现象的有________ (填序号)。
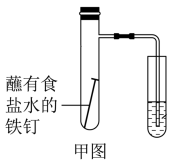
A.用纯氧气代替试管内空气 B.用酒精灯加热试管提高温度
C.将铁钉换成铁粉和炭粉混合粉末 D.换成更细的导管,水中滴加红墨水
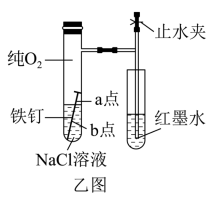
(2)该小组将甲图装置改进成乙图装置并进行实验,导管中红墨水液柱高度随时间的变化如下表,根据数据判断腐蚀的速率随时间逐渐_______________ (填“加快”、“不变”、“减慢”), 你认为影响因素为________________________________________
(3)为探究铁钉腐蚀实验 a、b 两点所发生的反应,进行以下实验,请完成表格空白:
根据以上实验探究,试判断____________ (填“a”或“b”)为负极,该点腐蚀更严重。
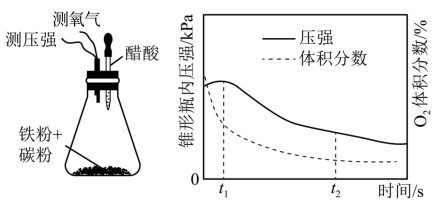
(4)设计下面装置研究弱酸性环境中腐蚀的主要形式。测定锥形瓶内气压和空气中氧气的体积分数随时间变化见下图,从图中可分析,t1~t2之间主要发生__________ 腐蚀(填吸氧或析氢),原因是__________________________________________ 。
(5)金属阳极钝化是一种电化学防腐方法。将 Fe 作阳极置于 H2SO4溶液中,一定条件下Fe 钝化形成致密 Fe3O4氧化膜,试写出该阳极电极反应式________________________ 。
(1)甲图为人教版教材中探究钢铁的吸氧腐蚀的装置。某兴趣小组按该装置实验,导管中液柱的上升缓慢,下列措施可以更快更清晰观察到水柱上升现象的有


A.用纯氧气代替试管内空气 B.用酒精灯加热试管提高温度
C.将铁钉换成铁粉和炭粉混合粉末 D.换成更细的导管,水中滴加红墨水
(2)该小组将甲图装置改进成乙图装置并进行实验,导管中红墨水液柱高度随时间的变化如下表,根据数据判断腐蚀的速率随时间逐渐
| 时间/min | 1 | 3 | 5 | 7 | 9 |
| 液柱高度/cm | 0.8 | 2.1 | 3.0 | 3.7 | 4.2 |
| 实验操作 | 实验现象 | 实验结论 |
| 向 NaCl溶液中滴加 2~3 滴酚酞指示剂 | a 点附近溶液出现红色 | a 点电极反应为① |
| 然后再滴加 2~3 滴② | b 点周围出现蓝色沉淀 | b 点电极反应为③ |
(4)设计下面装置研究弱酸性环境中腐蚀的主要形式。测定锥形瓶内气压和空气中氧气的体积分数随时间变化见下图,从图中可分析,t1~t2之间主要发生

(5)金属阳极钝化是一种电化学防腐方法。将 Fe 作阳极置于 H2SO4溶液中,一定条件下Fe 钝化形成致密 Fe3O4氧化膜,试写出该阳极电极反应式
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g) ΔH = a kJ·mol-1
2Fe(s)+3CO2(g) ΔH = a kJ·mol-1
(1)已知:①Fe2O3(s) + 3C(石墨) = 2Fe(s) + 3CO(g) ΔH1= + 489.0 kJ·mol-1
②C(石墨) + CO2(g) = 2CO(g) ΔH2 = +172.5 kJ·mol-1
则a =_____________ kJ·mol-1。
(2)冶炼铁反应的平衡常数表达式K =__________ ,温度升高后,K值_________ (填“增大”、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在 2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
①甲容器中CO的平衡转化率为________________________ 。
②下列说法正确的是__________________ (填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.增加Fe2O3可以提高CO的转化率
c.甲、乙容器中,CO的平衡浓度之比为2∶3
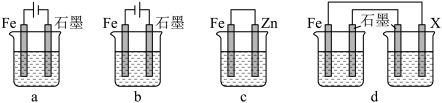
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在abc装置中能保护铁的是___________________ (填字母)
②若用d装置保护铁,X极的电极材料应是____________________ (填名称)
 2Fe(s)+3CO2(g) ΔH = a kJ·mol-1
2Fe(s)+3CO2(g) ΔH = a kJ·mol-1(1)已知:①Fe2O3(s) + 3C(石墨) = 2Fe(s) + 3CO(g) ΔH1= + 489.0 kJ·mol-1
②C(石墨) + CO2(g) = 2CO(g) ΔH2 = +172.5 kJ·mol-1
则a =
(2)冶炼铁反应的平衡常数表达式K =
(3)在T℃时,该反应的平衡常数K=64,在 2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
①甲容器中CO的平衡转化率为
②下列说法正确的是
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.增加Fe2O3可以提高CO的转化率
c.甲、乙容器中,CO的平衡浓度之比为2∶3
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在abc装置中能保护铁的是
②若用d装置保护铁,X极的电极材料应是

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】电化学的发展对人类文明的进步起到了推动作用。
(Ⅰ)用如图装置研究化学能转化为电能的过程。

(1)连接前,该装置中主要的能量转化形式为:______ 能→______ 能。连接后,Cu表面电极反应式为_______ 。
(2)连接前后,装置中现象的差异有______ 。(任写两条)
(Ⅱ)用如图装置实现“Zn表面镀Cu”。
(3)需要将溶液改为______ (填写溶质化学式),此时,Cu发生的电极反应式为______ 。
(4)该装置连续工作ts后,测得Zn增重mg,这段时间内平均电流强度为ⅠA,则阿伏加德罗常数的数值可以表示为______ 。(已知:一个电子的电量为qC,电量(Q)与电流强度(Ⅰ)的关系为:Q=I•t)
(Ⅲ)研究金属的腐蚀过程及防腐蚀对人们的日常生活有重大意义。
(5)如图1中的铁棒为纯铁,则其腐蚀过程属于_______ 腐蚀。
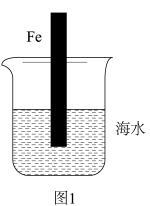
(6)如图1中的铁棒(含碳量为10.8%)越靠近烧杯底部发生电化学腐蚀就越______ (选填“轻微”、“严重”)。该实验说明_______ 因素会影响铁的腐蚀速率。腐蚀时正极的电极反应式为______ 。(已知:海水pH约为8.1)
(7)用图2研究铁的腐蚀过程。预测恒温条件下反应一段时间后,U形管内液面的变化情况。

(已知:起始时两管内液面相平,实验过程中铁丝始终不接触溶液,选填“左高右低”、“左低右高”或“几乎不变”)
该组实验目的:研究______ 、______ 等因素对铁的腐蚀过程产生影响。
(8)用图3所示装置研究铁的防腐蚀过程:

①K1、K2、K3只关闭一个,则铁腐蚀的速度最快的是只闭合______ (填“K1”、“K2”或“K3”下同)。
②为减缓铁的腐蚀,应只闭合______ ,该防护法称为______ 。
③只闭合K3,石墨电极附近的pH将______ (填“变大”、“变小”或“不变”)。
(9)图4为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。
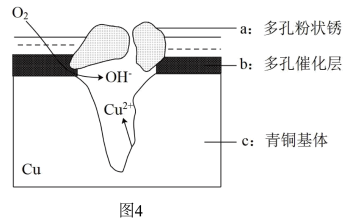
①腐蚀过程中,负极是______ (填“a”、“b”或“c”)。
②环境中的 扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl。青铜器发生电化腐蚀并最终生成Cu2(OH)3Cl的总离子方程式为
扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl。青铜器发生电化腐蚀并最终生成Cu2(OH)3Cl的总离子方程式为______ 。
(Ⅰ)用如图装置研究化学能转化为电能的过程。

(1)连接前,该装置中主要的能量转化形式为:
(2)连接前后,装置中现象的差异有
(Ⅱ)用如图装置实现“Zn表面镀Cu”。
(3)需要将溶液改为
(4)该装置连续工作ts后,测得Zn增重mg,这段时间内平均电流强度为ⅠA,则阿伏加德罗常数的数值可以表示为
(Ⅲ)研究金属的腐蚀过程及防腐蚀对人们的日常生活有重大意义。
(5)如图1中的铁棒为纯铁,则其腐蚀过程属于

(6)如图1中的铁棒(含碳量为10.8%)越靠近烧杯底部发生电化学腐蚀就越
(7)用图2研究铁的腐蚀过程。预测恒温条件下反应一段时间后,U形管内液面的变化情况。

(已知:起始时两管内液面相平,实验过程中铁丝始终不接触溶液,选填“左高右低”、“左低右高”或“几乎不变”)
| 溶液X | 浓硫酸 | 浓盐酸 | 稀硫酸 |
| 液面情况 |
(8)用图3所示装置研究铁的防腐蚀过程:

①K1、K2、K3只关闭一个,则铁腐蚀的速度最快的是只闭合
②为减缓铁的腐蚀,应只闭合
③只闭合K3,石墨电极附近的pH将
(9)图4为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。

①腐蚀过程中,负极是
②环境中的
 扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl。青铜器发生电化腐蚀并最终生成Cu2(OH)3Cl的总离子方程式为
扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl。青铜器发生电化腐蚀并最终生成Cu2(OH)3Cl的总离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】实验小组同学为探究Fe2+性质,进行如下实验。
【实验Ⅰ】向2mL 溶液滴中几滴
溶液滴中几滴 KSCN溶液,无明显现象,再滴加几滴3%
KSCN溶液,无明显现象,再滴加几滴3% 溶液(用
溶液(用 酸化至
酸化至 ),溶液颜色变红。
),溶液颜色变红。
(1)甲同学通过上述实验分析 具有
具有_______ (填“氧化”或“还原”)性。
乙同学查阅资料发现 与
与 可发生反应,生成无色的配合物。为证实该性质,利用进行如下实验。
可发生反应,生成无色的配合物。为证实该性质,利用进行如下实验。
(2) 的制备:用过量
的制备:用过量 溶液与
溶液与 溶液反应得到
溶液反应得到 ,离子方程式为
,离子方程式为_______ 。
【实验Ⅱ】验证 与
与 发生反应
发生反应_______ 。
(4)从沉淀溶解平衡角度解释实验a和b最终溶液颜色不同的原因是_______ 。
丙同学设计实验进一步证明 可与
可与 反应。
反应。
【实验Ⅲ】
①X为_______ 。
②实验能够证实 可与
可与 反应,则应观察到的现象是
反应,则应观察到的现象是_______ 。
(6)实验Ⅲ中若未加适量水稀释,则无法通过现象得出结论。推测加水稀释的目的可能有:使后续实验颜色变化易于观察;降低 ,
,_______ 。
【实验Ⅰ】向2mL
 溶液滴中几滴
溶液滴中几滴 KSCN溶液,无明显现象,再滴加几滴3%
KSCN溶液,无明显现象,再滴加几滴3% 溶液(用
溶液(用 酸化至
酸化至 ),溶液颜色变红。
),溶液颜色变红。(1)甲同学通过上述实验分析
 具有
具有乙同学查阅资料发现
 与
与 可发生反应,生成无色的配合物。为证实该性质,利用进行如下实验。
可发生反应,生成无色的配合物。为证实该性质,利用进行如下实验。(2)
 的制备:用过量
的制备:用过量 溶液与
溶液与 溶液反应得到
溶液反应得到 ,离子方程式为
,离子方程式为【实验Ⅱ】验证
 与
与 发生反应
发生反应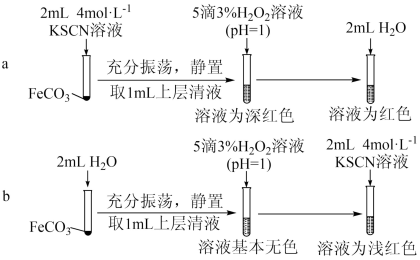
(4)从沉淀溶解平衡角度解释实验a和b最终溶液颜色不同的原因是
丙同学设计实验进一步证明
 可与
可与 反应。
反应。【实验Ⅲ】
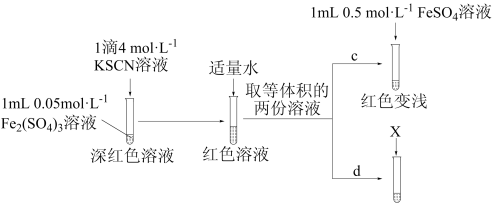
①X为
②实验能够证实
 可与
可与 反应,则应观察到的现象是
反应,则应观察到的现象是(6)实验Ⅲ中若未加适量水稀释,则无法通过现象得出结论。推测加水稀释的目的可能有:使后续实验颜色变化易于观察;降低
 ,
,
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】氨气和氨水在工农业生产中均有重要应用。
(1)工业合成氨反应的化学方程式是___________ 。
(2)实验室常加热熟石灰[主要成分是Ca(OH)2]和氯化铵混合固体制取氨气,写出反应的化学方程式___________ 。
(3)如下图所示,向表面皿中的NaOH固体滴几滴浓氨水,迅速盖上盖,观察现象。
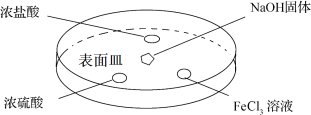
①___________ 液滴上方会出现白烟(填序号)
A.浓盐酸 B.浓硫酸 C.FeCl3溶液
②一段时间后浓硫酸的液滴中有白色固体,生成该白色固体的化学方程是___________ 。
③FeCl3液滴中出现的现象是___________ ,发生反应的离子方程式 是___________ 。
(4)浓氨水可以用来检验有毒气体(如:氯气)的泄漏,反应式为3Cl2+8NH3=N2+6NH4Cl,在该反应中,氧化剂是___________ (填化学式),检测时观察到的现象是___________ ,当有1mol氮气生成时,转移的电子数是___________ mol。
(1)工业合成氨反应的化学方程式是
(2)实验室常加热熟石灰[主要成分是Ca(OH)2]和氯化铵混合固体制取氨气,写出反应的化学方程式
(3)如下图所示,向表面皿中的NaOH固体滴几滴浓氨水,迅速盖上盖,观察现象。

①
A.浓盐酸 B.浓硫酸 C.FeCl3溶液
②一段时间后浓硫酸的液滴中有白色固体,生成该白色固体的化学方程是
③FeCl3液滴中出现的现象是
(4)浓氨水可以用来检验有毒气体(如:氯气)的泄漏,反应式为3Cl2+8NH3=N2+6NH4Cl,在该反应中,氧化剂是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】 (与
(与 的氧化性相近)常温下为气体,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放进行了研究。
的氧化性相近)常温下为气体,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放进行了研究。
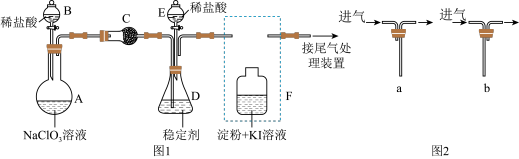
(1)安装F中导管时,应选用图2中的_______ (填“a”或“b”)。
(2)打开B的活塞,A中氯酸钠和稀盐酸混合产生 和
和 且体积之比为1∶2(相同条件下),写出反应的离子方程式:
且体积之比为1∶2(相同条件下),写出反应的离子方程式:_______ 。
(3)已知D中稳定剂仅能吸收 。当关闭B的活塞,
。当关闭B的活塞, 在D中被稳定剂完全吸收生成
在D中被稳定剂完全吸收生成 ,此时F中溶液的颜色不变,则装置C的作用是
,此时F中溶液的颜色不变,则装置C的作用是_______ ,若C中物质为 ,则反应化学方程式为
,则反应化学方程式为_______ 。
(4)已知 在酸性条件下会反应生成
在酸性条件下会反应生成 并释放出
并释放出 。在释放
。在释放 的实验中,打开活塞E,装置D中即可发生反应,则装置F的作用是
的实验中,打开活塞E,装置D中即可发生反应,则装置F的作用是_______ 。
 (与
(与 的氧化性相近)常温下为气体,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放进行了研究。
的氧化性相近)常温下为气体,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放进行了研究。
(1)安装F中导管时,应选用图2中的
(2)打开B的活塞,A中氯酸钠和稀盐酸混合产生
 和
和 且体积之比为1∶2(相同条件下),写出反应的离子方程式:
且体积之比为1∶2(相同条件下),写出反应的离子方程式:(3)已知D中稳定剂仅能吸收
 。当关闭B的活塞,
。当关闭B的活塞, 在D中被稳定剂完全吸收生成
在D中被稳定剂完全吸收生成 ,此时F中溶液的颜色不变,则装置C的作用是
,此时F中溶液的颜色不变,则装置C的作用是 ,则反应化学方程式为
,则反应化学方程式为(4)已知
 在酸性条件下会反应生成
在酸性条件下会反应生成 并释放出
并释放出 。在释放
。在释放 的实验中,打开活塞E,装置D中即可发生反应,则装置F的作用是
的实验中,打开活塞E,装置D中即可发生反应,则装置F的作用是
您最近一年使用:0次



