氮的重要化合物,如氨(NH3)、肼(N2H4)、三氟化氮(NF3)等在生产、生活中具有重要作用。
(1)利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
N2(g)+O2(g)=2NO(g) ΔH1=+229.3 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH2="-906.5" kJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(g) ΔH3
则ΔH3 =__________ kJ·mol-1
(2)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程产生的气体无毒,写出该反应的离子方程式___________________
(3)在微电子工业中,NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如图所示。

① 氮化硅的化学式为________________
② a电极为电解池的___________ (填“阴”或“阳”)极,写出该电极的电极反应式___________________
(1)利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
N2(g)+O2(g)=2NO(g) ΔH1=+229.3 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH2="-906.5" kJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(g) ΔH3
则ΔH3 =
(2)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程产生的气体无毒,写出该反应的离子方程式
(3)在微电子工业中,NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如图所示。

① 氮化硅的化学式为
② a电极为电解池的
更新时间:2016-12-09 09:18:28
|
相似题推荐
填空题
|
较难
(0.4)
名校
【推荐1】Ⅰ.已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出13种元素的X的数值:
试结合元素周期律知识完成下列问题:
(1)请预测K与Rb元素的X数值的大小关系:K______ Rb (填“>”、“=”或“<”)。
(2)经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键,试推断AlBr3中的化学键类型是____ 。
(3)某有机化合物分子中含有S-N键,你认为该共用电子对偏向于____ 原子(填元素符号).
(4)简述第二周期元素(除稀有气体外)的X的数值大小与原子半径之间的关系:________ 。
Ⅱ.(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
①第一步反应是____ 反应(选填“放热”或“吸热”),判断依据_____ 。
②1 molNH4+(aq)全部氧化成NO3- (aq)的热化学方程式_______ 。
(2)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:
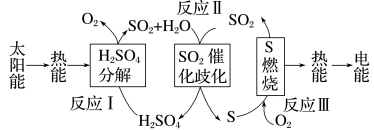
反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ/mol
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=−297 kJ/mol
反应Ⅱ的热化学方程式:_______________ 。
(3)一定条件下,不同量的CO2与不同量的NaOH充分反应放出的热量如下表所示:
写出该条件下,CO2与NaOH反应生成NaHCO3的热化学方__________________ 。
| 元素 | Al | B | Be | C | Cl | F | Li |
| X的数值 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | |
| X的数值 | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
(1)请预测K与Rb元素的X数值的大小关系:K
(2)经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键,试推断AlBr3中的化学键类型是
(3)某有机化合物分子中含有S-N键,你认为该共用电子对偏向于
(4)简述第二周期元素(除稀有气体外)的X的数值大小与原子半径之间的关系:
Ⅱ.(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
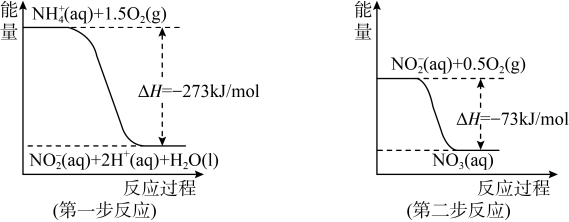
①第一步反应是
②1 molNH4+(aq)全部氧化成NO3- (aq)的热化学方程式
(2)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:

反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ/mol
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=−297 kJ/mol
反应Ⅱ的热化学方程式:
(3)一定条件下,不同量的CO2与不同量的NaOH充分反应放出的热量如下表所示:
| CO2的量 | NaOH的量 | 放出的热量 |
| 22.0 g | 750 mL 1.0 mol/L | x kJ |
| 1.0 mol | 2.0 L 1.0 mol/L | y kJ |
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】研究硫元素及其化合物的性质具有重要意义。
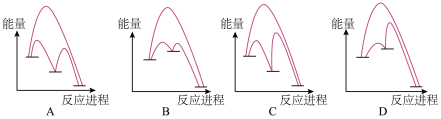
Ⅰ.已知I-可以催化二氧化硫与水溶液中发生的歧化反应:
3SO2(g)+2H2O(l) =2H2SO4(aq)+ S(s) △H<0,催化原理分为两步,
第一步反应为吸热的慢反应:SO2 + 4I-+ 4H+ = 2H2O + S↓+ 2I2
第二步反应为放热的快反应:2H2O + I2 +________ = ________ +________ + 2I-
(1)请补充第二步反应
(2)能正确表示I-催化SO2歧化反应原理的能量变化示意图为_______________
Ⅱ. 工业制硫酸,在接触室发生反应2SO2(g) +O2(g) 2SO3(g) 在1L的恒容密闭容器中充入2mol SO2和1mol O2,在不同温度下测得c(SO3)与时间的关系如图A:
2SO3(g) 在1L的恒容密闭容器中充入2mol SO2和1mol O2,在不同温度下测得c(SO3)与时间的关系如图A:

(3)能证明反应已经达到平衡状态的是________________
①c(SO2):c(O2):c(SO3)=2:1:2
②单位时间内生成nmol SO3的同时消耗nmol SO2
③反应速率2V(SO3)正= V(O2)逆
④温度和体积一定时,容器内压强不再变化
⑤温度和压强一定时,混合气体的密度不再变化
(4)反应的△H____________ 0(填“>”“<”或“=”)
(5)反应开始到10min时SO2的平均反应速率V(SO2) =_____________ mol/(L.min).
T2时该反应的平衡常数K=________________
(6)一定条件下在恒温恒容的密闭容器中按一定比例充入SO2 (g)和O2 (g),平衡时SO3的体积分数随n(SO2)/n(O2) 的变化图象如图B,则A、B、C 三状态中,SO2的转化率最小的是______________ 点,当n(SO2)/n(O2) =3 时,达到平衡状态SO3的体积分数可能是D、E、F三点中的_____ 点
Ⅰ.已知I-可以催化二氧化硫与水溶液中发生的歧化反应:
3SO2(g)+2H2O(l) =2H2SO4(aq)+ S(s) △H<0,催化原理分为两步,
第一步反应为吸热的慢反应:SO2 + 4I-+ 4H+ = 2H2O + S↓+ 2I2
第二步反应为放热的快反应:2H2O + I2 +
(1)请补充第二步反应
(2)能正确表示I-催化SO2歧化反应原理的能量变化示意图为

Ⅱ. 工业制硫酸,在接触室发生反应2SO2(g) +O2(g)
 2SO3(g) 在1L的恒容密闭容器中充入2mol SO2和1mol O2,在不同温度下测得c(SO3)与时间的关系如图A:
2SO3(g) 在1L的恒容密闭容器中充入2mol SO2和1mol O2,在不同温度下测得c(SO3)与时间的关系如图A:
(3)能证明反应已经达到平衡状态的是
①c(SO2):c(O2):c(SO3)=2:1:2
②单位时间内生成nmol SO3的同时消耗nmol SO2
③反应速率2V(SO3)正= V(O2)逆
④温度和体积一定时,容器内压强不再变化
⑤温度和压强一定时,混合气体的密度不再变化
(4)反应的△H
(5)反应开始到10min时SO2的平均反应速率V(SO2) =
T2时该反应的平衡常数K=
(6)一定条件下在恒温恒容的密闭容器中按一定比例充入SO2 (g)和O2 (g),平衡时SO3的体积分数随n(SO2)/n(O2) 的变化图象如图B,则A、B、C 三状态中,SO2的转化率最小的是
您最近一年使用:0次
填空题
|
较难
(0.4)
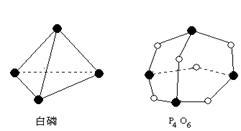
【推荐3】I.已知:P4(白磷)+3O2(g)= P4O6(g)的反应热△H=-1638 kJ·mol-1,白磷和P4O6的分子结构如图所示,化学键的键能(kJ·mol-1):P—P:198 P—O:360,则断开1molO2所需要的能量为______ kJ
II.已知:①CO(g)+1/2O2(g)=CO2(g) △H=-141kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1
③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) △H=-883kJ·mol-1
(1)利用CO、H2化合制得1mol气态甲醇的热化学方程式为____________ ;
(2)若在恒温2L密闭容器中,将1molCO与3mol H2充分反应,当吸收能量为129KJ时,此时H2的转化率为_____________ ,平衡常数为___________ 。

II.已知:①CO(g)+1/2O2(g)=CO2(g) △H=-141kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1
③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) △H=-883kJ·mol-1
(1)利用CO、H2化合制得1mol气态甲醇的热化学方程式为
(2)若在恒温2L密闭容器中,将1molCO与3mol H2充分反应,当吸收能量为129KJ时,此时H2的转化率为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】用石墨电极电解500 mL含一种溶质的某蓝色溶液,如右图所示,观察到A极表面有红色固体物质生成,B极上有无色气体生成;当溶液中的原有溶质完全电解后,取出A极,洗涤、干燥、称量,电极增重1.6 g,回答下列问题:
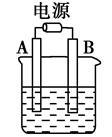
(1)B电极发生反应的电极反应式_______________________ 。
(2)写出电解时反应的离子方程式______________________________ 。
(3)电解后溶液中H+物质的量浓度为________________ ,要使电解后溶液恢复到电解前的状态,则需加入____________ ,其质量为________________ 。(假设电解前后溶液的体积不变)
(4)原溶液可能是________________ 溶液。

(1)B电极发生反应的电极反应式
(2)写出电解时反应的离子方程式
(3)电解后溶液中H+物质的量浓度为
(4)原溶液可能是
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】如图所示装置,C、D、E、F、M、N都是惰性电极;甲、乙、丁溶液的体积均为100mL,甲中AgNO3浓度为5mol/L,乙中NaCl浓度为3mol/L。接通电源后,向乙中滴入酚酞,在F极附近显红色。
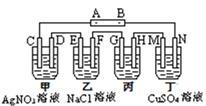
(1)电源A极的名称是________ 。
(2)若用丙装置电解精练铜,则H极为___________ (填“粗铜”或“纯铜”)。
(3)甲装置中电解总反应的化学方程式为_______________________________ 。
(4)电解结束后,向丁中加入0.1mol Cu(OH)2,恰好恢复到反应前的浓度,则:
①丁中硫酸铜的物质的量浓度为_____________ mol/L;
②将甲中溶液加水稀释至400mL,溶液的pH为___________ ;
③相同条件下,乙中E、F电极上产生气体的体积比为_____________ 。

(1)电源A极的名称是
(2)若用丙装置电解精练铜,则H极为
(3)甲装置中电解总反应的化学方程式为
(4)电解结束后,向丁中加入0.1mol Cu(OH)2,恰好恢复到反应前的浓度,则:
①丁中硫酸铜的物质的量浓度为
②将甲中溶液加水稀释至400mL,溶液的pH为
③相同条件下,乙中E、F电极上产生气体的体积比为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】天然矿物芒硝化学式为Na2SO4·10H2O,为无色晶体,易溶于水。该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念。

(1)该电解槽的阴极电极反应式为_____________ 。此时通过阴离子交换膜的离子数__________ (填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
(2)所得到的浓氢氧化钠溶液从出口(填“A”、“B”、“C”或“D”)____________ 导出。
(3)若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,则该电池负极的电极反应式为_________ 。

(1)该电解槽的阴极电极反应式为
(2)所得到的浓氢氧化钠溶液从出口(填“A”、“B”、“C”或“D”)
(3)若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,则该电池负极的电极反应式为
您最近一年使用:0次



