盐酸的质量分数为36.5%,密度为1.20g/mL,则此盐酸的物质的量浓度为______ mol/L。
更新时间:2016-12-09 09:21:35
|
【知识点】 化学计量
相似题推荐
填空题
|
适中
(0.65)
【推荐1】回答下列问题:
(1)下列四个因素:①气体分子的直径、②气体的物质的量多少、③气体分子间的平均距离、④气体分子的相对分子质量,决定气体体积的主要因素为___________ (填序号)。
(2)某气体氧化物的化学式为R2O,4.4g该氧化物含有0.3mol的原子,则在标准状况下该气体的体积为___________ L,R的相对原子质量为___________ 。
(3)用NA表示阿伏加德罗常数的值。标准状况下,3.36LNH3的质量为___________ ,其中含有氢原子的个数是___________ ,含有电子的物质的量是___________ 。
(4)在三个容积相同的密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(P)从大到小的顺序为___________ 。
(5)6.72LCO(标准状况)与一定量的Fe2O3恰好完全反应(生成Fe与CO2)后,生成Fe的质量为___________ g
(1)下列四个因素:①气体分子的直径、②气体的物质的量多少、③气体分子间的平均距离、④气体分子的相对分子质量,决定气体体积的主要因素为
(2)某气体氧化物的化学式为R2O,4.4g该氧化物含有0.3mol的原子,则在标准状况下该气体的体积为
(3)用NA表示阿伏加德罗常数的值。标准状况下,3.36LNH3的质量为
(4)在三个容积相同的密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(P)从大到小的顺序为
(5)6.72LCO(标准状况)与一定量的Fe2O3恰好完全反应(生成Fe与CO2)后,生成Fe的质量为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】根据题意填空:
(1)写出下列物质的电离方程式:
①NaHCO3:________ ;
②Cu(OH)2:________ ;
(2)计算:
①标准状况下,某气体的密度为1.5g•L-1,则该气体的摩尔质量为________ (保留整数)
②10.8gR2O5中氧原子的数目为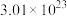 ,则元素R的相对原子质量为
,则元素R的相对原子质量为________ 。
③阻燃剂碱式碳酸铝镁中OH-与 质量之比为51:300,则这两种离子的物质的量之比为
质量之比为51:300,则这两种离子的物质的量之比为_______ 。
④将 溶液与
溶液与 l溶液相混和,则混和溶液中
l溶液相混和,则混和溶液中 的物质的量浓度为
的物质的量浓度为___________ 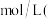 忽略混合前后溶液体积的变化,结果保留三位有效数字)。
忽略混合前后溶液体积的变化,结果保留三位有效数字)。
⑤标准状况下,将VLHCl溶解在1L水中(水的密度近似为1g/cm3),所得溶液的密度为ρg/cm3,物质的量浓度为cmol/L,则c=________ 。(用含V、ρ的式子表示)
(1)写出下列物质的电离方程式:
①NaHCO3:
②Cu(OH)2:
(2)计算:
①标准状况下,某气体的密度为1.5g•L-1,则该气体的摩尔质量为
②10.8gR2O5中氧原子的数目为
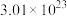 ,则元素R的相对原子质量为
,则元素R的相对原子质量为③阻燃剂碱式碳酸铝镁中OH-与
 质量之比为51:300,则这两种离子的物质的量之比为
质量之比为51:300,则这两种离子的物质的量之比为④将
 溶液与
溶液与 l溶液相混和,则混和溶液中
l溶液相混和,则混和溶液中 的物质的量浓度为
的物质的量浓度为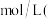 忽略混合前后溶液体积的变化,结果保留三位有效数字)。
忽略混合前后溶液体积的变化,结果保留三位有效数字)。⑤标准状况下,将VLHCl溶解在1L水中(水的密度近似为1g/cm3),所得溶液的密度为ρg/cm3,物质的量浓度为cmol/L,则c=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】硫代硫酸钠( )俗称大苏打、海波,其中硫的价态为+2价,是一种重要的无机化工原料。
)俗称大苏打、海波,其中硫的价态为+2价,是一种重要的无机化工原料。
Ⅰ.大苏打溶液置于空气中容易发生下列反应而出现黄色浑浊
①
②
(1)从硫的价态的角度分析,硫代硫酸钠_______(填序号)
(2)反应①中的氧化剂是_______ ,还原剂是_______ 。
(3)配制好的大苏打溶液会加入少量 ,吸收
,吸收 生成
生成 来防止发生反应①,涉及的化学方程式为
来防止发生反应①,涉及的化学方程式为_______ 。
(4)为了避免发生反应②,往往还会向配制好的大苏打溶液中加入少量 ,请你猜测加入
,请你猜测加入 的作用是什么?
的作用是什么?_______ 。
Ⅱ.生活中,自来水厂常常利用氟气对水体进行消毒,因而自来水中常有氯气残余。
(5)氯气与水的反应方程式为_______ ,氯气溶于水后,能实际起到漂白杀菌效果的成分是_______ (填名称)。
(6)可以使用大苏打来处理水中残余的氯气。涉及的化学方程式为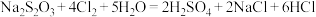
请在方程式中标出反应物电子转移的方向和数目_______ 。
(7)上述 和
和 的反应中,被还原的元素是
的反应中,被还原的元素是_______ ,氧化剂与还原剂的物质的量之比是_______ ,每转移10mol电子,可吸收标况下氯气_______ L。
(8)自来水中的残余的氯气也可以通过太阳暴晒一段时间来除去,请结合化学方程式解释其原理。_______ 。
(9)请分别对上述两种除去水中残余氯气的方法进行评价。_______ 。
Ⅲ.某实验探究小组需要用到0.1000mo/L的 溶液240mL,依据如下步骤配制溶液:
溶液240mL,依据如下步骤配制溶液:
(10)①在电子天平上准确称量_______ g 固体
固体
②将固体转移入_______ 中,加入新煮沸的蒸馏水进行溶解
③待溶液恢复至室温后,将溶液沿玻璃棒注入_______ 中
④加入新煮沸的蒸馏水至液面距离刻度线下1~2cm处,改用胶头滴管加水至凹液面底部与刻度线相切
⑤摇匀
(11)为什么在配制溶液的过程中要使用新煮沸的蒸馏水?_______ 。
(12)该探究小组严格按照上述实验步骤配制溶液,没有操作失误,却还是发现所配溶液浓度偏小,你认为是什么原因造成的?(该小组已排除了在配制的过程中 的变质对实验的影响)
的变质对实验的影响)_______ 。
 )俗称大苏打、海波,其中硫的价态为+2价,是一种重要的无机化工原料。
)俗称大苏打、海波,其中硫的价态为+2价,是一种重要的无机化工原料。Ⅰ.大苏打溶液置于空气中容易发生下列反应而出现黄色浑浊
①

②

(1)从硫的价态的角度分析,硫代硫酸钠_______(填序号)
| A.只有还原性 | B.只有氧化性 |
| C.既有氧化性也有还原性 | D.既没有氧化性也没有还原性 |
(3)配制好的大苏打溶液会加入少量
 ,吸收
,吸收 生成
生成 来防止发生反应①,涉及的化学方程式为
来防止发生反应①,涉及的化学方程式为(4)为了避免发生反应②,往往还会向配制好的大苏打溶液中加入少量
 ,请你猜测加入
,请你猜测加入 的作用是什么?
的作用是什么?Ⅱ.生活中,自来水厂常常利用氟气对水体进行消毒,因而自来水中常有氯气残余。
(5)氯气与水的反应方程式为
(6)可以使用大苏打来处理水中残余的氯气。涉及的化学方程式为
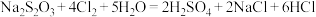
请在方程式中标出反应物电子转移的方向和数目
(7)上述
 和
和 的反应中,被还原的元素是
的反应中,被还原的元素是(8)自来水中的残余的氯气也可以通过太阳暴晒一段时间来除去,请结合化学方程式解释其原理。
(9)请分别对上述两种除去水中残余氯气的方法进行评价。
Ⅲ.某实验探究小组需要用到0.1000mo/L的
 溶液240mL,依据如下步骤配制溶液:
溶液240mL,依据如下步骤配制溶液:(10)①在电子天平上准确称量
 固体
固体②将固体转移入
③待溶液恢复至室温后,将溶液沿玻璃棒注入
④加入新煮沸的蒸馏水至液面距离刻度线下1~2cm处,改用胶头滴管加水至凹液面底部与刻度线相切
⑤摇匀
(11)为什么在配制溶液的过程中要使用新煮沸的蒸馏水?
(12)该探究小组严格按照上述实验步骤配制溶液,没有操作失误,却还是发现所配溶液浓度偏小,你认为是什么原因造成的?(该小组已排除了在配制的过程中
 的变质对实验的影响)
的变质对实验的影响)
您最近一年使用:0次



