某学习小组设计以下四个实验探究新制氯水的成分,请根据表格回答问题。(已知Cl2+2I- 2Cl-+I2)
2Cl-+I2)
(1)实验①得出的结论是__________________________ 。
(2)指出实验②和实验④中的“实验现象”:
②__________________________ ,④__________________________ 。
(3)实验③中“实验方法”的具体操作过程是__________________________ 。
(4)通过实验②的“实验现象”,同学们得出两个不同的结论。这两个结论可能是:
a.氯水中含有HClO,其漂白作用能使溶液褪色;
b._______________________ 。
请设计简单的实验证明上述a、b结论:_______________ 。
 2Cl-+I2)
2Cl-+I2)| 实验序号 | 实验方法 | 实验现象 | 结论 |
| ① | 将氯水滴加到AgNO3溶液中 | 生成白色沉淀 | |
| ② | 将氯水滴加到含有酚酞的NaOH溶液中 | ||
| ③ | 淀粉KI试纸变蓝色 | 氯水中含有Cl2 | |
| ④ | 将足量的氯水滴加到Na2CO3溶液中 | 氯水中含有H+ |
(2)指出实验②和实验④中的“实验现象”:
②
(3)实验③中“实验方法”的具体操作过程是
(4)通过实验②的“实验现象”,同学们得出两个不同的结论。这两个结论可能是:
a.氯水中含有HClO,其漂白作用能使溶液褪色;
b.
请设计简单的实验证明上述a、b结论:
2019高三·全国·专题练习 查看更多[3]
(已下线)【走进新高考】(人教版必修一)4.2.2富集在海水中的元素——氯 (氯离子检验和氯气制法)同步练习022.2.1 氯气的性质练习(1)《高中新教材同步备课》(人教版 必修第一册)广东省湛江市第二十一中学2023-2024学年高一上学期期中考试化学试题
更新时间:2019-02-16 17:41:20
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】某化学兴趣小组利用饱和氯水与石灰石的反应,制取较浓的HClO溶液,并对所得溶液中的部分阴离子进行检验。
⑴步骤1中发生反应的离子方程式是_______________ ,过滤的目的是___________ 。
⑵步骤2、步骤3的实验目的都是___________________ ,为达到该实验目的,还可以采取的方法是______________ 。
⑶步骤3中反应的离子方程式是:_______________________ 。
(4)请你设计一个简单的实验方案,证明步骤1所得滤液中的HClO浓度比饱和氯水中HClO浓度大:_________________________ 。
实验操作 | 实验现象 | |
步骤1 | 在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,过滤,将滤液分为若干份 | 有少量气泡产生,溶液的黄绿色褪去 |
步骤2 | 将第一份滤液与稀盐酸混合 | 产生大量气泡 |
步骤3 | 将第二份滤液加热 | 溶液变浑浊,且有大量无色气体产生 |
⑴步骤1中发生反应的离子方程式是
⑵步骤2、步骤3的实验目的都是
⑶步骤3中反应的离子方程式是:
(4)请你设计一个简单的实验方案,证明步骤1所得滤液中的HClO浓度比饱和氯水中HClO浓度大:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】为了探究氯水中所含微粒及其性质,兴趣小组进行如下探究实验。
注:试管中溶液均为1 ,均滴入氯水5滴:淀粉遇碘(
,均滴入氯水5滴:淀粉遇碘( )变蓝色。
)变蓝色。
(1)能证明氯水中含有 的是实验
的是实验__________ (填序号),写出该实验中反应的离子方程式:__________ 。
(2)结合离子方程式解释实验②的现象产生的原因:__________ 。
(3)实验③中使溶液变红的微粒是__________ ,使溶液褪色的微粒是__________ 。
(4)实验⑤中产生的气体经验证确认是 ,据此学习小组提出两种猜想:
,据此学习小组提出两种猜想:
猜想1: 在氯水的催化下分解产生
在氯水的催化下分解产生 和
和 ;
;
猜想2:氯水中的 氧化
氧化 产生
产生 :
:
为了验证上述猜想,请补充完整下述实验方案:取两支试管,分别加入适量等体积10% 溶液,
溶液,_________ 。(填操作步骤、预测的现象及对应的结论)
(5)资料表明,久置的氯水会由黄绿色变为无色,同时失去漂白性。为探究氯水失效的原因,兴趣小组进行实验:用强光照射盛有氯水的密闭广口瓶,并用传感器测定氯水中 浓度和液面上方气体中氧气的体积分数,得到下图所示曲线。
浓度和液面上方气体中氧气的体积分数,得到下图所示曲线。
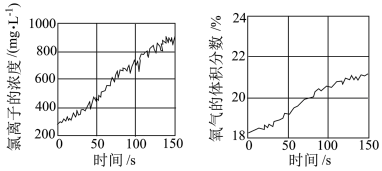
①随着时间延长, 浓度和氧气的体积分数不断增大的原因是
浓度和氧气的体积分数不断增大的原因是__________ 。
②若在整个实验过程中同时测定溶液的 ,则
,则 的变化趋势是
的变化趋势是__________ 。
编号 | 实验① | 实验② | 实验③ | 实验④ | 实验⑤ |
操作 |
|
|
|
|
|
现象 | 蒸馏水由无色逐渐变浅黄绿色 | 溶液变蓝 | 石蕊溶液先变红后褪色 | 产生白色沉淀 | 产生大量无色气泡 |
 ,均滴入氯水5滴:淀粉遇碘(
,均滴入氯水5滴:淀粉遇碘( )变蓝色。
)变蓝色。(1)能证明氯水中含有
 的是实验
的是实验(2)结合离子方程式解释实验②的现象产生的原因:
(3)实验③中使溶液变红的微粒是
(4)实验⑤中产生的气体经验证确认是
 ,据此学习小组提出两种猜想:
,据此学习小组提出两种猜想:猜想1:
 在氯水的催化下分解产生
在氯水的催化下分解产生 和
和 ;
;猜想2:氯水中的
 氧化
氧化 产生
产生 :
:
为了验证上述猜想,请补充完整下述实验方案:取两支试管,分别加入适量等体积10%
 溶液,
溶液,(5)资料表明,久置的氯水会由黄绿色变为无色,同时失去漂白性。为探究氯水失效的原因,兴趣小组进行实验:用强光照射盛有氯水的密闭广口瓶,并用传感器测定氯水中
 浓度和液面上方气体中氧气的体积分数,得到下图所示曲线。
浓度和液面上方气体中氧气的体积分数,得到下图所示曲线。
①随着时间延长,
 浓度和氧气的体积分数不断增大的原因是
浓度和氧气的体积分数不断增大的原因是②若在整个实验过程中同时测定溶液的
 ,则
,则 的变化趋势是
的变化趋势是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】氯气溶于水的体系,称为“氯水”。它含有多种微粒,具有多种性质。
(1)新制氯水中的微粒不包括_______。
(2)自来水可用液氯消毒,实验室用自来水配制下列溶液会产生明显药品变质的是_______。
① ②
② ③
③ ④NaOH ⑤石蕊试液
④NaOH ⑤石蕊试液
(3)相同温度和压强下,研究在不同溶液中,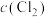 随溶液浓度的变化,见下图。下列说法不正确的是_______。
随溶液浓度的变化,见下图。下列说法不正确的是_______。

(4)制取浓HClO溶液
①在试管中加入过量的块状碳酸钙,再加入约20 mL饱和氯水,使之充分反应,观察现象;②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;③为了确定反应产物,将滤液分为两份,分别进行以下实验:第一份与稀盐酸混合,立即产生大量无色气体;第二份加热,看到溶液变浑浊且有大量无色气体产生。经检测,上述实验中产生的无色气体均为 。
。
a.实验①中观察到的现象为_______ ;
b.反应后所得的溶液漂白性增强的原因是_______ ;
c.依据上述实验可推知,②的滤液中的溶质除 、HClO外,还含有
、HClO外,还含有_______ ;
d.实验③中第二份发生的化学反应方程式为_______ 。
(5)探究氯水成分
①向新制氯水中加入 溶液会产生沉淀。某同学为验证除AgCl外还含有AgClO,取过滤、洗涤后的沉淀装入洁净的试管中,加入2 mL浓盐酸,用湿润的淀粉KI试纸靠近试管口,观察到产生黄绿色气体且试纸变蓝。请写出加入浓盐酸时发生的化学反应方程式:
溶液会产生沉淀。某同学为验证除AgCl外还含有AgClO,取过滤、洗涤后的沉淀装入洁净的试管中,加入2 mL浓盐酸,用湿润的淀粉KI试纸靠近试管口,观察到产生黄绿色气体且试纸变蓝。请写出加入浓盐酸时发生的化学反应方程式:_______ 。
②有资料显示:次氯酸银受热会分解产生氯化银和氧气。取新制氯水与足量饱和 溶液反应后得到的固体,用蒸馏水洗涤3次,干燥后称取8.93g装入一洁净试管,测得总质量为16.43g,用酒精灯加热,待氧气释放完全并恢复至室温,测得试管总质量为16.11g,则白色固体中
溶液反应后得到的固体,用蒸馏水洗涤3次,干燥后称取8.93g装入一洁净试管,测得总质量为16.43g,用酒精灯加热,待氧气释放完全并恢复至室温,测得试管总质量为16.11g,则白色固体中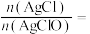
_______ 。
(1)新制氯水中的微粒不包括_______。
A. | B.HCl | C. | D. |
①
 ②
② ③
③ ④NaOH ⑤石蕊试液
④NaOH ⑤石蕊试液| A.①②④ | B.①③⑤ | C.②④⑤ | D.全部 |
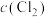 随溶液浓度的变化,见下图。下列说法不正确的是_______。
随溶液浓度的变化,见下图。下列说法不正确的是_______。
A.由图1可知, 与 与 结合生成 结合生成 ,增大 ,增大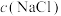 , ,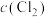 减小 减小 |
B.由图1无法确定 与氯气溶解度的关系 与氯气溶解度的关系 |
C.由图2可知,增大 , ,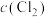 减小 减小 |
D.若将 通入盐酸中,增大 通入盐酸中,增大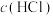 , , 的溶解度一定减小 的溶解度一定减小 |
①在试管中加入过量的块状碳酸钙,再加入约20 mL饱和氯水,使之充分反应,观察现象;②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;③为了确定反应产物,将滤液分为两份,分别进行以下实验:第一份与稀盐酸混合,立即产生大量无色气体;第二份加热,看到溶液变浑浊且有大量无色气体产生。经检测,上述实验中产生的无色气体均为
 。
。a.实验①中观察到的现象为
b.反应后所得的溶液漂白性增强的原因是
c.依据上述实验可推知,②的滤液中的溶质除
 、HClO外,还含有
、HClO外,还含有d.实验③中第二份发生的化学反应方程式为
(5)探究氯水成分
①向新制氯水中加入
 溶液会产生沉淀。某同学为验证除AgCl外还含有AgClO,取过滤、洗涤后的沉淀装入洁净的试管中,加入2 mL浓盐酸,用湿润的淀粉KI试纸靠近试管口,观察到产生黄绿色气体且试纸变蓝。请写出加入浓盐酸时发生的化学反应方程式:
溶液会产生沉淀。某同学为验证除AgCl外还含有AgClO,取过滤、洗涤后的沉淀装入洁净的试管中,加入2 mL浓盐酸,用湿润的淀粉KI试纸靠近试管口,观察到产生黄绿色气体且试纸变蓝。请写出加入浓盐酸时发生的化学反应方程式:②有资料显示:次氯酸银受热会分解产生氯化银和氧气。取新制氯水与足量饱和
 溶液反应后得到的固体,用蒸馏水洗涤3次,干燥后称取8.93g装入一洁净试管,测得总质量为16.43g,用酒精灯加热,待氧气释放完全并恢复至室温,测得试管总质量为16.11g,则白色固体中
溶液反应后得到的固体,用蒸馏水洗涤3次,干燥后称取8.93g装入一洁净试管,测得总质量为16.43g,用酒精灯加热,待氧气释放完全并恢复至室温,测得试管总质量为16.11g,则白色固体中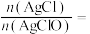
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应 是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态。若升高温度,混合气体的平均相对分子质量___________ ;充入氦气,混合气体的密度___________ 。(填“增大”“减小”或“不变”)
(2)已知: ,反应
,反应 的平衡常数
的平衡常数 。保持温度在
。保持温度在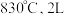 恒容反应器中发生上述反应同时充入以下物质:
恒容反应器中发生上述反应同时充入以下物质: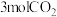 、
、 ,此时反应向
,此时反应向___________ 方向进行。(填“正反应”或“逆反应”)
(3)常温下浓度均为 的下列六种溶液的
的下列六种溶液的 如下表:
如下表:
①上述盐溶液中的阴离子,结合质子能力最强的是___________ 。
②根据表中数据判断:浓度均为 的下列四种物质的溶液中,酸性最强的是
的下列四种物质的溶液中,酸性最强的是___________ ;将各溶液分别稀释100倍, 变化最小的是
变化最小的是___________ (填序号)。
A. B.
B. C.
C. D.
D.
③据上表数据,请你判断下列反应不能成立的是___________ (填序号)。
A.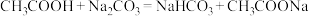
B.
C.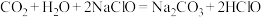
(4)要增大氯水中 的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为
的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为___________ 。
(1)可逆反应
 是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表: | 938 | 1100 |
 | 0.68 | 0.40 |
(2)已知:
 ,反应
,反应 的平衡常数
的平衡常数 。保持温度在
。保持温度在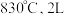 恒容反应器中发生上述反应同时充入以下物质:
恒容反应器中发生上述反应同时充入以下物质: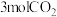 、
、 ,此时反应向
,此时反应向(3)常温下浓度均为
 的下列六种溶液的
的下列六种溶液的 如下表:
如下表:| 溶质 |  |  |  |  |  |
 | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
②根据表中数据判断:浓度均为
 的下列四种物质的溶液中,酸性最强的是
的下列四种物质的溶液中,酸性最强的是 变化最小的是
变化最小的是A.
 B.
B. C.
C. D.
D.
③据上表数据,请你判断下列反应不能成立的是
A.
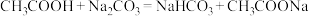
B.

C.
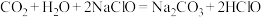
(4)要增大氯水中
 的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为
的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】某学生进行微型实验研究:一块下面衬白纸的玻璃片上有a、b、c、d四个位置,分别滴加浓度为0.1mol/L的四种溶液各1滴,每种彼此分开,形成一个小液滴。在圆心e处放置2粒芝麻粒大小的 晶体,然后向
晶体,然后向 晶体滴加一滴浓盐酸,并将表面皿盖好。可观察到a、b、c、d、e五个位置均有明显反应。完成下列填空:
晶体滴加一滴浓盐酸,并将表面皿盖好。可观察到a、b、c、d、e五个位置均有明显反应。完成下列填空:

(1)e处立即发生反应,化学方程式如下,请配平,并标出电子转移方向和数目___________
___________
 ___________HCl(浓)→___________KCl
___________HCl(浓)→___________KCl ___________
___________
 ___________
___________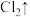
 ___________
___________
反应中,氧化剂与还原剂的物质的量之比为___________ 。
(2)b处实验现象为___________ 。d处发生氧化还原反应的离子方程式为___________ 。通过此实验___________ (填“能”或“不能”)比较 、
、 、
、 三种物质氧化性的强弱。若能,则其氧化性由强到弱的顺序是
三种物质氧化性的强弱。若能,则其氧化性由强到弱的顺序是___________ 。
(3)在氯水中,下列关系正确的是___________ (选填编号)。
a.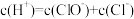 b.
b.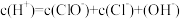
c.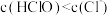 d.
d.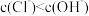
(4)常温下,将 缓慢通入水中至饱和,然后改向其中滴加浓NaOH溶液。整个实验过程中的pH变化曲线如图所示,不考虑次氯酸分解与溶液体积变化,下列叙述正确的是
缓慢通入水中至饱和,然后改向其中滴加浓NaOH溶液。整个实验过程中的pH变化曲线如图所示,不考虑次氯酸分解与溶液体积变化,下列叙述正确的是___________ 。

a.实验过程中可以用pH试纸测定溶液的pH
b.由a→b过程中,溶液中HClO的浓度增大
c.由b→c过程中,溶液中 的浓度减少
的浓度减少
d.c点以后溶液呈碱性,没有漂白性
 晶体,然后向
晶体,然后向 晶体滴加一滴浓盐酸,并将表面皿盖好。可观察到a、b、c、d、e五个位置均有明显反应。完成下列填空:
晶体滴加一滴浓盐酸,并将表面皿盖好。可观察到a、b、c、d、e五个位置均有明显反应。完成下列填空:
(1)e处立即发生反应,化学方程式如下,请配平,并标出电子转移方向和数目
___________

 ___________HCl(浓)→___________KCl
___________HCl(浓)→___________KCl ___________
___________
 ___________
___________
 ___________
___________
反应中,氧化剂与还原剂的物质的量之比为
(2)b处实验现象为
 、
、 、
、 三种物质氧化性的强弱。若能,则其氧化性由强到弱的顺序是
三种物质氧化性的强弱。若能,则其氧化性由强到弱的顺序是(3)在氯水中,下列关系正确的是
a.
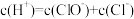 b.
b.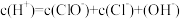
c.
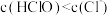 d.
d.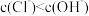
(4)常温下,将
 缓慢通入水中至饱和,然后改向其中滴加浓NaOH溶液。整个实验过程中的pH变化曲线如图所示,不考虑次氯酸分解与溶液体积变化,下列叙述正确的是
缓慢通入水中至饱和,然后改向其中滴加浓NaOH溶液。整个实验过程中的pH变化曲线如图所示,不考虑次氯酸分解与溶液体积变化,下列叙述正确的是
a.实验过程中可以用pH试纸测定溶液的pH
b.由a→b过程中,溶液中HClO的浓度增大
c.由b→c过程中,溶液中
 的浓度减少
的浓度减少d.c点以后溶液呈碱性,没有漂白性
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】固体粉末 中含有
中含有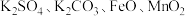 等物质,现取
等物质,现取 进行连续实验,实验过程及产物如图:
进行连续实验,实验过程及产物如图:
(1)①气体C的主要成分是___________ (填“ ”或“
”或“ ”)。
”)。
②溶液B中一定存在的金属阳离子是 、
、___________ (填“ ”或“
”或“ ”)。
”)。
③实验室收集 时用排
时用排___________ (填“饱和食盐水”或“饱和碳酸氢钠溶液”)法。
(2)回收利用 是环境科学的研究热点。工业上常在高温、高压、催化剂条件下利用天然气与二氧化碳反应制备合成气
是环境科学的研究热点。工业上常在高温、高压、催化剂条件下利用天然气与二氧化碳反应制备合成气 ,其原理是
,其原理是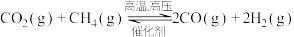 。
。
①恒温条件下,分别向甲、乙两个恒容容器中各加入 与
与 的混合气体,开始时容器压强:甲
的混合气体,开始时容器压强:甲 乙。则反应速率关系是容器甲
乙。则反应速率关系是容器甲___________ (填“ ”或“
”或“ ”)容器乙。
”)容器乙。
②上述反应达到最大限度时,则___________ (填字母)。
A.正、逆反应速率相等 B. 的转化率为
的转化率为 C.反应停止
C.反应停止
 中含有
中含有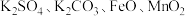 等物质,现取
等物质,现取 进行连续实验,实验过程及产物如图:
进行连续实验,实验过程及产物如图: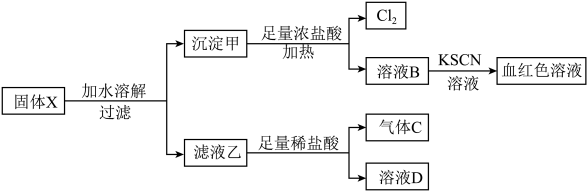
(1)①气体C的主要成分是
 ”或“
”或“ ”)。
”)。②溶液B中一定存在的金属阳离子是
 、
、 ”或“
”或“ ”)。
”)。③实验室收集
 时用排
时用排(2)回收利用
 是环境科学的研究热点。工业上常在高温、高压、催化剂条件下利用天然气与二氧化碳反应制备合成气
是环境科学的研究热点。工业上常在高温、高压、催化剂条件下利用天然气与二氧化碳反应制备合成气 ,其原理是
,其原理是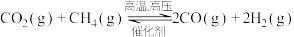 。
。①恒温条件下,分别向甲、乙两个恒容容器中各加入
 与
与 的混合气体,开始时容器压强:甲
的混合气体,开始时容器压强:甲 乙。则反应速率关系是容器甲
乙。则反应速率关系是容器甲 ”或“
”或“ ”)容器乙。
”)容器乙。②上述反应达到最大限度时,则
A.正、逆反应速率相等 B.
 的转化率为
的转化率为 C.反应停止
C.反应停止
您最近一年使用:0次