某无色试样溶液可能含有以下离子中的一种或几种:K+、Mg2+、Al3+、Cu2+、SO42-、Cl-。现进行如下实验:
① 取少量该试样溶液加入过量的氢氧化钡溶液,充分反应后过滤,得到沉淀1和溶液1。
② 向沉淀1中加入过量盐酸,沉淀部分溶解。
③ 向溶液1中通入适量二氧化碳气体,充分反应后过滤,得到沉淀2和溶液2。
④ 向沉淀2中加入过量盐酸,沉淀溶解并放出气体。
⑤ 另取少量该试样溶液进行焰色反应实验,透过蓝色钴玻璃片观察到紫色火焰。
(1)该试样溶液中肯定存在的离子有______________________ 。
(2)该试样溶液中可能存在的离子有__________________________ 。
(3)该试样溶液中一定不存在的离子有__________________________ 。
① 取少量该试样溶液加入过量的氢氧化钡溶液,充分反应后过滤,得到沉淀1和溶液1。
② 向沉淀1中加入过量盐酸,沉淀部分溶解。
③ 向溶液1中通入适量二氧化碳气体,充分反应后过滤,得到沉淀2和溶液2。
④ 向沉淀2中加入过量盐酸,沉淀溶解并放出气体。
⑤ 另取少量该试样溶液进行焰色反应实验,透过蓝色钴玻璃片观察到紫色火焰。
(1)该试样溶液中肯定存在的离子有
(2)该试样溶液中可能存在的离子有
(3)该试样溶液中一定不存在的离子有
更新时间:2019-03-03 11:40:19
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】某兴趣小组对NaHSO4的性质进行了如下的探究,从组成上看,它与NaHCO3类似,应该属于_______ (填“酸”“碱”或“盐”)。
【做出预测】
a.NaHSO4溶液呈碱性
b.NaHSO4溶液能与盐酸反应
c.NaHSO4溶液能与NaOH溶液反应
【对比讨论】
小组内有的同学对比NaHSO4与NaHCO3的组成及复分解反应的条件,认为预测b不正确,它的理由是_______ 。
【实验设计】
【得出结论】
上述预测a、c中,正确的是_______ (填序号)。
【查阅资料】
为了弄清原因,他们查阅了资料,发现NaHSO4在溶液中的电离方程式是NaHSO4=Na++H++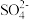 ,他们根据资料又设计了如下三个实验。
,他们根据资料又设计了如下三个实验。
【补充实验】
a.上述实验③中的现象是_______ 。
b.实验④中发生反应的离子方程式为_______ 。
c.对上述实验⑤中发生反应的离子方程式,小组内同学分别写出了解释:
解释I:Ba2++OH-+H++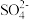 =BaSO4↓+H2O
=BaSO4↓+H2O
解释II:Ba2++2OH-+2H++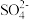 =BaSO4↓+2H2O
=BaSO4↓+2H2O
他们相互争论不下,请教于老师,老师说两个解释都是正确的,一个代表刚开始滴加Ba(OH)2溶液时的反应的离子方程式,另一个代表后来的反应的离子方程式。你认为刚开始滴加时的反应离子方程式应该是_______ (填“解释I”或“解释II”)。
【做出预测】
a.NaHSO4溶液呈碱性
b.NaHSO4溶液能与盐酸反应
c.NaHSO4溶液能与NaOH溶液反应
【对比讨论】
小组内有的同学对比NaHSO4与NaHCO3的组成及复分解反应的条件,认为预测b不正确,它的理由是
【实验设计】
| 序号 | 实验操作 | 实验现象 |
| ① | 取少量的NaHSO4溶液,滴加2-3滴石蕊试液。 | 溶液变红 |
| ② | 向①中溶液中逐滴加入NaOH溶液。 | 溶液先变成紫色,后变成蓝色 |
上述预测a、c中,正确的是
【查阅资料】
为了弄清原因,他们查阅了资料,发现NaHSO4在溶液中的电离方程式是NaHSO4=Na++H++
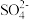 ,他们根据资料又设计了如下三个实验。
,他们根据资料又设计了如下三个实验。【补充实验】
| 序号 | 实验操作 | 实验现象 |
| ③ | 向NaHSO4溶液中滴加NaHCO3溶液。 | _______ |
| ④ | 向NaHSO4溶液滴加BaCl2溶液。 | 有白色沉淀生成 |
| ⑤ | 向NaHSO4溶液滴加Ba(OH)2溶液。 | 有白色沉淀生成 |
b.实验④中发生反应的离子方程式为
c.对上述实验⑤中发生反应的离子方程式,小组内同学分别写出了解释:
解释I:Ba2++OH-+H++
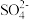 =BaSO4↓+H2O
=BaSO4↓+H2O解释II:Ba2++2OH-+2H++
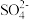 =BaSO4↓+2H2O
=BaSO4↓+2H2O他们相互争论不下,请教于老师,老师说两个解释都是正确的,一个代表刚开始滴加Ba(OH)2溶液时的反应的离子方程式,另一个代表后来的反应的离子方程式。你认为刚开始滴加时的反应离子方程式应该是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】以海水为基本原料可制取单质钠、氯气、纯碱等重要的化工产品,其中一种工艺流程如图所示(粗盐中的杂质主要是 、
、 ):
):

回答下列问题:
(1)利用盐田获得粗盐的过程主要发生的是_______ (填“物理变化”或“化学变化”),试剂X、Y的化学式分别为_______ (按加入的先后顺序写)。
(2)调pH之前必须进行的一项操作的名称是_______ ;生成小苏打的离子方程式是_______ 。
(3)由精盐制备钠的化学方程式是_______ 。
 、
、 ):
):
回答下列问题:
(1)利用盐田获得粗盐的过程主要发生的是
(2)调pH之前必须进行的一项操作的名称是
(3)由精盐制备钠的化学方程式是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】对一份稀溶液做初步分析后发现,溶液无色、澄清,其中可能含有 、Na+、
、Na+、 、H+、
、H+、 、
、 、Cl-等离子中的若干种。然后又做了如下分析,以确定这些离子是否大量存在。
、Cl-等离子中的若干种。然后又做了如下分析,以确定这些离子是否大量存在。
①用pH试纸检测溶液的酸碱性,结果pH试纸显红色。
②取2mL溶液用BaCl2溶液和稀硝酸进行检验,结果生成了白色沉淀。
③对②中所得的混合物充分静置后,取其澄清的液体用AgNO3溶液和稀硝酸进行检验,结果又生成了白色沉淀。请回答下列问题:
(1)溶液中一定存在的离子是________ ,一定不存在的离子是________ 。
(2)上述实验操作中,有错误的操作是________ (填写序号)。改正该错误的方法是(要做较详细的说明)________ 。
(3)到目前为止,仍不能肯定溶液中是否存在的离子是_______ ,若想确定是否含有其中的金属阳离子,应该采用什么方法________ (写出方法即可)。
 、Na+、
、Na+、 、H+、
、H+、 、
、 、Cl-等离子中的若干种。然后又做了如下分析,以确定这些离子是否大量存在。
、Cl-等离子中的若干种。然后又做了如下分析,以确定这些离子是否大量存在。①用pH试纸检测溶液的酸碱性,结果pH试纸显红色。
②取2mL溶液用BaCl2溶液和稀硝酸进行检验,结果生成了白色沉淀。
③对②中所得的混合物充分静置后,取其澄清的液体用AgNO3溶液和稀硝酸进行检验,结果又生成了白色沉淀。请回答下列问题:
(1)溶液中一定存在的离子是
(2)上述实验操作中,有错误的操作是
(3)到目前为止,仍不能肯定溶液中是否存在的离子是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】已知某工业废水中含有大量的 ,还可能大量存在
,还可能大量存在 中的几种,以及部分污泥,通过下列流程可从该废水中回收
中的几种,以及部分污泥,通过下列流程可从该废水中回收 晶体及固体单质。已知氧化性:
晶体及固体单质。已知氧化性: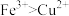 。
。
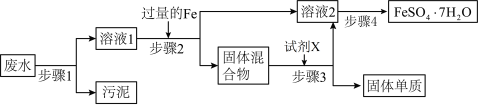
(1)不做任何实验就可以确定上述工业废水中一定不存在的离子是___________ (填离子符号)
(2)根据步骤2中得到固体混合物可以确定上述工业废水中肯定存在的离子是___________ (填离子符号)。
(3) 的存在对回收
的存在对回收 晶体的纯度
晶体的纯度___________ (填“有”或“无)影响,理由是___________ 。
(4)检验上述工业废水中是否存在 常用方法的名称是
常用方法的名称是___________ 。
(5)步骤3中加入的试剂X为________ (填试剂名称),发生反应的离子方程式为_________ 。
(6)步骤4中涉及的操作是:___________ 、___________ 、过滤、洗涤、烘干。烘干操作需在低温条件下进行,原因是___________ 。
 ,还可能大量存在
,还可能大量存在 中的几种,以及部分污泥,通过下列流程可从该废水中回收
中的几种,以及部分污泥,通过下列流程可从该废水中回收 晶体及固体单质。已知氧化性:
晶体及固体单质。已知氧化性: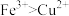 。
。
(1)不做任何实验就可以确定上述工业废水中一定不存在的离子是
(2)根据步骤2中得到固体混合物可以确定上述工业废水中肯定存在的离子是
(3)
 的存在对回收
的存在对回收 晶体的纯度
晶体的纯度(4)检验上述工业废水中是否存在
 常用方法的名称是
常用方法的名称是(5)步骤3中加入的试剂X为
(6)步骤4中涉及的操作是:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】有一固体粉末,其中可能含有Na2CO3、NH4NO3、Na2SO4、CuCl2、Ba(NO3)2、K2CO3、K2SO4中的一种或几种,现按下列步骤进行实验。
(1)将该粉末溶于水得无色溶液和白色沉淀。
(2)在滤出的沉淀中加入稀硝酸,有部分沉淀溶解,同时产生无色气体。
(3)取滤液做焰色反应,可证明滤液中含Na+,不含K+。
由上述现象推断:
(1)该混合物中一定含有_______ ;一定不含有______ ,可能含有_______ 。
(2)如要检验其是否存在,将如何操作______ 。请写出相应的化学方程式:_____ 。
(1)将该粉末溶于水得无色溶液和白色沉淀。
(2)在滤出的沉淀中加入稀硝酸,有部分沉淀溶解,同时产生无色气体。
(3)取滤液做焰色反应,可证明滤液中含Na+,不含K+。
由上述现象推断:
(1)该混合物中一定含有
(2)如要检验其是否存在,将如何操作
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】A、B、C、D四种可溶性盐,阳离子分别可能是Ba2+、Na+、Ag+、Cu2+中的某一种,阴离子分别可能是NO3-、SO42-、Cl-、CO32-中的某一种。根据你所学习的知识回答下列问题:①把四种盐分别溶于盛有蒸馏水的试管中,只有C盐的溶液呈蓝色。②向①的四支试管中分别加入盐酸,B盐有沉淀生成,D盐有无色无味气体溢出。
(1)四种盐的化学式分别为:A、_______ ;B、___________ ;C、__________ ;D、________ 。
(2)写出向①的四支试管中分别加盐酸时的离子反应方程式____________________________ 。
(1)四种盐的化学式分别为:A、
(2)写出向①的四支试管中分别加盐酸时的离子反应方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】利用“价类二维图”研究物质的性质是化学研究的重要手段。下图是氯元素的化合价与部分物质类别的对应关系。请回答下列问题:

(1)已知D焰色试验时其火焰呈现紫色。A、B、C、D四种物质中,属于电解质的是___________ (填化学式)。
(2)将E滴入碳酸氢钠溶液中有大量气泡产生,该反应的离子方程式为___________ 。
(3)取10 mL某84消毒液,加水稀释,配制成100 mL稀溶液。配制过程中使用的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒、___________ 。
(4)关于配制过程的下列说法中,正确的是___________。
(5)工业上“侯氏制碱法”以NaCl、NH3、CO2及水等为原料制备纯碱,检验产品Na2CO3中是否含有氯离子,需要的试剂有___________ 。
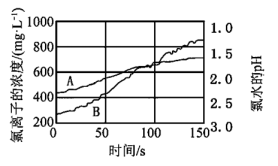
(6)某兴趣小组利用数字化实验测定光照过程中氯水的pH、氯水中氯离子的浓度的变化,实验结果如下图所示。A曲线是___________ 的变化曲线。由图可知50 s时Cl-浓度约为450 mg/L,则氯水中氯离子物质的量浓度约为___________ mol/L。(列出计算式即可)

(1)已知D焰色试验时其火焰呈现紫色。A、B、C、D四种物质中,属于电解质的是
(2)将E滴入碳酸氢钠溶液中有大量气泡产生,该反应的离子方程式为
(3)取10 mL某84消毒液,加水稀释,配制成100 mL稀溶液。配制过程中使用的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒、
(4)关于配制过程的下列说法中,正确的是___________。
| A.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制 |
| B.未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低 |
| C.定容时,俯视观察刻度线可能导致结果偏低 |
| D.定容、摇匀后,将溶液保存于容量瓶中,随用随取。 |
(5)工业上“侯氏制碱法”以NaCl、NH3、CO2及水等为原料制备纯碱,检验产品Na2CO3中是否含有氯离子,需要的试剂有
(6)某兴趣小组利用数字化实验测定光照过程中氯水的pH、氯水中氯离子的浓度的变化,实验结果如下图所示。A曲线是

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】某无色透明的溶液中可能大量含有以下离子中的几种: 、
、 、
、 、
、 、
、 、
、 、
、 、
、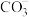 、
、 、
、 ,且每种离子的数目相等。为确定其组成,分别取原溶液进行了如下四组实验:
,且每种离子的数目相等。为确定其组成,分别取原溶液进行了如下四组实验:
①取少量溶液于试管中,滴入石蕊试液,溶液变红;
②取少量溶液做焰色试验,透过蓝色钴玻璃片观察,焰色为紫色;
③取少量溶液于试管中,滴入硝酸钡溶液,产生白色沉淀;
④取少量溶液于试管中,滴入过量氢氧化钠溶液,产生白色沉淀;
(1)由步骤①可以判断溶液中存在的离子为___________ (填离子符号,下同),由步骤②可以判断溶液中存在的离子为___________ 。
(2)写出步骤③发生反应的离子方程式___________ ;写出步骤④产生白色沉淀的离子方程式___________ ;
(3)综合以上实验分析,该溶液中一定存在的阴离子是___________ (填离子符号)。
(4)取一定量的原溶液,逐滴滴入 溶液,恰好使溶液中的沉淀量达到最大值,此时溶液呈
溶液,恰好使溶液中的沉淀量达到最大值,此时溶液呈___________ 性(填“酸”、“中”、“碱”),此时溶液中还大量存在的阳离子为___________ (填离子符号)。
(5)取一定量的原溶液,加入铜片,观察到铜片溶解,同时产生气泡(经测定该气体为NO),溶液最终变为蓝色。写出该反应的离子方程式___________ 。
 、
、 、
、 、
、 、
、 、
、 、
、 、
、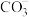 、
、 、
、 ,且每种离子的数目相等。为确定其组成,分别取原溶液进行了如下四组实验:
,且每种离子的数目相等。为确定其组成,分别取原溶液进行了如下四组实验:①取少量溶液于试管中,滴入石蕊试液,溶液变红;
②取少量溶液做焰色试验,透过蓝色钴玻璃片观察,焰色为紫色;
③取少量溶液于试管中,滴入硝酸钡溶液,产生白色沉淀;
④取少量溶液于试管中,滴入过量氢氧化钠溶液,产生白色沉淀;
(1)由步骤①可以判断溶液中存在的离子为
(2)写出步骤③发生反应的离子方程式
(3)综合以上实验分析,该溶液中一定存在的阴离子是
(4)取一定量的原溶液,逐滴滴入
 溶液,恰好使溶液中的沉淀量达到最大值,此时溶液呈
溶液,恰好使溶液中的沉淀量达到最大值,此时溶液呈(5)取一定量的原溶液,加入铜片,观察到铜片溶解,同时产生气泡(经测定该气体为NO),溶液最终变为蓝色。写出该反应的离子方程式
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。

请填写下列空白:
(1)写出B和C的电子式:B___________ ,C___________
(2)以上反应中,属于非氧化还原反应的有___________ (填序号)
(3)写出反应④的化学方程式___________ ,该反应中B___________
a.是氧化剂 b.是还原剂 c.既是氧化剂又是还原剂 d.既非氧化剂又非还原剂
(4)写出下列反应的离子方程式:
C+E—→D___________
E与足量Ba(OH)2溶液___________
B与FeSO4溶液___________

请填写下列空白:
(1)写出B和C的电子式:B
(2)以上反应中,属于非氧化还原反应的有
(3)写出反应④的化学方程式
a.是氧化剂 b.是还原剂 c.既是氧化剂又是还原剂 d.既非氧化剂又非还原剂
(4)写出下列反应的离子方程式:
C+E—→D
E与足量Ba(OH)2溶液
B与FeSO4溶液
您最近一年使用:0次



