下列说法正确的是( )
| A.在101 kPa时,1 mol S(s)和2 mol S(s)的燃烧热相等 |
| B.需要加热才能发生的反应一定是吸热反应 |
| C.已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则稀H2SO4溶液和稀Ba(OH)2溶液反应的反应热ΔH > 2×(-57.3) kJ·mol-1 |
| D.已知2C(s)+2O2(g)===2CO2(g) ΔH=a kJ·mol-1;2C(s)+O2(g)===2CO(g) ΔH=b kJ·mol-1;则b>0>a |
更新时间:2019-05-18 17:56:23
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】下列依据热化学方程式得出的结论正确的是
A.已知2SO2(g)+O2(g) 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量 |
| B.若C(石墨,s)=C(金刚石,s) ΔH>0,则石墨比金刚石稳定 |
| C.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.4 kJ·mol-1,则20.0 g NaOH固体与稀盐酸完全中和,放出28.7 kJ的热量 |
| D.已知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1>ΔH2 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】下列热化学方程式正确的是
| A.CH4的燃烧热为890 kJ·mol-1:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=—890 kJ·mol-1 |
| B.中和热ΔH=—57.3 kJ·mol-1:CH3COOH(aq)+NaOH(aq)=H2O(l)+CH3COONa(aq) ΔH=-57.3 kJ·mol-1 |
C.一定条件下,0.5 mol N2与1.5 mol H2充分反应后放出35.5 kJ的热量:N2(g)+3H2(g)  2NH3(g) ΔH=—71 kJ·mol-1 2NH3(g) ΔH=—71 kJ·mol-1 |
D.96 g O2的能量比96 g O3的能量低b kJ:3O2(g)  2O3(g) ΔH=+b kJ·mol-1 2O3(g) ΔH=+b kJ·mol-1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】下列说法正确的是
| A.同温同压下,H2(g)+ Cl2(g)=2HCl(g)在光照和点燃条件的△H相同 |
B.500 ℃、30 Mpa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g), 放热 akJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g) △H= -2a kJ•mol-1 2NH3(g) △H= -2a kJ•mol-1 |
| C.甲烷的标准燃烧热(△H)为-890.3 kJ • mol -1,则甲烷燃烧的热化学方程式表示为:CH4(g)+2O2(g) =CO2(g) +2H2O(g) △H=-890.3kJ•mol-1 |
| D.HCl和NaOH反应的中和热△H= -57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3) kJ/mol |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】下列有关能量的判断或表示方法正确的是
| A.从C(s,石墨)=C(s,金刚石) ΔH=+1.9kJ·mol-1,可知石墨比金刚石更稳定 |
| B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量更多 |
| C.由H+(aq)+OH-(aq)==H2O(l) ΔH= -57.3kJ·mol-1,可知含1 mol CH3COOH的溶液与含1 mol NaOH的溶液充分混合反应,放出的热量等于57.3 kJ |
| D.2g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)==2H2O(l) ΔH= +571.6kJ·mol-1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列有关热化学方程式的叙述正确的是
A.已知: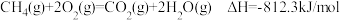 ,则甲烷的燃烧热为 ,则甲烷的燃烧热为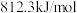 |
B.已知: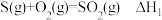 ; ;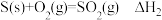 ,则 ,则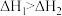 |
C.已知: ,增加氮气和氢气的用量,则 ,增加氮气和氢气的用量,则 不变 不变 |
D.在稀溶液中, ,则将 ,则将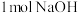 固体加入 固体加入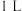  的稀盐酸溶液中,放出的热量等于 的稀盐酸溶液中,放出的热量等于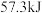 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】下列有关热化学方程式的叙述正确的是 ( )
| A.已知C(石墨,s)===C(金刚石,s) ΔH>0,则金刚石比石墨稳定 |
| B.已知2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol,则氢气的燃烧热为ΔH=-285.8 kJ/mol |
| C.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)===CH3COONa(aq)+H2O(l)ΔH=-57.4 kJ/mol |
| D.已知2C(s)+2O2(g)===2CO2(g) ΔH1;2C(s)+O2(g)===2CO(g)ΔH2,则ΔH1>ΔH2 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】下列说法正确的是( )
| A.形成生成物中化学键所释放的总能量大于断开反应物中化学键所吸收的总能量时,△H<0 |
| B.体系温度升高一定是反应放热造成的;体系温度降低一定是反应吸热造成的 |
| C.需要加热才能进行的反应一定是吸热反应 |
| D.反应放出热量的多少与反应物的质量和状态无关 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】人类对能源的需求不断增加,开发新能源、节能减排成为当前国际能源研究的重要课题。下列说法正确的是
| A.氢能、太阳能、地热能、风能、潮汐能均为新能源 |
| B.寻找高效催化剂可以使常温下水分解并释放能量 |
C.通过煤的气化、液化等物理方法将煤转化为CO、 等气体燃料,可提高煤燃烧的热效率 等气体燃料,可提高煤燃烧的热效率 |
| D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的标准燃烧热 |
您最近一年使用:0次

 捕获和转化可减少
捕获和转化可减少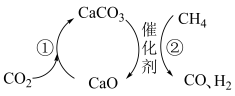
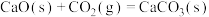
 ,反应②:
,反应②: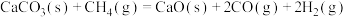
 。下列有关说法不正确的是
。下列有关说法不正确的是 ,则
,则 与
与 的总能量高于
的总能量高于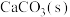 的能量
的能量 的
的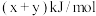 ,且
,且


