50 mL 0.5 mol/L的盐酸与50 mL0.55 mol/L的NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算反应热。
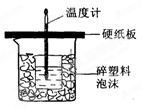
请回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是_______ ;(由图可知该装置有两处不妥之处:①_______ ,②_______
(2)烧杯间填满碎塑料泡沫的作用是___ 。
(3)大烧杯上如不盖硬纸板,则求得的反应热数值___ 。(填“偏大”、“偏小’、“无影响”)。
(4)若实验过程中,测得盐酸和NaOH溶液的起始温度的平均值为25.2℃。溶液混合后的最高温度为28.6℃。试经过计算写出表示该反应中和热的热化学方程式:_______ (混合溶液的比热容c=4.18J/(g∙℃),盐酸和NaOH溶液的密度认为都是1 g/cm3)
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会____ (填“偏大”、“偏小”、“无影响”)。

请回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是
(2)烧杯间填满碎塑料泡沫的作用是
(3)大烧杯上如不盖硬纸板,则求得的反应热数值
(4)若实验过程中,测得盐酸和NaOH溶液的起始温度的平均值为25.2℃。溶液混合后的最高温度为28.6℃。试经过计算写出表示该反应中和热的热化学方程式:
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会
2011·内蒙古呼伦贝尔·一模 查看更多[1]
(已下线)2012届内蒙古呼伦贝尔市牙克石林业一中高三上学期第一次模拟考试化学试卷
更新时间:2016-12-09 02:29:40
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】利用如图所示装置测定中和热的实验步骤如下:

步骤一:用量筒量取50ml 0.50 mol•L-1盐酸倒入小烧杯中,测出盐酸温度t1;
步骤二:用另一量筒量取50ml 0.55 mol•L-1 NaOH溶液,并用另一温度计测出其温度t2;
步骤三:将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度t3。
回答下列问题:
(1)步骤三中倒入NaOH溶液的正确操作是______ 。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使盐酸与NaOH溶液混合均匀的正确操作是______ (填序号)。
A.轻轻地振荡烧杯 B.揭开硬纸片用玻璃棒搅拌
C.用温度计小心搅拌 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(3)______ (填“能”或“不能”)用Ba(OH)2溶液和硫酸代替NaOH溶液和盐酸测中和热,理由是______ 。
(4)在反应中若因为有放热现象,而造成少量HCl在反应中挥发,则测得的中和热______ (填“偏大”、“偏小”或“不变”)。

步骤一:用量筒量取50ml 0.50 mol•L-1盐酸倒入小烧杯中,测出盐酸温度t1;
步骤二:用另一量筒量取50ml 0.55 mol•L-1 NaOH溶液,并用另一温度计测出其温度t2;
步骤三:将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度t3。
回答下列问题:
(1)步骤三中倒入NaOH溶液的正确操作是
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使盐酸与NaOH溶液混合均匀的正确操作是
A.轻轻地振荡烧杯 B.揭开硬纸片用玻璃棒搅拌
C.用温度计小心搅拌 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(3)
(4)在反应中若因为有放热现象,而造成少量HCl在反应中挥发,则测得的中和热
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】重庆市实验中学化学兴趣小组要完成中和热的测定实验。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、50mL量筒、50 mL0.25 mol· L-1稀硫酸、50 mL 0.55mol· L-1NaOH溶液,尚缺少的实验玻璃用品是:___________ 、___________ 。
(2)泡沫塑料、泡沫塑料板的作用是___________ 。
(3)某同学用该装置做实验,因有些操作不规范,造成所测中和热的数值偏低,请分析可能的原因是___________ (用标号字母填写)。
A.测量稀硫酸温度后,温度计没用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.量取稀硫酸时仰视计数
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.大烧杯的盖板中间小孔太大了
(4)实验得到表中的数据:
假设0.55mol/LNaOH溶液和0.25mol/L硫酸溶液的密度都近似取1g/cm3,中和后所得溶液的比热容c =4.18 J/(g·℃)。则中和热ΔH =___________ kJ/mol。(小数点后保留两位)
(5)如果用60mL0.25mol/L硫酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量___________ (填:“增多”、“不变”、“减少”),所求中和热___________ (填:“相等”、“不相等”)。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、50mL量筒、50 mL0.25 mol· L-1稀硫酸、50 mL 0.55mol· L-1NaOH溶液,尚缺少的实验玻璃用品是:
(2)泡沫塑料、泡沫塑料板的作用是
(3)某同学用该装置做实验,因有些操作不规范,造成所测中和热的数值偏低,请分析可能的原因是
A.测量稀硫酸温度后,温度计没用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.量取稀硫酸时仰视计数
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.大烧杯的盖板中间小孔太大了
(4)实验得到表中的数据:
| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
(5)如果用60mL0.25mol/L硫酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】I.在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256kJ的热量。
(1)写出该反应的热化学方程式______ 。
(2)已知H2O(l)=H2O(g) △H=+44kJ/mol,则16g液态肼燃烧生成氮气和液态水时,放出的热量是______ kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是______ 。
(4)已知①2O2(g)+N2(g)=N2O4(l);△H1
②N2(g)+2H2(g)=N2H4(l);△H2
③O2(g)+2H2(g)=2H2O(g);△H3
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g);△H4
上述反应热效应之间的关系式为△H4=______ 。
II.中和热的测定是高中重要的定量实验.取0.55moL/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
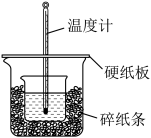
(5)从图中实验装置看,其中尚缺少的一种玻璃用品是______ 。
(6)若改用60mL0.25mol•L-1H2SO4和50mL0.55mol•L-1NaOH溶液进行反应与上述实验相比,所放出的热量______ (填“相等”、“不相等”),若实验操作均正确,则所求中和热______ (填“相等”、“不相等”)。
(7)若上述实验测出来的中和热比57.3kJ/mol更小,则产生偏差的原因可能是______ (填字母)。
a.实验装置保温、隔热效果差
b.量取硫酸溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(1)写出该反应的热化学方程式
(2)已知H2O(l)=H2O(g) △H=+44kJ/mol,则16g液态肼燃烧生成氮气和液态水时,放出的热量是
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是
(4)已知①2O2(g)+N2(g)=N2O4(l);△H1
②N2(g)+2H2(g)=N2H4(l);△H2
③O2(g)+2H2(g)=2H2O(g);△H3
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g);△H4
上述反应热效应之间的关系式为△H4=
II.中和热的测定是高中重要的定量实验.取0.55moL/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:

(5)从图中实验装置看,其中尚缺少的一种玻璃用品是
(6)若改用60mL0.25mol•L-1H2SO4和50mL0.55mol•L-1NaOH溶液进行反应与上述实验相比,所放出的热量
(7)若上述实验测出来的中和热比57.3kJ/mol更小,则产生偏差的原因可能是
a.实验装置保温、隔热效果差
b.量取硫酸溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】回答下列问题:
(1)某同学测量强酸和强碱的中和热,将50.0 mL 0.10 mol·L-1 H2SO4溶液与50.0 mL 0.22 mol·L-1 NaOH溶液混合,放出0.572kJ热量,该反应的中和热为___________ ,用离子方式表示该反应中和热的热化学方程式:___________ 。
(2)已知:H2(g)+ O2(g)=H2O(g),反应过程中能量变化如图所示
O2(g)=H2O(g),反应过程中能量变化如图所示

已知:a、b、c表示数值(均为正数),下列对a、b、c说法正确的是___________ 。
A.a表示此反应正反应速率的活化能。
B.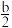 表示O-H键的键能
表示O-H键的键能
C.c表示此反应的反应热△H
D.b表示1摩尔H2O(g)具有的内能
(3)SF6是一种优良的绝缘气体,分子结构中,只存在S-F键,已知1 mol S(s)转化为气态硫原子吸收能量280kJ,F-F键能为160 kJ·mol-1,S-F键能为330 kJ·mol-1,试写出S(s)和F2(g)反应生成SF6(g)的热化学方程式___________ 。
(1)某同学测量强酸和强碱的中和热,将50.0 mL 0.10 mol·L-1 H2SO4溶液与50.0 mL 0.22 mol·L-1 NaOH溶液混合,放出0.572kJ热量,该反应的中和热为
(2)已知:H2(g)+
 O2(g)=H2O(g),反应过程中能量变化如图所示
O2(g)=H2O(g),反应过程中能量变化如图所示
已知:a、b、c表示数值(均为正数),下列对a、b、c说法正确的是
A.a表示此反应正反应速率的活化能。
B.
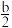 表示O-H键的键能
表示O-H键的键能C.c表示此反应的反应热△H
D.b表示1摩尔H2O(g)具有的内能
(3)SF6是一种优良的绝缘气体,分子结构中,只存在S-F键,已知1 mol S(s)转化为气态硫原子吸收能量280kJ,F-F键能为160 kJ·mol-1,S-F键能为330 kJ·mol-1,试写出S(s)和F2(g)反应生成SF6(g)的热化学方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】某实验小组用50mL0.50mol·L-1盐酸溶液与50mL0.55mol·L-1NaOH溶液进行中和热的测定,装置如图所示。回答下列问题:

(1)图中装置缺少的玻璃仪器是___________ 。
(2)隔热层的作用___________ 。
(3)倒入NaOH溶液的正确操作是________ (填字母序号,下同)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(4)NaOH溶液的浓度要稍大于盐酸浓度的原因是___________ 。
(5)请填写表中的平均温度差:
(6)近似认为0.50mol/L盐酸溶液与0.55mol/LNaOH溶液的密度都是1g/mL,中和后生成溶液的比热容c=4.18J·g-1·℃-1,则上述实验测得的中和热△H=________ (结果保留至小数点后一位)。
(7)上述实验测得放出的热量小于57.3kJ,产生偏差的原因可能是________ (填字母)。
A.用量筒量取盐酸溶液时仰视读数 B.实验过程中,内筒未加杯盖 C.NaOH 分多次倒入

(1)图中装置缺少的玻璃仪器是
(2)隔热层的作用
(3)倒入NaOH溶液的正确操作是
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(4)NaOH溶液的浓度要稍大于盐酸浓度的原因是
(5)请填写表中的平均温度差:
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 平均温度差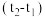 /℃ /℃ | ||
| HCl | NaOH | 平均值 | |||
| 1 | 23.0 | 23.2 | 23.1 | 26.3 | |
| 2 | 23.2 | 23.4 | 23.3 | 27.2 | |
| 3 | 22.9 | 22.9 | 22.9 | 26.0 | |
| 4 | 23.1 | 22.9 | 23.0 | 26.3 | |
(6)近似认为0.50mol/L盐酸溶液与0.55mol/LNaOH溶液的密度都是1g/mL,中和后生成溶液的比热容c=4.18J·g-1·℃-1,则上述实验测得的中和热△H=
(7)上述实验测得放出的热量小于57.3kJ,产生偏差的原因可能是
A.用量筒量取盐酸溶液时仰视读数 B.实验过程中,内筒未加杯盖 C.NaOH 分多次倒入
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】用图中装置测定中和反应热的测定步骤如下:

Ⅰ、测量反应物的温度。
①用量筒量取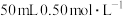 盐酸,打开杯盖,倒入量热计的内筒,盖上杯盖,插入温度计,测量并记录盐酸的温度。用水把温度计上的酸冲洗干净,擦干备用。
盐酸,打开杯盖,倒入量热计的内筒,盖上杯盖,插入温度计,测量并记录盐酸的温度。用水把温度计上的酸冲洗干净,擦干备用。
②用另一个量筒量取 溶液,用温度计测量并记录NaOH溶液的温度。
溶液,用温度计测量并记录NaOH溶液的温度。
Ⅱ、测量反应后体系的温度。
打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒,立即盖上杯盖,插入温度计,用搅拌器匀速搅拌;密切关注温度变化,将最高温度记为反应后体系的温度( )。
)。
Ⅲ、重复测定2次,数据记录见下表。
注:稀盐酸和稀碱密度近似为 ,混合液的比热容为:
,混合液的比热容为: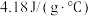
完成以下问题:
(1)上述操作中将NaOH溶液迅速倒入量热计的内筒,并立即盖上杯盖的目的是______ 。
(2)测量过程中,测量盐酸后未清洗温度计即用来测量NaOH溶液温度,其他过程无误,测得反应热的绝对值______ (填“偏大”“不变”或“偏小”,下同);反应后NaOH剩余,测得反应热的数值______ 。
(3)计算此反应的反应热的数值Q=______ KJ,写出中和热(生成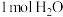 )的热化学方程式(焓变数值精确到0.01)
)的热化学方程式(焓变数值精确到0.01)______ 。
(4)若实验中将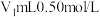 的盐酸与
的盐酸与 未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持
未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持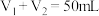 )。
)。

则NaOH溶液的浓度为______ 。

Ⅰ、测量反应物的温度。
①用量筒量取
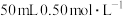 盐酸,打开杯盖,倒入量热计的内筒,盖上杯盖,插入温度计,测量并记录盐酸的温度。用水把温度计上的酸冲洗干净,擦干备用。
盐酸,打开杯盖,倒入量热计的内筒,盖上杯盖,插入温度计,测量并记录盐酸的温度。用水把温度计上的酸冲洗干净,擦干备用。②用另一个量筒量取
 溶液,用温度计测量并记录NaOH溶液的温度。
溶液,用温度计测量并记录NaOH溶液的温度。Ⅱ、测量反应后体系的温度。
打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒,立即盖上杯盖,插入温度计,用搅拌器匀速搅拌;密切关注温度变化,将最高温度记为反应后体系的温度(
 )。
)。Ⅲ、重复测定2次,数据记录见下表。
| 实验次数 | 反应物温度/℃ | 反应前体系温度 | 反应后体系温度 | 温度差 | |
| 盐酸 | NaOH溶液 |  /℃ /℃ |  /℃ /℃ | 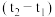 /℃ /℃ | |
| 1 | 24.9 | 25.1 | 25.0 | 28.3 | 3.3 |
| 2 | 24.8 | 25.0 | 24.9 | 28.1 | 3.2 |
| 3 | 25.0 | 25.2 | 25.1 | 28.5 | 3.4 |
 ,混合液的比热容为:
,混合液的比热容为: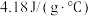
完成以下问题:
(1)上述操作中将NaOH溶液迅速倒入量热计的内筒,并立即盖上杯盖的目的是
(2)测量过程中,测量盐酸后未清洗温度计即用来测量NaOH溶液温度,其他过程无误,测得反应热的绝对值
(3)计算此反应的反应热的数值Q=
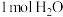 )的热化学方程式(焓变数值精确到0.01)
)的热化学方程式(焓变数值精确到0.01)(4)若实验中将
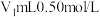 的盐酸与
的盐酸与 未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持
未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持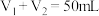 )。
)。
则NaOH溶液的浓度为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、炭粉、氧化铁等涂覆在铝箔上制成.由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收研究,并设计出相关实验流程图

已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如表所示:
回答下列问题:
(1)根据表数据判断步骤②依次析出沉淀Ⅱ_______ 和沉淀Ⅲ______ (填化学式),则pH1_________ pH2(填填“>”、“=”或“<”),控制两种沉淀析出可利用 _______ 。
A.pH试纸 B.石蕊指示剂 C.pH计
(2)已知溶解度:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O,则反应③的化学方程式是_________________________ .第③步反应后,过滤沉淀时需要的玻璃仪器有____ .若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因 _______ 、______ 。
(3)④中阳极反应产生的气体E为_______ ,验证该气体的试剂为 _________ 。
(4)试写出反应⑥的离子方程式____

已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如表所示:
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-33 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
回答下列问题:
(1)根据表数据判断步骤②依次析出沉淀Ⅱ
A.pH试纸 B.石蕊指示剂 C.pH计
(2)已知溶解度:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O,则反应③的化学方程式是
(3)④中阳极反应产生的气体E为
(4)试写出反应⑥的离子方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】(1)下列实验设计或操作合理的是_________________ 。
a. 中和热测定实验时,如果没有环形玻璃棒,可用环形铜质搅拌棒代替。
b. 实验室制肥皂时,将适量植物油、乙醇和NaOH溶液混合,并不断搅拌、加热,直到混合物变稠,即可得到肥皂。
c. 实验室制取乙烯时必须将温度计的水银球插入反应液中,测定反应液的温度。
d. 向Na2CO3与NaOH的混合溶液中加入足量的CaCl2溶液,再滴加几滴酚酞试液,可检验NaOH的存在。
e. 将10滴溴乙烷加入1 mL 10%的烧碱溶液中加热片刻后,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子。
(2)①取等体积、等物质的量浓度的盐酸和乙酸溶液分别与等量(足量)相同的锌反应,通过生成H2的快慢证明乙酸是弱酸。取用“相同”的锌的目的是_____________________________ ,比较生成H2快慢的方法是___________________________________________________ 。
②做溴乙烷水解实验时,不断振荡乙烷与NaOH溶液混合物的作用是____________________ ,溴乙烷已完全水解的现象是___________________ 。
a. 中和热测定实验时,如果没有环形玻璃棒,可用环形铜质搅拌棒代替。
b. 实验室制肥皂时,将适量植物油、乙醇和NaOH溶液混合,并不断搅拌、加热,直到混合物变稠,即可得到肥皂。
c. 实验室制取乙烯时必须将温度计的水银球插入反应液中,测定反应液的温度。
d. 向Na2CO3与NaOH的混合溶液中加入足量的CaCl2溶液,再滴加几滴酚酞试液,可检验NaOH的存在。
e. 将10滴溴乙烷加入1 mL 10%的烧碱溶液中加热片刻后,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子。
(2)①取等体积、等物质的量浓度的盐酸和乙酸溶液分别与等量(足量)相同的锌反应,通过生成H2的快慢证明乙酸是弱酸。取用“相同”的锌的目的是
②做溴乙烷水解实验时,不断振荡乙烷与NaOH溶液混合物的作用是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】探究SO2的某些性质.某兴趣小组设计了如图所示图实验装置。回答相关问题:
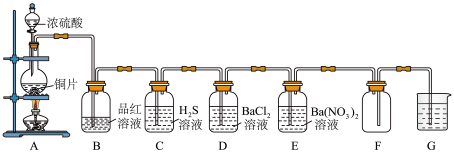
(1)A装置中用于滴加浓硫酸的仪器名称是_______________ 。
(2)当装置B中出现_______________ 的现象时,证明生成了SO2;若装置C中观察到淡黄色沉淀,说明SO2具有_______________ 性。
(3)装置G中盛放的试剂为_______________ (填标号)。
A.NaOH溶液B.硫酸C.Cu(NO3)2溶液
(4)装置D中无明显现象,装置E中产生白色沉淀,猜测该沉淀可能是_______________ ,理由是_______________ ,对应的离子方程式为_______________ 。

(1)A装置中用于滴加浓硫酸的仪器名称是
(2)当装置B中出现
(3)装置G中盛放的试剂为
A.NaOH溶液B.硫酸C.Cu(NO3)2溶液
(4)装置D中无明显现象,装置E中产生白色沉淀,猜测该沉淀可能是
您最近一年使用:0次



