某化学兴趣小组的同学学习了同周期元素性质的递变规律后,设计了一套实验方案进行实验探究,并记录了有关实验现象,如下表。
请你帮助该同学整理并完成实验报告。
(1)实验目的:__________________ 。
(2)实验仪器:①________ ;②________ ;③________ ;④试管夹;⑤镊子;⑥小刀;⑦玻璃片;⑧砂纸;⑨胶头滴管等。
(3)实验药品:钠、镁带、铝条、2 mol·L-1盐酸、新制的氯水、硫化氢饱和溶液、氯化铝溶液、氢氧化钠溶液等。
(4)请你写出上述的实验操作对应的现象(用A~F表示):①________ ;②________ ;③________ ;④________ ;⑤________ ;⑥________ 。
(4)写出实验操作②、⑥中有关反应的离子方程式:实验②__________ ,实验⑥___________ 。
(5)实验结论:__________________________ 。
| 实验操作 | 实验现象 |
| 1、用砂纸擦后的镁带与沸水反应,再向反应后溶液中滴加酚酞 | (A)浮于水面,熔成一个小球,在水面上无定向移动,随之消失,溶液变红色 (B)产生气体,可在空气中燃烧,溶液变成浅红色 (C)反应不十分强烈,产生的气体可以在空气中燃烧 (D)剧烈反应,产生可燃性气体 (E)生成白色胶状沉淀,进而沉淀消失 (F)生成淡黄色沉淀 |
| 2、向新制的H2S饱和溶液中滴加新制的氯水 | |
| 3、钠与滴有酚酞试液的冷水反应 | |
| 4、镁带与2 mol·L-1的盐酸反应 | |
| 5、铝条与2 mol·L-1的盐酸反应 | |
| 6、向AlCl3溶液滴加NaOH溶液至过量 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:
(2)实验仪器:①
(3)实验药品:钠、镁带、铝条、2 mol·L-1盐酸、新制的氯水、硫化氢饱和溶液、氯化铝溶液、氢氧化钠溶液等。
(4)请你写出上述的实验操作对应的现象(用A~F表示):①
(4)写出实验操作②、⑥中有关反应的离子方程式:实验②
(5)实验结论:
更新时间:2020-01-28 10:36:18
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】有A、B、C、D、E、F、G七种元素,试按下述所给的条件推断:
①A、B、C是同一周期的金属元素,已知原子核外有3个电子层,A的原子半径在所属周期中最大且原子半径A>B>C;
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,在室温时,D的单质是液体,E的单质是固体;
③F的单质在常温下是气体,性质很稳定,是除氢外最轻的气体;
④G是除氢外原子半径最小的元素。
(1)A的名称是_______ ,B位于周期表中第_______ 周期第_______ 族。
(2)E单质的颜色是_______________ 。
(3)A元素与D元素形成化合物的电子式是___________________________ 。
(4)G的单质与水反应的化学方程式是_______________________________ 。
(5)F的元素符号是_____________ 。
(6)在上述七种元素中,最高价氧化物对应的水化物碱性最强的化学式是_________ ,酸性最强的化学式是________ ,气态氢化物最稳定的化学式是_____________ 。
(7)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中反应的离子方程式是______________ 。
①A、B、C是同一周期的金属元素,已知原子核外有3个电子层,A的原子半径在所属周期中最大且原子半径A>B>C;
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,在室温时,D的单质是液体,E的单质是固体;
③F的单质在常温下是气体,性质很稳定,是除氢外最轻的气体;
④G是除氢外原子半径最小的元素。
(1)A的名称是
(2)E单质的颜色是
(3)A元素与D元素形成化合物的电子式是
(4)G的单质与水反应的化学方程式是
(5)F的元素符号是
(6)在上述七种元素中,最高价氧化物对应的水化物碱性最强的化学式是
(7)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中反应的离子方程式是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】为探究元素性质递变规律,设计如下实验。
(1)填写各实验步骤对应的实验现象(选填相应序号;不重复选)。
A.剧烈反应,迅速产生大量无色气体。
B.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色。
C.反应不十分剧烈;产生无色气体。
D.有气体产生,溶液变成浅红色。
(2)实验④:向1mL 1 mol/L AlCl3溶液中滴加2 mol/L NaOH溶液至过量,观察生成白色胶状沉淀,继而沉淀消失。
请用离子 方程式解释该实验现象: ________ 、 ________ 。
(3)实验⑤:在试管中加入3~5 mL Na2SiO3溶液,逐滴加入稀硫酸,边加边振荡。观察试管中出现白色凝胶。相应化学方程式:________ ,证明酸性:________ ﹥ (用化学式表示)。
(4)实验⑥:向新制得的Na2S溶液中滴加新制的氯水。观察试管中出现黄色沉淀。相应离子 方程式: ________ ,证明氧化性:________ ﹥ (用化学式表示)。
通过以上实验和讨论,推断钠、镁、铝的金属性逐渐________ (选填“增强”或“减弱”),硅、硫、氯的非金属性逐渐 ________ (选填“增强”或“减弱”)。
(1)填写各实验步骤对应的实验现象(选填相应序号;不重复选)。
实验序号 | 实验步骤 | 实验现象 |
① | 将一小块金属钠放入滴有酚酞溶液的冷水中。 | |
② | 将磨去表面氧化膜的一小段镁条放入试管中,加入2mL水,滴入2滴酚酞溶液,加热至水沸腾。 | |
③ | 将磨去表面氧化膜的一小段镁条投入2mL 1 mol/L盐酸中。 | |
④ | 将磨去表面氧化膜的一小片铝投入2mL 1 mol/L盐酸中。 | |
B.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色。
C.反应不十分剧烈;产生无色气体。
D.有气体产生,溶液变成浅红色。
(2)实验④:向1mL 1 mol/L AlCl3溶液中滴加2 mol/L NaOH溶液至过量,观察生成白色胶状沉淀,继而沉淀消失。
请用
(3)实验⑤:在试管中加入3~5 mL Na2SiO3溶液,逐滴加入稀硫酸,边加边振荡。观察试管中出现白色凝胶。相应化学方程式:
(4)实验⑥:向新制得的Na2S溶液中滴加新制的氯水。观察试管中出现黄色沉淀。相应
通过以上实验和讨论,推断钠、镁、铝的金属性逐渐
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】某校化学兴趣小组同学为探究元素周期律,设计了如下一系列实验。
Ⅰ.(1)将物质的量均为1 mol的钠、钾、镁、铝分别投入足量的0.1 mol/L的盐酸中,试预测实验结果:________ 与盐酸反应最剧烈,________ 与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合,反应生成NH3·H2O,从而验证NaOH的碱性强于NH3·H2O的碱性,继而可以验证Na的金属性强于N的金属性,你认为此设计是否合理,并说明理由_______ 。
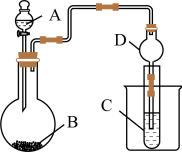
Ⅱ.利用如所示装置可以验证元素的非金属性的变化规律。______ ,D的作用是__________ 。
(4)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验,验证氯的非金属性强于硫的非金属性。装置A、B、C中所装药品分别为_________ 、_________ 、_________ ,装置C中的实验现象为有淡黄色沉淀生成,则反应的离子方程式为___________ 。
(5)若要证明非金属性C>Si,则A中应加入________ 溶液,B中应加入Na2CO3,C中应加入______ 溶液,装置C中的现象为________ 。
Ⅰ.(1)将物质的量均为1 mol的钠、钾、镁、铝分别投入足量的0.1 mol/L的盐酸中,试预测实验结果:
(2)将NaOH溶液与NH4Cl溶液混合,反应生成NH3·H2O,从而验证NaOH的碱性强于NH3·H2O的碱性,继而可以验证Na的金属性强于N的金属性,你认为此设计是否合理,并说明理由
Ⅱ.利用如所示装置可以验证元素的非金属性的变化规律。
已知:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,
MnCl2+Cl2↑+2H2O,
(4)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验,验证氯的非金属性强于硫的非金属性。装置A、B、C中所装药品分别为
(5)若要证明非金属性C>Si,则A中应加入
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】十种元素A~J在元素周期表中的相对位置如表所示:
回答下列问题:
(1)A、C元素组成的常见化合物分别为M和N,其中M含有18个电子。
①M的电子式为______ 。
②实验室制取N的化学方程式为______ 。
(2)元素C、H、J的最高价含氧酸的酸性从强到弱的顺序为______ (用相应酸的化学式表示)。
(3)不同价态的I元素可以相互转化,若反应前后存在4种价态的I元素,写出该反应的化学方程式:______ 。
(4)请用一个化学方程式证明元素D和E的非金属性强弱关系:______ 。
(5)某研究学习小组用如图装置探究F、G的金属性强弱。

当试管(Ⅰ)出现______ 的现象、且试管(Ⅱ)出现______ 的现象时,能说明金属性F大于G,写出试管(Ⅱ)依次发生反应的离子方程式:______ 、_____ 。
| 族 周期 | ⅠA | 0 | ||||||
| 1 | A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | B | C | D | E | ||||
| 3 | F | G | H | Ⅰ | J | |||
(1)A、C元素组成的常见化合物分别为M和N,其中M含有18个电子。
①M的电子式为
②实验室制取N的化学方程式为
(2)元素C、H、J的最高价含氧酸的酸性从强到弱的顺序为
(3)不同价态的I元素可以相互转化,若反应前后存在4种价态的I元素,写出该反应的化学方程式:
(4)请用一个化学方程式证明元素D和E的非金属性强弱关系:
(5)某研究学习小组用如图装置探究F、G的金属性强弱。

当试管(Ⅰ)出现
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某同学设计实验探究同主族碳、硅两元素的非金属性的强弱,根据要求完成下列问题:
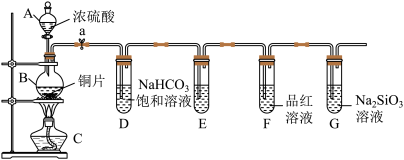
(1)填写所示仪器名称:A_______ ,B ______ 。
(2)铜与浓硫酸反应的化学方程式是____________________ 。
(3)装置E中足量酸性KMnO4溶液的作用是_________________ 。
(4)能说明碳元素的非金属性比硅元素非金属性强的实验现象是_________ 。
(5)依据试管D中实验现象,能否证明硫元素的非金属性强于碳元素的非金属性___ (填“能”或“否”),试管D中发生反应的离子方程式是____________ 。

(1)填写所示仪器名称:A
(2)铜与浓硫酸反应的化学方程式是
(3)装置E中足量酸性KMnO4溶液的作用是
(4)能说明碳元素的非金属性比硅元素非金属性强的实验现象是
(5)依据试管D中实验现象,能否证明硫元素的非金属性强于碳元素的非金属性
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】高一化学课外活动小组为探究元素周期表中元素性质的递变规律,设计了如下两组实验,装置如图:

Ⅰ.甲组同学利用该装置探究氯和碘两元素的非金属性强弱, 中加入浓盐酸,
中加入浓盐酸, 中盛放高锰酸钾固体。
中盛放高锰酸钾固体。
(1)仪器 的作用是
的作用是_______ 。
(2) 中试剂为碘化钾溶液,反应一段时间以后观察到
中试剂为碘化钾溶液,反应一段时间以后观察到 中溶液
中溶液_______ (填现象), 中发生反应的离子方程式为
中发生反应的离子方程式为_______ ,即可证明 的氧化性强于
的氧化性强于 。
。
(3)碘单质易升华属于_______ (填“物理”或“化学”)变化,碘升华过程破坏的作用力为_______ 。
(4)丙组同学负责纠错,发现该装置存在缺陷,如何改进_______ 。
Ⅱ.乙组同学利用该装置探究碳和硅的非金属性强弱。(已知硅酸是难溶于水的弱酸)
(1)乙组同学认为若要证明非金属性 ,则在
,则在 中加盐酸,
中加盐酸, 中加
中加 固体,
固体, 中加
中加 溶液。当装置
溶液。当装置 中有足量气体通入时,写出
中有足量气体通入时,写出 中发生反应的离子方程式
中发生反应的离子方程式_______ ,该反应可证明 酸性比
酸性比 酸性强。
酸性强。
(2)对乙组同学的实验,纠错小组丙组同学认为盐酸具有挥发性,可进入 中干扰实验,应在两装置间添加装有
中干扰实验,应在两装置间添加装有_______ 溶液的洗气瓶除去。
(3)对于上述实验有同学还得到非金属性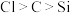 的结论,你认为该结论能否成立
的结论,你认为该结论能否成立_______ (填“能”或“否”),原因是_______ 。

Ⅰ.甲组同学利用该装置探究氯和碘两元素的非金属性强弱,
 中加入浓盐酸,
中加入浓盐酸, 中盛放高锰酸钾固体。
中盛放高锰酸钾固体。(1)仪器
 的作用是
的作用是(2)
 中试剂为碘化钾溶液,反应一段时间以后观察到
中试剂为碘化钾溶液,反应一段时间以后观察到 中溶液
中溶液 中发生反应的离子方程式为
中发生反应的离子方程式为 的氧化性强于
的氧化性强于 。
。(3)碘单质易升华属于
(4)丙组同学负责纠错,发现该装置存在缺陷,如何改进
Ⅱ.乙组同学利用该装置探究碳和硅的非金属性强弱。(已知硅酸是难溶于水的弱酸)
(1)乙组同学认为若要证明非金属性
 ,则在
,则在 中加盐酸,
中加盐酸, 中加
中加 固体,
固体, 中加
中加 溶液。当装置
溶液。当装置 中有足量气体通入时,写出
中有足量气体通入时,写出 中发生反应的离子方程式
中发生反应的离子方程式 酸性比
酸性比 酸性强。
酸性强。(2)对乙组同学的实验,纠错小组丙组同学认为盐酸具有挥发性,可进入
 中干扰实验,应在两装置间添加装有
中干扰实验,应在两装置间添加装有(3)对于上述实验有同学还得到非金属性
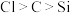 的结论,你认为该结论能否成立
的结论,你认为该结论能否成立
您最近一年使用:0次



