金属是现代生活和工业生产中应用极为普遍的一类材料。已知某金属粉末中除含有Al外还含有一定量的Fe和Cu,为证明Fe和Cu的存在并测定其中Al的质量分数,某化学兴趣小组的同学展开了如下的实验探究。小金查阅资料得Al与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气(反应的化学方程式为2Al+2H2O+2NaOH=2NaAlO2+3H2↑),Fe和Cu不与氢氧化钠溶液反应。
(1)请完成证明金属粉末中存在Fe和Cu的实验设计;为探究该金属粉末中Al的质量分数,取20g该金属粉末,加入氢氧化钠溶液反应,剩余固体质量与所加氢氧化钠溶液的质量关系如图所示,求:
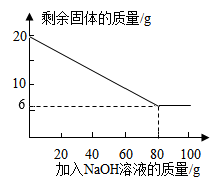
(2)该金属粉末中Al的质量分数为________ ;
(3)加入的NaOH溶液的溶质质量分数________ (结果精确到0.1%)。
| 实验操作 | 实验现象 | 结论 |
| Ⅰ取少量的金属粉末于试管中,加入足量的 | 有气泡产生 | 仅除去铝 |
| Ⅱ将试管静置,弃去上层清液,加入足量的稀硫酸 | 证明含有铁 | |
| Ⅲ将试管静置,弃去上层清液,多次洗涤剩余固体 | 剩余固体呈紫红色 | 证明含有铜 |
(1)请完成证明金属粉末中存在Fe和Cu的实验设计;为探究该金属粉末中Al的质量分数,取20g该金属粉末,加入氢氧化钠溶液反应,剩余固体质量与所加氢氧化钠溶液的质量关系如图所示,求:

(2)该金属粉末中Al的质量分数为
(3)加入的NaOH溶液的溶质质量分数
更新时间:2020-04-26 15:33:05
|
相似题推荐
解答题
|
较难
(0.4)
【推荐1】固体粉末由Mg、MgO和MgCO3中的一种或几种组成。小越同学为了探究该固体粉末的成分,取了1.8g样品,并设计如图所示的实验装置及如下所示方案:

①检查装置气密性,加入药品并连接仪器;
②打开分液漏斗活塞,将15%的稀硫酸缓缓注入锥形瓶中,使样品完全反应,量筒内共收集到112mL的水;
③拆下装置后,往锥形瓶内的溶液中注入足量氢氧化钠溶液,至沉淀完全,经过滤、洗涤和干燥后,称量沉淀质量;
(1)在步骤①中,向装置中加入的药品a是____________ 溶液;
(2)此实验条件下,氢气密度为0.09g/L,则样品中Mg的质量为____________ g(保留2位小数);
(3)在步骤③中,当沉淀质量大于____________ g时,说明样品中含有MgO(保留2位小数);
(4)强盛老师对实验进行反思,提出以下想法,其中正确的有____________ 。
A.实验前可通过样品的质量估算15%的稀硫酸的质量,确保样品完全反应
B.实验中可根据固体样品全部消失这一现象,来判断样品完全反应
C.根据上述实验方案,能计算出样品中各物质的质量

①检查装置气密性,加入药品并连接仪器;
②打开分液漏斗活塞,将15%的稀硫酸缓缓注入锥形瓶中,使样品完全反应,量筒内共收集到112mL的水;
③拆下装置后,往锥形瓶内的溶液中注入足量氢氧化钠溶液,至沉淀完全,经过滤、洗涤和干燥后,称量沉淀质量;
(1)在步骤①中,向装置中加入的药品a是
(2)此实验条件下,氢气密度为0.09g/L,则样品中Mg的质量为
(3)在步骤③中,当沉淀质量大于
(4)强盛老师对实验进行反思,提出以下想法,其中正确的有
A.实验前可通过样品的质量估算15%的稀硫酸的质量,确保样品完全反应
B.实验中可根据固体样品全部消失这一现象,来判断样品完全反应
C.根据上述实验方案,能计算出样品中各物质的质量
您最近一年使用:0次
解答题
|
较难
(0.4)
【推荐2】某科学兴趣小组开展综合实践活动。参观电镀工厂并对镀铜液中的相关成分进行检测。
(1)若要通过置换反应在某铁块表面镀上一层铜,可以选择Cu(NO3)2溶液和CuO中的___________ 。
(2)镀铜的液体是以稀硫酸、硫酸铜为原料按一定比例配制而成。兴趣小组同学用如下方法测定二者的比例:取镀铜液于烧杯中,取300克的NaOH溶液,平均分三次滴入烧杯中,将每次所得沉淀过滤、洗涤、烘干、称量。三次实验数据见下表:
①第2次实验生成9.80克沉淀的过程中,有多少NaOH溶质参加反应_________ ?
②请算出镀铜液中硫酸溶质与硫酸铜溶质的质量比________ 。
(1)若要通过置换反应在某铁块表面镀上一层铜,可以选择Cu(NO3)2溶液和CuO中的
(2)镀铜的液体是以稀硫酸、硫酸铜为原料按一定比例配制而成。兴趣小组同学用如下方法测定二者的比例:取镀铜液于烧杯中,取300克的NaOH溶液,平均分三次滴入烧杯中,将每次所得沉淀过滤、洗涤、烘干、称量。三次实验数据见下表:
| 实验序号 | NaOH溶液/g | 沉淀质量/g |
| 1 | 100 | 4.90 |
| 2 | 100 | 9.80 |
| 3 | 100 | 4.90 |
①第2次实验生成9.80克沉淀的过程中,有多少NaOH溶质参加反应
②请算出镀铜液中硫酸溶质与硫酸铜溶质的质量比
您最近一年使用:0次
解答题
|
较难
(0.4)
【推荐1】建筑工程制图时,需要亮绿色的K3[Fe(C2O4)3]-3H2O(三草酸合铁酸钾)晶体做感光剂,这种晶体在一定温度下才会分解,为了探究三草酸合铁酸钾的热分解产物,用如图装置进行实验
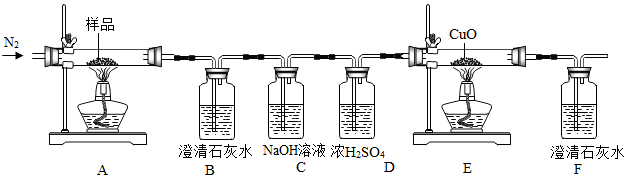
(1)C装置的作用是_____ ;
(2)反应后将A中固体溶于水,过滤得到的红棕色固体和无色溶液,在无色溶液中加盐酸产生气泡,检测无色滤液可能含_____ ;
(3)三草酸合铁酸钾的分解产物有_____ ;
(4)从实验安全角度考虑,图示装置还应采取的改进装置措施是_____ 。
| 步骤 | 观察 | 现象 |
| 1 | 装置A | 亮绿色晶体变红色和白色固体,玻璃管壁上有小水珠 |
| 2 | 装置BF | 澄清石灰水变浑浊 |
| 3 | 装置E | 固体变红色 |

(1)C装置的作用是
(2)反应后将A中固体溶于水,过滤得到的红棕色固体和无色溶液,在无色溶液中加盐酸产生气泡,检测无色滤液可能含
(3)三草酸合铁酸钾的分解产物有
(4)从实验安全角度考虑,图示装置还应采取的改进装置措施是
您最近一年使用:0次
解答题
|
较难
(0.4)
【推荐2】小科用如图装置来探究炼铁的反应原理,称取10g赤铁矿样品(主要成分为Fe2O3,杂质不含Fe元素且不与酸反应),铺开在硬质玻璃管中,充分加热至样品完全反应(化学方程式为: ),熄灭酒精喷灯,继续通入CO至硬质玻璃管冷却,将反应后的固体酸洗(除去反应生成的Fe)、干燥,称量剩余固体杂质的质量为2g。
),熄灭酒精喷灯,继续通入CO至硬质玻璃管冷却,将反应后的固体酸洗(除去反应生成的Fe)、干燥,称量剩余固体杂质的质量为2g。

(1)已知发生装置得到的CO气体中混有杂质CO2和H2O,则A装置的作用是______ 。
(2)从环保角度考虑,请写出一种尾气处理方法______ 。
(3)请计算样品中铁元素的质量。(写出计算过程)______
 ),熄灭酒精喷灯,继续通入CO至硬质玻璃管冷却,将反应后的固体酸洗(除去反应生成的Fe)、干燥,称量剩余固体杂质的质量为2g。
),熄灭酒精喷灯,继续通入CO至硬质玻璃管冷却,将反应后的固体酸洗(除去反应生成的Fe)、干燥,称量剩余固体杂质的质量为2g。
(1)已知发生装置得到的CO气体中混有杂质CO2和H2O,则A装置的作用是
(2)从环保角度考虑,请写出一种尾气处理方法
(3)请计算样品中铁元素的质量。(写出计算过程)
您最近一年使用:0次
解答题
|
较难
(0.4)
【推荐3】某同学为了测定由两种元素形成的气态化合物X的组成,做了如图所示的实验。他把气体X由注射器A缓慢送入装有CuO的B装置,使之完全反应,得到如下结果(不考虑装置中的空气):
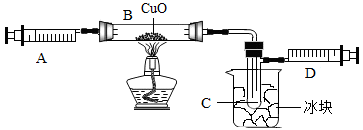
①实验前B管及药品的质量为21.32克,实验后为21.16克。
②C管收集到的液体物质经电解后可以得到H2和O2。
③在D中收集到约为0.09克的N2。
根据上述实验结果分析,回答下列问题:
(1)B管反应前后减小了0.16g,这是________ 的质量,B管中的实验现象为________ 。
(2)C中收集到的液体名称及质量分别是________ 。
(3)根据该实验数据,得出气态化合物X币各元素的质量比约为________ 。

①实验前B管及药品的质量为21.32克,实验后为21.16克。
②C管收集到的液体物质经电解后可以得到H2和O2。
③在D中收集到约为0.09克的N2。
根据上述实验结果分析,回答下列问题:
(1)B管反应前后减小了0.16g,这是
(2)C中收集到的液体名称及质量分别是
(3)根据该实验数据,得出气态化合物X币各元素的质量比约为
您最近一年使用:0次
解答题
|
较难
(0.4)
【推荐1】“双吸剂”是一种常见袋装食品的保鲜剂,能吸收空气中的氧气、二氧化碳、水蒸气等。某包“双吸剂”标签如图所示。某科学兴趣小组通过定性探究,发现这包久置的“双吸剂”固体样品中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3的几种或全部。为进一步确定这包久置的“双吸剂”固体的成分,进行如下定量实验∶取3g样品研碎,并用磁铁充分吸引后,得到剩余固体2.6 g,按照下图流程进行实验。


请回答相关问题∶
(1)铁粉的质量是___________ g。
(2)操作二名称是___________ 。
(3)根据实验数据计算判断,固体I的成分是否同时含有Fe2O3和CaCO3?___________ (填“是”或“否”)。
(4)烧杯C中溶液的溶质为___________ 。
(5)依据有关实验数据判断,这包久置“双吸剂”固体的成分中一定含有Ca(OH)2,是否同时含有CaO?___________ (填“是”或“否”)。


请回答相关问题∶
(1)铁粉的质量是
(2)操作二名称是
(3)根据实验数据计算判断,固体I的成分是否同时含有Fe2O3和CaCO3?
(4)烧杯C中溶液的溶质为
(5)依据有关实验数据判断,这包久置“双吸剂”固体的成分中一定含有Ca(OH)2,是否同时含有CaO?
您最近一年使用:0次
解答题
|
较难
(0.4)
【推荐2】取含杂质的硫酸镁样品14g(杂质不溶于水,也不参加反应),向其中加入一定量的氢氧化钠溶液(密度为1.06g/cm3),恰好完全反应,得到沉淀和 71 g 溶质质量分数为 5%的溶液。计算:
(1)样品中硫酸镁的质量_______ ;
(2)所加入的氢氧化钠溶液中溶质的质量分数_______ (计算结果精确至0.1%);
(3)所加入的氢氧化钠溶液的体积_______ (计算结果精确至0.1)。
(1)样品中硫酸镁的质量
(2)所加入的氢氧化钠溶液中溶质的质量分数
(3)所加入的氢氧化钠溶液的体积
您最近一年使用:0次




