小华在做实验时,不小心将镁条掉到碳酸钠溶液中,发现产生大量的气泡和白色不溶物。他非常好奇,和同学们一起进行了如下的探究。
【问题一】镁条与碳酸钠溶液反应产生的气体是什么?
【作出猜想】猜想1:可能是二氧化碳; 猜想2:可能是氢气。
【问题二】镁条与碳酸钠溶液反应产生的白色不溶物是什么?
【查阅资料】
①Mg(OH)2难溶于水,MgCO3微溶于水,它们受热都会分解成两种氧化物;
②白色的无水硫酸铜遇水变蓝色。
【作出猜想】甲同学猜想:是Mg(OH)2;
乙同学猜想:是MgCO3;
丙同学猜想:是Mg(OH)2和MgCO3的混合物。
【进行实验】取白色不溶物放入试管中,滴加足量的稀盐酸,观察到有气泡产生,得出甲同学的猜想不正确。小明通过进一步实验得出丙同学的猜想正确。他的实验操作及现象是______ 。
【问题三】镁条与碳酸钠溶液反应快速产生大量气泡的原因是什么?
【查阅资料】Na2CO3溶液中除Na+、CO32-外,还有OH—;镁条与水能缓慢反应生成H2。
【作出猜想】可能是Na+、CO32-、OH-中的某一种离子促进了镁与水的反应。
【进行实验】按如图所示方案进行实验。发现只有A中产生气泡较快,而B、C中产生气泡很缓慢。

(1)试剂X是________ 。
(2)该实验说明是________ 促进了镁与水的反应。
【问题一】镁条与碳酸钠溶液反应产生的气体是什么?
【作出猜想】猜想1:可能是二氧化碳; 猜想2:可能是氢气。
【问题二】镁条与碳酸钠溶液反应产生的白色不溶物是什么?
【查阅资料】
①Mg(OH)2难溶于水,MgCO3微溶于水,它们受热都会分解成两种氧化物;
②白色的无水硫酸铜遇水变蓝色。
【作出猜想】甲同学猜想:是Mg(OH)2;
乙同学猜想:是MgCO3;
丙同学猜想:是Mg(OH)2和MgCO3的混合物。
【进行实验】取白色不溶物放入试管中,滴加足量的稀盐酸,观察到有气泡产生,得出甲同学的猜想不正确。小明通过进一步实验得出丙同学的猜想正确。他的实验操作及现象是
【问题三】镁条与碳酸钠溶液反应快速产生大量气泡的原因是什么?
【查阅资料】Na2CO3溶液中除Na+、CO32-外,还有OH—;镁条与水能缓慢反应生成H2。
【作出猜想】可能是Na+、CO32-、OH-中的某一种离子促进了镁与水的反应。
【进行实验】按如图所示方案进行实验。发现只有A中产生气泡较快,而B、C中产生气泡很缓慢。

(1)试剂X是
(2)该实验说明是
更新时间:2023-12-04 22:05:28
|
相似题推荐
探究题
|
适中
(0.65)
【推荐1】小凤和小凯在做“金属与酸反应”的实验时,分别将镁条投入盛有稀盐酸的试管中,小凤加入少量镁条,而小凯加入了足量镁条。一段时间后,小凯的试管底部“意外”地出现了灰白色固体。为探究该固体是什么物质,他们开展了如下探究:
【提出问题】足量镁和稀盐酸反应生成的灰白色固体是什么?
【查阅资料】①氢氧化镁和碱式氯化镁 都难溶于水,但都能与稀硝酸反应,后者能生成
都难溶于水,但都能与稀硝酸反应,后者能生成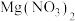 和HCl。②碱式氯化镁受热易分解产生氯化氢气体。
和HCl。②碱式氯化镁受热易分解产生氯化氢气体。
【建立假设】假设1:未溶解的氯化镁;假设2:氢氧化镁;假设3:碱式氯化镁;
【进行实验】将灰白色固体过滤、充分洗涤后进行如下实验:(请完成以下实验记录)
【评价交流】小凤认为该灰白色固体一定是碱式氯化镁。小凯认为上述探究还不足以说明该固体只有碱式氯化镁,可能是氢氧化镁和碱式氯化镁的混合物,需要进一步计算证明。小凯取灰白色固体m克用于实验,请你帮他写出实验思路:___________ 。
【提出问题】足量镁和稀盐酸反应生成的灰白色固体是什么?
【查阅资料】①氢氧化镁和碱式氯化镁
 都难溶于水,但都能与稀硝酸反应,后者能生成
都难溶于水,但都能与稀硝酸反应,后者能生成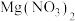 和HCl。②碱式氯化镁受热易分解产生氯化氢气体。
和HCl。②碱式氯化镁受热易分解产生氯化氢气体。【建立假设】假设1:未溶解的氯化镁;假设2:氢氧化镁;假设3:碱式氯化镁;
【进行实验】将灰白色固体过滤、充分洗涤后进行如下实验:(请完成以下实验记录)
| 序号 | 实验操作 | 实验现象 | 实验结论 |
| 实验一 | 取灰白色固体于试管中,加入足量蒸馏水,充分振荡 | 固体不溶解 | 假设1 |
| 实验二 | 取灰白色固体于试管中,加入足量稀硝酸,充分振荡 | 固体溶解 | 假设2不成立 |
| 往上述溶液中滴加硝酸银溶液 | |||
| 实验三 | 取少量灰白色沉淀于试管中加热,并将湿润的蓝色石蕊试纸悬于试管口 | 假设3成立 |
【评价交流】小凤认为该灰白色固体一定是碱式氯化镁。小凯认为上述探究还不足以说明该固体只有碱式氯化镁,可能是氢氧化镁和碱式氯化镁的混合物,需要进一步计算证明。小凯取灰白色固体m克用于实验,请你帮他写出实验思路:
您最近一年使用:0次
探究题
|
适中
(0.65)
名校
【推荐2】工业上用电解饱和食盐水的方法制备烧碱,小乐对用此方法生产的、外包装破损的烧碱样品进行了如下探究。
【提出问题】烧碱样品中含有哪些杂质?
【建立猜想】猜想1:可能含有碳酸钠,依据是氢氧化钠能和二氧化碳反应生成碳酸钠。
猜想2:可能含有氯化钠,依据是在化工生产中,原料可能__________________ 。
【实验探究】
【反思评价】除去烧碱样品中含有的少量碳酸钠,可选用的药品是____________ 。
A.CuCl2溶液 B.Ba(NO3)2溶液 C.Ba(OH)2溶液 D.KOH溶液
【提出问题】烧碱样品中含有哪些杂质?
【建立猜想】猜想1:可能含有碳酸钠,依据是氢氧化钠能和二氧化碳反应生成碳酸钠。
猜想2:可能含有氯化钠,依据是在化工生产中,原料可能
【实验探究】
| 实验操作 | 实验现象 | 实验结论 |
| 取少量烧碱样品于试管中,加适量水溶解,加入过量的稀硝酸,再滴加少量硝酸银溶液 | 烧碱样品中含碳酸钠和氯化钠 |
A.CuCl2溶液 B.Ba(NO3)2溶液 C.Ba(OH)2溶液 D.KOH溶液
您最近一年使用:0次
探究题
|
适中
(0.65)
【推荐3】(1)请根据下列实验装置图回答有关问题:

①仪器a的名称:_______ ,制取较纯净的氢气可选用的发生装置和收集装置是_____ (填字母)实验室制取氢气的化学反应方程式为______ 。
②实验室若用A作为氧气的发生装置,请写出一个对应的化学方程式_______ ;用C装置收集氧气的验满方法______ 。
③如下图所示,在白色点滴板1~6的孔穴中,分别滴加2滴紫色石蕊溶液。

(I)孔穴6中溶液变为蓝色,说明碳酸钠溶液显_______ (填“酸性”或“碱性”)。
(II)溶液变为红色的孔穴有_____ (填孔穴序号,下同)。
(III)作为空白对照实验的孔穴是______ 。
(2)(I)下图是两个实验小组分别进行“加热硫酸铜和氢氧化钠溶液反应后生成物”的实验过程示意图:

【甲组】氢氧化钠与硫酸铜反应的化学方程式为:_______ 加热后产生黑色的氧化铜。
【乙组】为寻找实验中没有产生氧化铜的原因,他们进行了以下实验探究:
【查阅资料】在酸性条件下,氢氧化钠与硫酸铜在溶液中可发生如下反应:
 ,生成的碱式硫酸铜是不溶于水的蓝白色固体,加热不易发生分解。
,生成的碱式硫酸铜是不溶于水的蓝白色固体,加热不易发生分解。
【提出猜想】根据资料分析,同学们针对试管中溶液呈酸性的原因作出以下猜想:
猜想I:硫酸铜溶液呈酸性; 猜想II:生成的硫酸钠使溶液呈酸性。
【实验与结论】实验①:用pH试纸测定硫酸铜溶液的酸碱度,得出其pH______ 7(填“>”、“<”或“=”),硫酸铜溶液呈酸性,猜想I成立。
实验②:向盛有硫酸钠溶液的试管中逐滴加石蕊溶液,观察到溶液显紫色,硫酸钠溶液呈_______ (填“酸”、“中”或“碱”)性,猜想II不成立。
【交流和反思】(1)乙组同学认真分析甲组实验后,一致认为不需要通过实验就能判断猜想II不成立,理由是________ 。
(2)在化学反应中,相同的反应物因质量比不同可能会导致生成物不同,请另举一列______ (写出反应物即可)

①仪器a的名称:
②实验室若用A作为氧气的发生装置,请写出一个对应的化学方程式
③如下图所示,在白色点滴板1~6的孔穴中,分别滴加2滴紫色石蕊溶液。

(I)孔穴6中溶液变为蓝色,说明碳酸钠溶液显
(II)溶液变为红色的孔穴有
(III)作为空白对照实验的孔穴是
(2)(I)下图是两个实验小组分别进行“加热硫酸铜和氢氧化钠溶液反应后生成物”的实验过程示意图:

【甲组】氢氧化钠与硫酸铜反应的化学方程式为:
【乙组】为寻找实验中没有产生氧化铜的原因,他们进行了以下实验探究:
【查阅资料】在酸性条件下,氢氧化钠与硫酸铜在溶液中可发生如下反应:
 ,生成的碱式硫酸铜是不溶于水的蓝白色固体,加热不易发生分解。
,生成的碱式硫酸铜是不溶于水的蓝白色固体,加热不易发生分解。【提出猜想】根据资料分析,同学们针对试管中溶液呈酸性的原因作出以下猜想:
猜想I:硫酸铜溶液呈酸性; 猜想II:生成的硫酸钠使溶液呈酸性。
【实验与结论】实验①:用pH试纸测定硫酸铜溶液的酸碱度,得出其pH
实验②:向盛有硫酸钠溶液的试管中逐滴加石蕊溶液,观察到溶液显紫色,硫酸钠溶液呈
【交流和反思】(1)乙组同学认真分析甲组实验后,一致认为不需要通过实验就能判断猜想II不成立,理由是
(2)在化学反应中,相同的反应物因质量比不同可能会导致生成物不同,请另举一列
您最近一年使用:0次
探究题
|
适中
(0.65)
真题
名校
【推荐1】小明发现某食品包装袋中有一个小袋,上面标有“成分:生石灰、铁粉;作用:防潮、防氧化”等字样。他想了解袋内粉末是否已失效,取少量粉末在水中充分溶解,滴入无色酚酞发现不变色。通过查阅资料获知,常温下铁在空气中不能反应生成Fe3O4和FeO。于是对粉末成分做出如下猜想:
猜想一:可能是CaCO3和Fe。
猜想二:可能是CaCO3和Fe2O3。
猜想三:可能是____ 。
【实验设计】小明设计了下图所示的实验
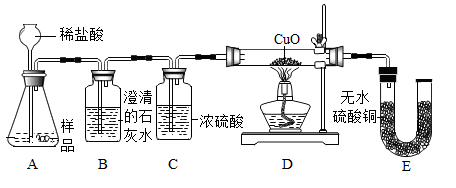
【实验与分析】
(1)向A装置中加入稀盐酸,B装置中出现浑浊现象,证明样品中含有CaCO3。
(2)若粉末中含有Fe,装置E中应观察到的现象是____ 。
【实验与分析】
上述实验中,如果将E装置去掉,是否还能验证粉末中含有Fe,请说明理由____ 。
猜想一:可能是CaCO3和Fe。
猜想二:可能是CaCO3和Fe2O3。
猜想三:可能是
【实验设计】小明设计了下图所示的实验

【实验与分析】
(1)向A装置中加入稀盐酸,B装置中出现浑浊现象,证明样品中含有CaCO3。
(2)若粉末中含有Fe,装置E中应观察到的现象是
【实验与分析】
上述实验中,如果将E装置去掉,是否还能验证粉末中含有Fe,请说明理由
您最近一年使用:0次
探究题
|
适中
(0.65)
【推荐2】小思同学在实验室用大理石和稀盐酸反应制取二氧化碳完毕后,对废液中溶质的成分产生了兴趣。请你一同参与探究并回答下列问题:
【提出问题】废液中的溶质是什么物质?
【作出猜想】小思同学认为废液中溶质只有氯化钙。
你认为还可能有的溶质是______① ______(填化学式)。
【查阅资料】氯化钙溶液呈中性。
【实验与结论】(1)小思同学取少量废液与试管中,滴入几滴无色酚酞试液后,酚酞不变色。于是小思同学认为自己的猜想是正确的。
(2)你认为小思同学的实验不能证明他的猜想,理由是_________② _ __。
(3)如果要证明你的猜想是正确的,你选择的试剂是_③__。
A 石蕊 B 酚酞 C Na2CO3 D NaOH
【拓展与应用】(1)实验证明你的猜想是正确的。要想处理废液只得到氯化钙溶液,应向废液中加足量或过量的( ④ )A.Na2CO3 B.CaCO3
(2)通过以上探究,如果该废液未经处理直接倒入下水道,可能造成的危害___⑤__(写一条)。
【交流与反思】在分析化学反应后所得物质的成分时,除了考虑生成物外,还需要考虑反应物是否剩余(环境污染问题)。
【提出问题】废液中的溶质是什么物质?
【作出猜想】小思同学认为废液中溶质只有氯化钙。
你认为还可能有的溶质是______① ______(填化学式)。
【查阅资料】氯化钙溶液呈中性。
【实验与结论】(1)小思同学取少量废液与试管中,滴入几滴无色酚酞试液后,酚酞不变色。于是小思同学认为自己的猜想是正确的。
(2)你认为小思同学的实验不能证明他的猜想,理由是_________② _ __。
(3)如果要证明你的猜想是正确的,你选择的试剂是_③__。
A 石蕊 B 酚酞 C Na2CO3 D NaOH
【拓展与应用】(1)实验证明你的猜想是正确的。要想处理废液只得到氯化钙溶液,应向废液中加足量或过量的( ④ )A.Na2CO3 B.CaCO3
(2)通过以上探究,如果该废液未经处理直接倒入下水道,可能造成的危害___⑤__(写一条)。
【交流与反思】在分析化学反应后所得物质的成分时,除了考虑生成物外,还需要考虑反应物是否剩余(环境污染问题)。
您最近一年使用:0次
探究题
|
适中
(0.65)
【推荐3】科学兴趣小组通过学习知道铜和稀硫酸反应,却发现铜片在加热的条件下可以与浓硫酸反应,铜片溶解,产生气泡并闻到刺激性气味,溶液呈蓝色,于是进行了以下实验探究:
【提出问题】蓝色溶液的溶质是什么?
【提出猜想】猜想一:CuSO4;猜想二:CuSO4和H2SO4。
【进行实验】取一定量反应后的溶液进行稀释,并分装在A、B两支试管中,然后进行下列实验,并完成如表:
【探究结论】通过实验,猜想二正确。
(2)写出步骤二中所发生反应的化学方程式:____ 、____ 。
【反思评价】同学们设计制取硫酸铜的两种方案。
方案一:铜和浓硫酸反应方程式:
方案二:通过以下流程:
(3)以环保角度,大家认为工业上不适宜用铜和浓硫酸反应来大量制取硫酸铜,理由是____ 。
【提出问题】蓝色溶液的溶质是什么?
【提出猜想】猜想一:CuSO4;猜想二:CuSO4和H2SO4。
【进行实验】取一定量反应后的溶液进行稀释,并分装在A、B两支试管中,然后进行下列实验,并完成如表:
| 步骤 | 实验操作 | 实验现象 | 实验结论 |
| 步骤一 | 在试管A中加入少量的CuO粉末 | (1) | 溶液中含有H2SO4 |
| 步骤二 | 在试管B中加入过量的NaOH溶液 | 产生蓝色沉淀 | 溶液中含有CuSO4 |
【探究结论】通过实验,猜想二正确。
(2)写出步骤二中所发生反应的化学方程式:
【反思评价】同学们设计制取硫酸铜的两种方案。
方案一:铜和浓硫酸反应方程式:

方案二:通过以下流程:

(3)以环保角度,大家认为工业上不适宜用铜和浓硫酸反应来大量制取硫酸铜,理由是
您最近一年使用:0次



