怎样解实验类计算题
全国
九年级
专题练习
2019-09-15
249次
整体难度:
适中
考查范围:
物质的化学变化、身边的化学物质、物质构成的奥秘、化学实验
怎样解实验类计算题
全国
九年级
专题练习
2019-09-15
249次
整体难度:
适中
考查范围:
物质的化学变化、身边的化学物质、物质构成的奥秘、化学实验
一、填空与简答 添加题型下试题
填空与简答-填空题
|
较难(0.4)
1. 某同学为测定12g含杂质的氧化铁样品中氧化铁的质量分数,利用稀硫酸和锌粒制取氢气,设计了下图所示的装置,进行有关的实验探究(提示:3H2+Fe2O3 2Fe+3H2O杂质不参加反应,假定每步均完全反应或吸收).请回答有关问题:
2Fe+3H2O杂质不参加反应,假定每步均完全反应或吸收).请回答有关问题:
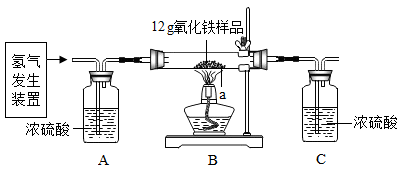
得到如下数据:
(1)请计算样品中氧化铁的质量分数.(写出计算步骤,计算结果精确到0.l%)_______
(2)该实验还可测定组成水的各元素之间的质量关系,请用表中实验数据列式表示出水中氢、氧元素的质量比为_____________________________________________________________________ (不用化简);若玻璃管中的氧化铁没有完全反应,则求得水中氢、氧元素的质量比会________ (选填“偏大”、“偏小”或“不变”).
 2Fe+3H2O杂质不参加反应,假定每步均完全反应或吸收).请回答有关问题:
2Fe+3H2O杂质不参加反应,假定每步均完全反应或吸收).请回答有关问题:
得到如下数据:
| 装置 | B | C |
| 反应前质量 | 86.3g | 284.2g |
| 反应后质量 | 83.9g | 286.9g |
(1)请计算样品中氧化铁的质量分数.(写出计算步骤,计算结果精确到0.l%)
(2)该实验还可测定组成水的各元素之间的质量关系,请用表中实验数据列式表示出水中氢、氧元素的质量比为
您最近一年使用:0次
二、计算题 添加题型下试题
计算题
|
较难(0.4)
真题
2. 将一定质量的甲烷和一氧化碳的混合气体在足量的氧气中充分燃烧,将生成物依次通入盛有足量浓硫酸和氢氧化钠溶液的洗气瓶,实验测得装有浓硫酸的洗气瓶增重5.4克,装有氢氧化钠溶液的洗气瓶增重8.8克。试计算:
(1)混合气体中甲烷的质量(写出完整的计算过程)________
(2)混合气体中甲烷和一氧化碳的质量之比为______,混合气体中碳、氢、氧三种元素的质量之比为_________。
(1)混合气体中甲烷的质量(写出完整的计算过程)________
(2)混合气体中甲烷和一氧化碳的质量之比为______,混合气体中碳、氢、氧三种元素的质量之比为_________。
您最近一年使用:0次
2014-07-01更新
|
1143次组卷
|
4卷引用:2014年初中毕业升学考试(内蒙古呼和浩特市)化学
三、综合应用题 添加题型下试题
综合应用题
|
较难(0.4)
3. 汉墓出土青铜器表面一些有绿色物质,该物质俗称“铜绿”,其化学组成为 。小明同学研究该物质时做了下列实验。
。小明同学研究该物质时做了下列实验。
【实验一】取2.22g“铜绿”固体,向其中加入足量的7.3%的稀盐酸,使固体完全溶解。反应方程式为: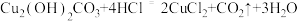 ,试求参加反应的稀盐酸的质量
,试求参加反应的稀盐酸的质量____ 。
【实验二】(1)另取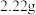 “铜绿”固体加热使其分解,绘制出固体的质量随温度的变化关系图。如图所示到
“铜绿”固体加热使其分解,绘制出固体的质量随温度的变化关系图。如图所示到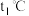 时全部变为黑色固体,则此过程中生成的二氧化碳和水的总质量为
时全部变为黑色固体,则此过程中生成的二氧化碳和水的总质量为_____ g。
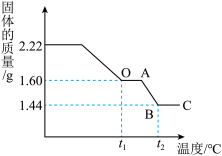
(2)根据上图,计算并推理出升温到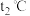 后,BC段残留固体的合理化学式
后,BC段残留固体的合理化学式_____ (要求有计算过程)。
 。小明同学研究该物质时做了下列实验。
。小明同学研究该物质时做了下列实验。【实验一】取2.22g“铜绿”固体,向其中加入足量的7.3%的稀盐酸,使固体完全溶解。反应方程式为:
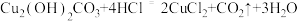 ,试求参加反应的稀盐酸的质量
,试求参加反应的稀盐酸的质量【实验二】(1)另取
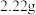 “铜绿”固体加热使其分解,绘制出固体的质量随温度的变化关系图。如图所示到
“铜绿”固体加热使其分解,绘制出固体的质量随温度的变化关系图。如图所示到 时全部变为黑色固体,则此过程中生成的二氧化碳和水的总质量为
时全部变为黑色固体,则此过程中生成的二氧化碳和水的总质量为
(2)根据上图,计算并推理出升温到
 后,BC段残留固体的合理化学式
后,BC段残留固体的合理化学式
您最近一年使用:0次
综合应用题
|
困难(0.15)
4. 某实验小组为测定铜和氧化铜混合物中氧化铜的质量分数,设计了用干燥纯净的氢气还原氧化铜的实验,所需实验装置如图所示,回答下列问题:
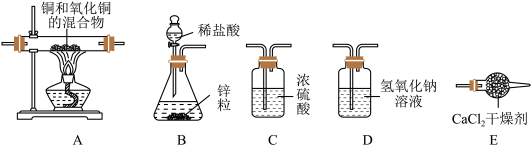
(1)将上图连接成整套装置,连接顺序依次为
____ 
____ 
____  (填写字母)。
(填写字母)。
(2)A装置中实验前混合物质量为2.5g,实验后的剩余固体质量为2.1g,则混合物中氧化铜的质量分数为_____ 。
(3)某同学用 装置增加的质量来计算混合物中氧化铜的质量分数,计算的结果会
装置增加的质量来计算混合物中氧化铜的质量分数,计算的结果会____ 。(填“增大”、“减少”或“不变”)

(1)将上图连接成整套装置,连接顺序依次为
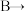


 (填写字母)。
(填写字母)。(2)A装置中实验前混合物质量为2.5g,实验后的剩余固体质量为2.1g,则混合物中氧化铜的质量分数为
(3)某同学用
 装置增加的质量来计算混合物中氧化铜的质量分数,计算的结果会
装置增加的质量来计算混合物中氧化铜的质量分数,计算的结果会
您最近一年使用:0次
四、选择题 添加题型下试题
选择题-单选题
|
适中(0.65)
名校
解题方法
5. 有CO、CO2和N2的混合气体120g,其中碳元素的质量分数为20%。使该混合气体与足量的灼热氧化铜完全反应,再将气体通入过量的澄清石灰水中,充分反应后得到白色沉淀的质量为
| A.50 g | B.100 g | C.150 g | D.200 g |
您最近一年使用:0次
2019-12-14更新
|
497次组卷
|
35卷引用:2015届山东省济南市槐荫中学初三上学期期末化学试卷
2015届山东省济南市槐荫中学初三上学期期末化学试卷2015届江苏省泰兴市实验初级中学九年级下学期第一次月度检测化学试卷2015届江苏省无锡市南长区九年级第一次模拟考试化学试卷2017届山东省莒北五校联盟九年级下学期初中学业水平模拟试题(一 )化学试卷四川省仁寿县2017届九年级中考适应性考试化学试题2017年秋人教版九年级上册化学:第六单元 碳和碳的氧化物-单元清检测广东省2019届九年级化学第六单元测试题江苏省南通市八一中学2018届九年级上学期第三次月考化学试题【校级联考】山东省日照市五莲县2019届九年级上学期期末考试化学试题山东省五莲县2019届九年级上学期期末考试化学试题四川省成都外国语学校2019届九年级下学期中考一诊化学试题四川省眉山市仁寿县华兴联谊学校2019届九年级下学期中考二模考试化学试题怎样解实验类计算题湖北省孝感市汉川市官备塘中学2018-2019学年九年级上学期期末化学试题江苏省无锡市前洲中学2019-2020学年九年级上学期12月学科竞赛化学试题(已下线)【万唯原创】2018年河南省中考化学逆袭卷特训三(已下线)【万唯原创】2017年河南省中考化学红绿蓝青卷-红卷(已下线)【万唯原创】2018年河南省中考化学面对面卷九年级专题二湖南省岳阳市岳阳县八校2020-2021学年九年级上学期第三次联考化学试题河北省张家口市怀安县2020-2021学年九年级上学期期末化学试题四川省雅安市2020-2021学年九年级上学期期末化学试题广西南宁市2020-2021学年九年级上学期期末化学试题江苏省盐城市盐都区郭猛实验学校2020-2021学年九年级下学期第一次月考化学试题黑龙江省大庆市林甸县2019-2020学年九年级上学期期末化学试题四川省成都市金牛区成都外国语学校2018-2019学年九年级下学期入学考试化学试题山东省菏泽市曹县致远实验学校2021-2022学年九年级上学期10月月考化学试题河南省洛阳市偃师市新前程美语学校2021-2022学年九年级上学期第三次月考化学试题湖北省孝感市云梦县2021-2022学年九年级上学期四校联考12月月考化学试题江西省赣州市崇义县2021-2022学年九年级上学期期末化学试题河北省张家口市怀安县2021-2022学年九年级上学期期末化学试题四川省自贡市荣县中学校2020-2021学年九年级下学期期中化学试题2022年四川省广元市剑阁县中考模拟抽样监测化学试题(已下线)易错点16 技巧性计算-备战2023年中考化学考试易错题黑龙江省绥化市绥棱县克音河学校2022-2023学年八年级下学期第一次月考化学试题河南省南阳市宛城区第十九中学2023-2024学年九年级上学期第二次月考化学试卷
五、计算题 添加题型下试题
计算题
|
较难(0.4)
6. 请根据下图所示的实验过程和提供的数据,计算样品中钠元素的质量。(提示
①氯化钠与盐酸不反应 ②二氧化碳溶于水的质量忽略不计)
①氯化钠与盐酸不反应 ②二氧化碳溶于水的质量忽略不计)

您最近一年使用:0次
计算题
|
适中(0.65)
7. 请根据如图所示的实验过程和提供的数据,计算生石灰样品中钙元素的质量___ 。(不考虑其他因素对实验的影响)


您最近一年使用:0次
计算题
|
适中(0.65)
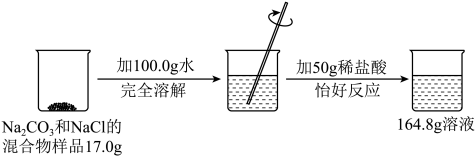
8. 请根据下图所示的实验过程和提供的数据,回答以下问题。
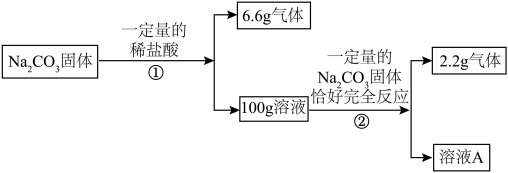
(1)过程②中产生气体的原因是______。
(2)计算溶液A的质量(写出计算过程,结果保留一位小数)______。

(1)过程②中产生气体的原因是______。
(2)计算溶液A的质量(写出计算过程,结果保留一位小数)______。
您最近一年使用:0次
六、综合应用题 添加题型下试题
综合应用题
|
困难(0.15)
9. 阳光牌小包装“脱氧剂”成分为Fe粉、活性炭及少量NaCl、水。使用一段时间后,其中的Fe粉会转变成Fe2O3而变质。某化学兴趣小组欲探究使用过的阳光牌“脱氧剂”的变质程度(已变质的Fe粉占变质前Fe粉的质量分数),设计并进行如下探究过程。
步骤(1)取食品包装袋中的阳光牌“脱氧剂”一袋,将里面的固体溶于水,过滤、洗涤、干燥滤渣。
步骤(2)取步骤(1)中的滤渣8.0g,加入足量的稀H2SO4与滤渣充分反应,过滤、洗涤、干燥得固体1.2g。
步骤(3)取步骤(2)中的滤液,加入足量的NaOH溶液,得到的固体经洗涤后转移到坩埚中,充分加热、冷却、称量,得到8.0gFe2O3(注:滤液中的Fe元素已全部转化为Fe2O3)。
求(1)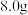 滤渣中Fe和Fe2O3两种物质的总质量
滤渣中Fe和Fe2O3两种物质的总质量____ 。
(2)该“脱氧剂”在未变质时,Fe粉和活性炭的质量之比____ 。
(3)该“脱氧剂”的变质程度____ 。
步骤(1)取食品包装袋中的阳光牌“脱氧剂”一袋,将里面的固体溶于水,过滤、洗涤、干燥滤渣。
步骤(2)取步骤(1)中的滤渣8.0g,加入足量的稀H2SO4与滤渣充分反应,过滤、洗涤、干燥得固体1.2g。
步骤(3)取步骤(2)中的滤液,加入足量的NaOH溶液,得到的固体经洗涤后转移到坩埚中,充分加热、冷却、称量,得到8.0gFe2O3(注:滤液中的Fe元素已全部转化为Fe2O3)。
求(1)
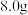 滤渣中Fe和Fe2O3两种物质的总质量
滤渣中Fe和Fe2O3两种物质的总质量(2)该“脱氧剂”在未变质时,Fe粉和活性炭的质量之比
(3)该“脱氧剂”的变质程度
您最近一年使用:0次
七、计算题 添加题型下试题
计算题
|
较难(0.4)
真题
10. 某化学小组为测定一瓶失去标签的盐酸的溶质质量分数,分成甲、乙两组,分别用不同的方法进行测定。
实验设计:
甲组:取纯净碳酸钙粉末5g于烧杯中,加入20g该盐酸溶液,充分反应后,过滤、洗涤、干燥,称量得剩余固体3g。
乙组:取纯净碳酸钙粉末5g于锥形瓶中,将20g该盐酸溶液加入分液漏斗,利用测定产生二氧化碳的体积(20℃、标准大气压)计算盐酸浓度。装置示意图如下:
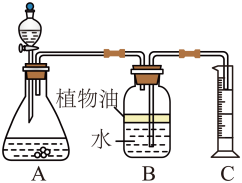
数据处理:
(1)请利用甲组数据计算该盐酸的溶质质量分数。(写出计算过程)
(2)乙组计算结果略小于甲组。经过多次实验仍得到相同结果(忽略量筒引起的误差),可能的原因是__
实验设计:
甲组:取纯净碳酸钙粉末5g于烧杯中,加入20g该盐酸溶液,充分反应后,过滤、洗涤、干燥,称量得剩余固体3g。
乙组:取纯净碳酸钙粉末5g于锥形瓶中,将20g该盐酸溶液加入分液漏斗,利用测定产生二氧化碳的体积(20℃、标准大气压)计算盐酸浓度。装置示意图如下:

数据处理:
(1)请利用甲组数据计算该盐酸的溶质质量分数。(写出计算过程)
(2)乙组计算结果略小于甲组。经过多次实验仍得到相同结果(忽略量筒引起的误差),可能的原因是__
您最近一年使用:0次
八、综合应用题 添加题型下试题
综合应用题
|
困难(0.15)
11. 现有HCl与CaCl2的混合溶液,为了分析混合溶液中HCl与CaCl2的质量分数,设计了如图所示实验方案:
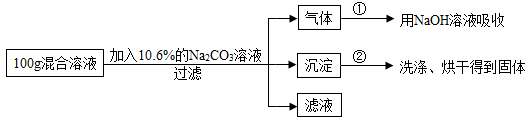
【实验数据】实验共记录了两组数据:
第①组,气体吸收完全后,NaOH溶液质量增加4.4g。
第②组,沉淀完全后,经过滤、洗涤、烘干后得到固体的质量为10g。
根据实验设计及有关数据进行分析与计算:
(1)混合溶液中HCl的质量分数为______ (只写结果)。
(2)混合溶液中CaCl2的质量分数为_____ (写出计算过程)?
(3)实验中混合溶液与Na2CO3溶液恰好完全反应,经过滤后所得“滤液”中溶质的质量分数为____ (不考虑过滤中的损失。只写结果,保留小数点后一位)。
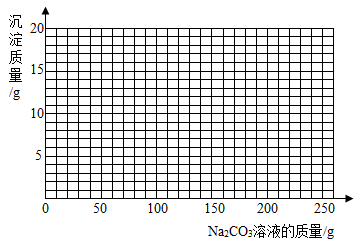
(4)若在100g混合溶液中不断加入溶质质量分数为10.6%的Na2CO3的溶液,请你在图上画出加入Na2CO3溶液的质量与产生沉淀的质量的关系图。____

【实验数据】实验共记录了两组数据:
第①组,气体吸收完全后,NaOH溶液质量增加4.4g。
第②组,沉淀完全后,经过滤、洗涤、烘干后得到固体的质量为10g。
根据实验设计及有关数据进行分析与计算:
(1)混合溶液中HCl的质量分数为
(2)混合溶液中CaCl2的质量分数为
(3)实验中混合溶液与Na2CO3溶液恰好完全反应,经过滤后所得“滤液”中溶质的质量分数为
(4)若在100g混合溶液中不断加入溶质质量分数为10.6%的Na2CO3的溶液,请你在图上画出加入Na2CO3溶液的质量与产生沉淀的质量的关系图。

【知识点】 化学方程式与实验的计算解读 碳酸氢钠、碳酸钠、碳酸钙解读
您最近一年使用:0次
九、实验题 添加题型下试题
实验题
|
较难(0.4)
真题
12. 在一堂化学实验课上,老师为每组同学分别提供了一瓶氢氧化钠溶液,让他们用1%的稀盐酸来测定其溶质的质量分数。以下是几组同学的设想及做法:
(1)甲组同学的实验如下图所示:在烧杯中加入5g氢氧化钠溶液,滴入几滴酚酞溶液,用滴管慢慢滴入1%的稀盐酸,并不断搅拌,至溶液颜色恰好变为无色为止。
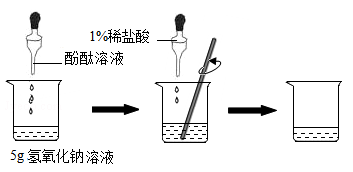
请回答:
①酚酞溶液的作用是_______ ;
②边滴加稀盐酸,边要用玻璃棒不断搅拌的目的是_____ 。
③当溶液颜色恰好变为无色时,共用去了稀盐酸7.3g,则甲组这瓶氢氧化钠溶液中溶质的质量分数为____ (写出计算过程,结果用百分数表示)。
(2)乙组同学的设想是:在烧杯中加入一定量的氢氧化钠溶液,用滴管慢慢滴入1%的稀盐酸,并不断搅拌,通过用pH试纸多次测定溶液pH的办法,达到实验目的。
①下列使用pH试纸的方法正确的是_____ (填字母)。
A 将pH试纸剪成几段节约使用
B 将pH试纸直接插入待测液中
C 将pH试纸放在干净的白瓷板上,用玻璃棒蘸取待测液滴在pH试纸上
D 将pH试纸润湿后放在玻璃片上,用玻璃棒蘸取待测液滴在pH试纸上
②由于用pH试纸需多次测定,较繁琐,且所测数值不够精确。在老师指导下,乙组同学取了5g氢氧化钠溶液进行了数字化实验,由计算机描绘出了整个实验过程中溶液pH的变化图像(简单表示为下图)。
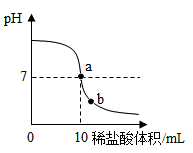
请回答:图中a点表示的含义是_____ ;b点溶液中含有的阳离子有_____ (填离子符号);乙组同学要计算出本组这瓶氢氧化钠溶液中溶质的质量分数,除了要用到已有数据外,你认为还需要的数据是_____ 。
(3)丙组同学在滴加稀盐酸一段时间后,发现溶液中有少量气泡产生。这一“异常现象”激起了他们的探究欲望,通过实验证明:该组用的这瓶氢氧化钠溶液已经部分变质。
请用化学方程式表示其变质的原因______ ;若要除去溶液中变质生成的杂质,请简要写出你的实验方案:_______________ 。
(1)甲组同学的实验如下图所示:在烧杯中加入5g氢氧化钠溶液,滴入几滴酚酞溶液,用滴管慢慢滴入1%的稀盐酸,并不断搅拌,至溶液颜色恰好变为无色为止。

请回答:
①酚酞溶液的作用是
②边滴加稀盐酸,边要用玻璃棒不断搅拌的目的是
③当溶液颜色恰好变为无色时,共用去了稀盐酸7.3g,则甲组这瓶氢氧化钠溶液中溶质的质量分数为
(2)乙组同学的设想是:在烧杯中加入一定量的氢氧化钠溶液,用滴管慢慢滴入1%的稀盐酸,并不断搅拌,通过用pH试纸多次测定溶液pH的办法,达到实验目的。
①下列使用pH试纸的方法正确的是
A 将pH试纸剪成几段节约使用
B 将pH试纸直接插入待测液中
C 将pH试纸放在干净的白瓷板上,用玻璃棒蘸取待测液滴在pH试纸上
D 将pH试纸润湿后放在玻璃片上,用玻璃棒蘸取待测液滴在pH试纸上
②由于用pH试纸需多次测定,较繁琐,且所测数值不够精确。在老师指导下,乙组同学取了5g氢氧化钠溶液进行了数字化实验,由计算机描绘出了整个实验过程中溶液pH的变化图像(简单表示为下图)。

请回答:图中a点表示的含义是
(3)丙组同学在滴加稀盐酸一段时间后,发现溶液中有少量气泡产生。这一“异常现象”激起了他们的探究欲望,通过实验证明:该组用的这瓶氢氧化钠溶液已经部分变质。
请用化学方程式表示其变质的原因
您最近一年使用:0次
2019-01-30更新
|
1558次组卷
|
4卷引用:2014年初中毕业升学考试化学试卷(江苏连云港市)
(已下线)2014年初中毕业升学考试化学试卷(江苏连云港市)2015年人教版初中化学九年级中考3年模拟第十单元练习卷怎样解实验类计算题第7章 应用广泛的酸、碱、盐(综合测试卷)-九年级下册初三化学【能力拓展练习】上教版
试卷分析
整体难度:较难
考查范围:物质的化学变化、身边的化学物质、物质构成的奥秘、化学实验
试卷题型(共 12题)
题型
数量
填空与简答
1
计算题
5
综合应用题
4
选择题
1
实验题
1
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、填空与简答 | |||
| 1 | 0.4 | 用质量守恒定律确定物质组成 含杂质的化学方程式计算 化学方程式与实验的计算 浓硫酸做干燥剂 | 填空题 |
| 二、计算题 | |||
| 2 | 0.4 | 化学方程式有关计算 不含杂质的化学方程式计算 根据化学式计算元素质量分数 | |
| 6 | 0.4 | 含杂质的化学方程式计算 化学方程式与实验的计算 盐类参与的反应 | |
| 7 | 0.65 | 含杂质的化学方程式计算 根据化学式计算元素质量分数 计算混合物中物质或元素的质量分数 | |
| 8 | 0.65 | 溶液和化学方程式的综合计算 碳酸氢钠、碳酸钠、碳酸钙 | |
| 10 | 0.4 | 制取二氧化碳原理的拓展 溶质质量分数结合化学方程式的计算 | |
| 三、综合应用题 | |||
| 3 | 0.4 | 不含杂质的化学方程式计算 根据化学式计算元素质量分数 | |
| 4 | 0.15 | 化学方程式与实验的计算 氢气还原金属氧化物 浓硫酸做干燥剂 | |
| 9 | 0.15 | 质量守恒定律内容及适用范围 酸的通性 设计实验探究物质的成分 | |
| 11 | 0.15 | 化学方程式与实验的计算 碳酸氢钠、碳酸钠、碳酸钙 | |
| 四、选择题 | |||
| 5 | 0.65 | 用质量守恒定律确定物质组成 不含杂质的化学方程式计算 | 单选题 |
| 五、实验题 | |||
| 12 | 0.4 | 中和反应相关实验与计算 无明显现象的中和反应的判断 溶液的酸碱性的判断与pH的测定 盐类参与的反应 | |



