硫酸是化学实验室中常用的试剂,也是重要的化工原料。试回答下列问题:
(1)浓硫酸具有强烈的腐蚀性。如果不慎将浓硫酸沾到皮肤上,应立即用大量的水冲洗,然后涂上3%~5%的______ (填“碳酸氢钠”“氢氧化钠”“硼酸”之一)溶液,以防灼伤皮肤。
(2)用硫单质制取硫酸的转化流程示意图如下:
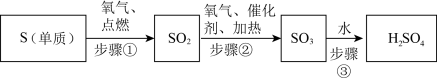
在S、SO2、SO3、H2SO4四种物质中,硫元素的化合价表现为+4价的物质是______ (填化学式)。写出上述转化流程步骤③中所发生反应的化学方程式______ 。
(3)现取100g稀硫酸倒入烧杯中,慢慢向烧杯中加入溶质质量分数为10%的BaCl2溶液,反应过程中产生沉淀的质量与所加入BaCl2溶液的质量关系如图所示。试回答:

①当加入BaCl2溶液200g时(即图中A点),烧杯中溶液里大量存在的酸根离子是______ (填离子符号)。
②当加入BaCl2溶液416g时(即图中B点),恰好完全反应,试通过计算求产生沉淀的总质量______ 。(计算结果精确至0.1g)。
(1)浓硫酸具有强烈的腐蚀性。如果不慎将浓硫酸沾到皮肤上,应立即用大量的水冲洗,然后涂上3%~5%的
(2)用硫单质制取硫酸的转化流程示意图如下:

在S、SO2、SO3、H2SO4四种物质中,硫元素的化合价表现为+4价的物质是
(3)现取100g稀硫酸倒入烧杯中,慢慢向烧杯中加入溶质质量分数为10%的BaCl2溶液,反应过程中产生沉淀的质量与所加入BaCl2溶液的质量关系如图所示。试回答:

①当加入BaCl2溶液200g时(即图中A点),烧杯中溶液里大量存在的酸根离子是
②当加入BaCl2溶液416g时(即图中B点),恰好完全反应,试通过计算求产生沉淀的总质量
2021·山东济南·中考真题 查看更多[3]
更新时间:2021-09-28 21:54:07
|
相似题推荐
综合应用题
|
较难
(0.4)
名校
解题方法
【推荐1】如图所示为实验室中常见气体制备装置,请回答下列问题。______ ;
(2)选择装置A和装置______ 制取较纯净的氧气,反应的化学方程式为______ 。
(3)若使用装置C作为制取 的发生装盟,与装置B比较,除了废物利用的优点外,请写出另一个优点
的发生装盟,与装置B比较,除了废物利用的优点外,请写出另一个优点______ 。
(4)测定某白色固体中碳酸钠的质量分数,可利用下图所示的实验装置(固定装置已略去,装置气密性良好)进行实验,每一步反应均完全进行。
第一步:打开弹簧夹,通入足量的氮气后关闭弹簧夹,称量装置丙的质量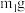
第二步:打开分液漏斗的活塞,注入足量的稀硫酸,关闭活塞
第三步:打开弹簧夹,通入足量的氮气,关闭弹簧夹,称量装置丙的质量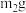
①写出碳酸钠的质量分数的表达式:______ (用a、 和
和 表示)。
表示)。
②如果没有装置乙,会造成测定结果填______ (“偏大”“偏小”或“不变”)。

(2)选择装置A和装置
(3)若使用装置C作为制取
 的发生装盟,与装置B比较,除了废物利用的优点外,请写出另一个优点
的发生装盟,与装置B比较,除了废物利用的优点外,请写出另一个优点(4)测定某白色固体中碳酸钠的质量分数,可利用下图所示的实验装置(固定装置已略去,装置气密性良好)进行实验,每一步反应均完全进行。

第一步:打开弹簧夹,通入足量的氮气后关闭弹簧夹,称量装置丙的质量
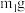
第二步:打开分液漏斗的活塞,注入足量的稀硫酸,关闭活塞
第三步:打开弹簧夹,通入足量的氮气,关闭弹簧夹,称量装置丙的质量
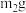
①写出碳酸钠的质量分数的表达式:
 和
和 表示)。
表示)。②如果没有装置乙,会造成测定结果填
您最近一年使用:0次
综合应用题
|
较难
(0.4)
名校
解题方法
【推荐2】过氧化钙(CaO2)可用于改善地表水质、处理重金属粒子废水、应急供氧等。称取7.2g过氧化钙固体加热。发生反应:2CaO2 2CaO+O2↑。该过程中,固体质量随温度变化如图所示。求:
2CaO+O2↑。该过程中,固体质量随温度变化如图所示。求:

(1)求B点对应纵坐标的数值(需要写出计算过程)。
(2)A点时,固体成分为_____ ,其中钙元素的质量为_____ g。
(3)CaO2是鱼类长途运输的供氧剂,它与水反应生成氧气,还生成一种碱,该反应的化学方程式为_______ 。
 2CaO+O2↑。该过程中,固体质量随温度变化如图所示。求:
2CaO+O2↑。该过程中,固体质量随温度变化如图所示。求:
(1)求B点对应纵坐标的数值(需要写出计算过程)。
(2)A点时,固体成分为
(3)CaO2是鱼类长途运输的供氧剂,它与水反应生成氧气,还生成一种碱,该反应的化学方程式为
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐3】化学是以实验为基础的科学,实验是科学探究的重要手段。
(1)①用A装置收集的气体应具备的物理性质是___________ 。

②若用如图装置采用排水法收集H2,请简述操作步骤___________ 。

(2)实验室可利用下图实验装置制取纯净、干燥的CO,然后用CO还原Fe2O3并检验气体产物。已知CO发生装置中的反应为:H2C2O4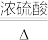 H2O+CO2↑+CO↑
H2O+CO2↑+CO↑

①A装置中能观察到什么现象?__________
②写出B装置中反应的化学方程式__________ 。
③要达到实验目的,装置中导管接口从左到右的连接顺序为:一氧化碳发生装置接___________ 、___________ 接___________ 、___________ 接___________ 、___________ 接___________ 。
④实验开始后,用数字化实验技术测得反应过程中D装置溶液的pH始终都大于7的原因是___________ ,设计实验方案证明实验结束后D装置溶液中溶质的成分___________ 。
(3)将一定量的碳酸钠加入到100g水中得到澄清透明溶液,向其中加入CaCl2溶液至恰好不再产生沉淀为止,经过滤、洗涤、干燥,称得沉淀为10g,计算碳酸钠的质量是多少?__________
(1)①用A装置收集的气体应具备的物理性质是

②若用如图装置采用排水法收集H2,请简述操作步骤

(2)实验室可利用下图实验装置制取纯净、干燥的CO,然后用CO还原Fe2O3并检验气体产物。已知CO发生装置中的反应为:H2C2O4
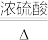 H2O+CO2↑+CO↑
H2O+CO2↑+CO↑
①A装置中能观察到什么现象?
②写出B装置中反应的化学方程式
③要达到实验目的,装置中导管接口从左到右的连接顺序为:一氧化碳发生装置接
④实验开始后,用数字化实验技术测得反应过程中D装置溶液的pH始终都大于7的原因是
(3)将一定量的碳酸钠加入到100g水中得到澄清透明溶液,向其中加入CaCl2溶液至恰好不再产生沉淀为止,经过滤、洗涤、干燥,称得沉淀为10g,计算碳酸钠的质量是多少?
您最近一年使用:0次
综合应用题
|
较难
(0.4)
【推荐1】地球上的金属资源广泛地存在于地壳和海洋中。
(1)利用金属活泼性的不同,可以采用不同的冶炼方法。
(1)利用金属活泼性的不同,可以采用不同的冶炼方法。
①电解熔融的氯化镁可以得到镁。分别写出氯化镁和镁的化学式,并标出其中镁元素的化合价:___________ 、___________ 。
②炼铁的原理是利用一氧化碳和氧化铁的反应,写出该反应的化学方程式:_________________________ 。
③二百多年前,拉瓦锡研究空气的成分时,加热红色的氧化汞粉末得到了银白色的汞,写出该反应的化学方程式:_______________________ 。
④从含有铅元素并有开采价值的矿石中提取铅,应选择上述方法中的_______________ 。
(2)某工厂利用废铁屑与废硫酸反应制取硫酸亚铁。现有废硫酸9.8 t(硫酸的质量分数为20%),与足量的废铁屑反应,可生产硫酸亚铁的质量是多少?(写出计算过程)____________
(1)利用金属活泼性的不同,可以采用不同的冶炼方法。
| 冶炼方法 | 主要原理 | 代表金属 |
| 电解法 | 熔融的金属化合物在通电的条件下分解 | 钠、铝 |
| 热还原法 | 金属氧化物与一氧化碳(或碳等)在高温的条件下反应 | 铁、铜 |
| 热分解法 | 金属氧化物在加热的条件下分解 | 汞、银 |
(1)利用金属活泼性的不同,可以采用不同的冶炼方法。
①电解熔融的氯化镁可以得到镁。分别写出氯化镁和镁的化学式,并标出其中镁元素的化合价:
②炼铁的原理是利用一氧化碳和氧化铁的反应,写出该反应的化学方程式:
③二百多年前,拉瓦锡研究空气的成分时,加热红色的氧化汞粉末得到了银白色的汞,写出该反应的化学方程式:
④从含有铅元素并有开采价值的矿石中提取铅,应选择上述方法中的
(2)某工厂利用废铁屑与废硫酸反应制取硫酸亚铁。现有废硫酸9.8 t(硫酸的质量分数为20%),与足量的废铁屑反应,可生产硫酸亚铁的质量是多少?(写出计算过程)
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐2】CO2是最主要的温室气体,也是巨大的碳资源,CO2的低能耗捕集、转化和利用正受到世界各国的广泛关注。

(1)以CO2为原料制取炭黑的太阳能工艺如图所示。
①反应1的基本类型为__________________ 。
②反应2中碳元素的化合价__________________ (填“升高”“不变”或“降低”)。
(2)利用NaOH溶液吸收CO2,部分转化关系见图。

反应①的化学方程式为__________________ ,该转化中循环使用的物质是__________________ 。
(3)利用Na2CO3或K2CO3溶液吸收低浓度的CO2,将其转化为 NaHCO3,或KHCO3,NaHCO3或KHCO3受热分解生成高浓度的CO2储存利用,生成的Na2CO3或K2CO3循环使用以降低生产成本。
根据表中信息,选择K2CO3溶液作吸收液的优点是_________________ 。
(4)利用一种新型“人造树叶”将CO2转化为乙醇(C2H5OH)的反应如下: ,研究显示,1L“人造树叶”每天能从空气中吸收968gCO2,计算1L“人造树叶”工作1天可得到乙醇的质量为
,研究显示,1L“人造树叶”每天能从空气中吸收968gCO2,计算1L“人造树叶”工作1天可得到乙醇的质量为_________________ 。
(5)某研究小组设计如下图所示实验,探究CO2和H2在一定条件下反应的产物。
查阅资料:①CO2和H2在合适催化剂和一定温度下反应转化为CO和H2O;
②白色无水硫酸铜吸水后变为蓝色;
③H2和CO一样也能还原氧化铁、氧化铜等金属氧化物得到金属单质。

实验过程中观察到的主要现象有:B装置中白色固体变为蓝色,C装置中黑色固体变为红色,D装置中澄清石灰水变浑浊。
①设计B装置的目的是_________________ 。
②C装置中发生的反应的化学方程式为_________________ 。

(1)以CO2为原料制取炭黑的太阳能工艺如图所示。
①反应1的基本类型为
②反应2中碳元素的化合价
(2)利用NaOH溶液吸收CO2,部分转化关系见图。

反应①的化学方程式为
(3)利用Na2CO3或K2CO3溶液吸收低浓度的CO2,将其转化为 NaHCO3,或KHCO3,NaHCO3或KHCO3受热分解生成高浓度的CO2储存利用,生成的Na2CO3或K2CO3循环使用以降低生产成本。
| 吸收剂 | Na2CO3 | K2CO3 |
| 20℃最高浓度(g/L) | 212 | 1104 |
| 价格(元/Kg) | 1.25 | 9.80 |
根据表中信息,选择K2CO3溶液作吸收液的优点是
(4)利用一种新型“人造树叶”将CO2转化为乙醇(C2H5OH)的反应如下:
 ,研究显示,1L“人造树叶”每天能从空气中吸收968gCO2,计算1L“人造树叶”工作1天可得到乙醇的质量为
,研究显示,1L“人造树叶”每天能从空气中吸收968gCO2,计算1L“人造树叶”工作1天可得到乙醇的质量为(5)某研究小组设计如下图所示实验,探究CO2和H2在一定条件下反应的产物。
查阅资料:①CO2和H2在合适催化剂和一定温度下反应转化为CO和H2O;
②白色无水硫酸铜吸水后变为蓝色;
③H2和CO一样也能还原氧化铁、氧化铜等金属氧化物得到金属单质。

实验过程中观察到的主要现象有:B装置中白色固体变为蓝色,C装置中黑色固体变为红色,D装置中澄清石灰水变浑浊。
①设计B装置的目的是
②C装置中发生的反应的化学方程式为
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐3】请回答下列问题。
Ⅰ.高纯硅可用于制备硅半导体材料,其主要生产流程如图所示:
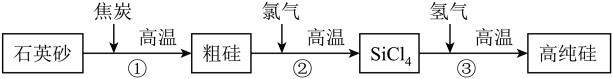
(1)①发生反应的化学方程式为 ,该反应中属于氧化物的是
,该反应中属于氧化物的是___________ (填化学式),一氧化碳在生产生活中的用途是___________ (写一种即可)。
(2)反应的化学方程式为SiCl4+2H2 Si+4HCl ,该反应中氢元素的化合价变化为零价→+1价,硅元素的化合价变化为
Si+4HCl ,该反应中氢元素的化合价变化为零价→+1价,硅元素的化合价变化为___________ 。
Ⅱ.A~I都是初中化学中的常见物质,A是大理石、石灰石、鸡蛋壳的主要成分。C、E为气体且元素组成相同,其中E为有毒气体。D、H为黑色固体,I为红色金属单质。它们的转化关系如图所示,请回答下列有关问题:

(3)写出下列物质的化学式:B________ :D________ :G_______ 。
(4)反应②发生时要___________ (填“放出”或“吸收”)热量。
(5)写出反应①的化学方程式___________ ,该反应属于___________ (填基本反应类型)
(6)写出反应⑤的化学方程式___________ 。
Ⅰ.高纯硅可用于制备硅半导体材料,其主要生产流程如图所示:

(1)①发生反应的化学方程式为
 ,该反应中属于氧化物的是
,该反应中属于氧化物的是(2)反应的化学方程式为SiCl4+2H2
 Si+4HCl ,该反应中氢元素的化合价变化为零价→+1价,硅元素的化合价变化为
Si+4HCl ,该反应中氢元素的化合价变化为零价→+1价,硅元素的化合价变化为Ⅱ.A~I都是初中化学中的常见物质,A是大理石、石灰石、鸡蛋壳的主要成分。C、E为气体且元素组成相同,其中E为有毒气体。D、H为黑色固体,I为红色金属单质。它们的转化关系如图所示,请回答下列有关问题:

(3)写出下列物质的化学式:B
(4)反应②发生时要
(5)写出反应①的化学方程式
(6)写出反应⑤的化学方程式
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐1】硫酸是化学实验室中常用的试剂,也是重要的化工原料。试回答下列问题:
(1)浓硫酸具有强烈的腐蚀性。如果不慎将浓硫酸沾到皮肤上,应立即用大量的水冲洗,然后涂上3%~5%的______ (填“碳酸氢钠”、“氢氧化钠”或“硼酸”之一)溶液,以防灼伤皮肤。
(2)用硫单质制取硫酸的转化流程示意图如下:

在S、 、
、 三种物质中,硫元素的化合价表现为+4价的物质是
三种物质中,硫元素的化合价表现为+4价的物质是______ (填化学式)。写出上述转化流程步骤②中所发生反应的化学方程式:______ 。
(3)现取100g稀硫酸倒入烧杯中,慢慢向烧杯中加入溶质质量分数为10%的 溶液,反应过程中产生沉淀的质量与所加入
溶液,反应过程中产生沉淀的质量与所加入 溶液的质量关系如图所示。试回答:
溶液的质量关系如图所示。试回答:

①当加入 溶液240g时(即图中A点),烧杯中溶液里大量存在的酸根阴离子是
溶液240g时(即图中A点),烧杯中溶液里大量存在的酸根阴离子是______ (填离子符号)。
②当加入 溶液522g时(即图中B点),恰好完全反应,试通过计算求产生沉淀的总质量。
溶液522g时(即图中B点),恰好完全反应,试通过计算求产生沉淀的总质量。______ (计算结果精确至0.1g)
(1)浓硫酸具有强烈的腐蚀性。如果不慎将浓硫酸沾到皮肤上,应立即用大量的水冲洗,然后涂上3%~5%的
(2)用硫单质制取硫酸的转化流程示意图如下:

在S、
 、
、 三种物质中,硫元素的化合价表现为+4价的物质是
三种物质中,硫元素的化合价表现为+4价的物质是(3)现取100g稀硫酸倒入烧杯中,慢慢向烧杯中加入溶质质量分数为10%的
 溶液,反应过程中产生沉淀的质量与所加入
溶液,反应过程中产生沉淀的质量与所加入 溶液的质量关系如图所示。试回答:
溶液的质量关系如图所示。试回答:
①当加入
 溶液240g时(即图中A点),烧杯中溶液里大量存在的酸根阴离子是
溶液240g时(即图中A点),烧杯中溶液里大量存在的酸根阴离子是②当加入
 溶液522g时(即图中B点),恰好完全反应,试通过计算求产生沉淀的总质量。
溶液522g时(即图中B点),恰好完全反应,试通过计算求产生沉淀的总质量。
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐2】氢氧化钠(俗称:烧碱)的用途十分广泛,既是化学实验室的必备药品之一,同时也是重要的化工原斜。试回答下列问题:
(1)氢氧化钠在常温下是一种白色晶体,具有强烈的腐蚀性。如果不慎将氢氧化钠沾到皮肤上,应立即用大量的水冲洗,然后涂上______ (填“碳酸氢钠”“硫酸”“硼酸”之一)溶液,以防灼伤皮肤。
(2)工业上常用纯碱和石灰石为原料制备氢氧化钠,主要流程如下图所示:

在上述转化反应过程中属于复分解反应的是______ (填序号);用pH试纸检验石灰水酸碱度的具体方法是:______ 。
(3)取制备好的氢氧化钠溶液100g倒入烧杯中,慢慢向烧杯中加入溶质质量分数为10%的MgSO4溶液,反应过程中产生沉淀的质量与所加入MgSO4溶液的质量关系如下图所示。当加入MgSO4溶液240g时(即图中A点),试通过计算求产生沉淀的质量。(计算结果精确至0.1g)

(1)氢氧化钠在常温下是一种白色晶体,具有强烈的腐蚀性。如果不慎将氢氧化钠沾到皮肤上,应立即用大量的水冲洗,然后涂上
(2)工业上常用纯碱和石灰石为原料制备氢氧化钠,主要流程如下图所示:

在上述转化反应过程中属于复分解反应的是
(3)取制备好的氢氧化钠溶液100g倒入烧杯中,慢慢向烧杯中加入溶质质量分数为10%的MgSO4溶液,反应过程中产生沉淀的质量与所加入MgSO4溶液的质量关系如下图所示。当加入MgSO4溶液240g时(即图中A点),试通过计算求产生沉淀的质量。(计算结果精确至0.1g)

您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐3】在实验室和生活中选择合适的药品和装置可以制取氧气。
I.选择合适的药品制取氧气
(1)过碳酸钠制氧。某款家用制氧机利用两种化学药剂[过碳酸钠(2Na2CO3•3H2O2)和二氧化锰]同时加入水中制取氧气,装置如图1所示。
①制氧机工作时发生了两步反应,写出第二步反应的化学方程式。
第一步:2Na2CO3•3H2O2═2Na2CO3+3H2O2;第二步:___________ 。
②图中“加湿过滤仓”的原理与下列___________ (填字母)装置类似。__________ (填“大于”或“小于”)氧分子渗透速率。
②将通过氧气分离膜的气体收集在集气瓶中,证明瓶中收集到的气体是富氧空气的方法为______ 。
(3)氧烛制氧。氧烛制氧是密闭空间紧急供氧技术。一种氧烛主要含NaClO3,还有少量铁粉。其产氧原理为:触发铁粉燃烧,使NaClO3分解。
已知:2NaClO3 2NaCl+3O2↑。
2NaCl+3O2↑。
①NaClO3的理论产氧率[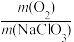 ]为
]为___________ (结果精确至0.1%)。
②氧烛在使用时的产氧率明显低于理论值的原因可能是___________ 。
③这种氧烛在使用时,NaClO3在250℃左右即开始产氧,且速率较快。其原因可能是__________ 。
II.设计鱼类运输供氧箱
任务1:选供氧剂
查阅资料:过氧化钙(CaO2)、过氧化钠(Na2O2)都能与H2O反应生成O2和相应的碱,反应原理:2CaO2+2H2O=2Ca(OH)2+O2↑;2Na2O2+2H2O=4NaOH+O2↑。前者反应速率缓慢,后者反应剧烈。
(4)CaO2与H2O反应速率比Na2O2缓慢的主要原因是:___________ 。
(5)小组讨论后,认为鱼类运输供氧选择CaO2更好,理由是___________ 。
任务2:设计装置
(6)为保证不同鱼类在运输中的存活率,需要监测水中溶氧量和温度。同学们在老师指导下,设计了如图4的鱼类运输供氧箱,其中微孔输氧棒的作用是___________ 。利用该装置持续供氧30分钟,记录数据,如图5,可得出水中溶氧量随温度变化的规律为___________ 。
I.选择合适的药品制取氧气
(1)过碳酸钠制氧。某款家用制氧机利用两种化学药剂[过碳酸钠(2Na2CO3•3H2O2)和二氧化锰]同时加入水中制取氧气,装置如图1所示。
①制氧机工作时发生了两步反应,写出第二步反应的化学方程式。
第一步:2Na2CO3•3H2O2═2Na2CO3+3H2O2;第二步:
②图中“加湿过滤仓”的原理与下列


②将通过氧气分离膜的气体收集在集气瓶中,证明瓶中收集到的气体是富氧空气的方法为
(3)氧烛制氧。氧烛制氧是密闭空间紧急供氧技术。一种氧烛主要含NaClO3,还有少量铁粉。其产氧原理为:触发铁粉燃烧,使NaClO3分解。
已知:2NaClO3
 2NaCl+3O2↑。
2NaCl+3O2↑。①NaClO3的理论产氧率[
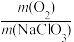 ]为
]为②氧烛在使用时的产氧率明显低于理论值的原因可能是
③这种氧烛在使用时,NaClO3在250℃左右即开始产氧,且速率较快。其原因可能是
II.设计鱼类运输供氧箱
任务1:选供氧剂
查阅资料:过氧化钙(CaO2)、过氧化钠(Na2O2)都能与H2O反应生成O2和相应的碱,反应原理:2CaO2+2H2O=2Ca(OH)2+O2↑;2Na2O2+2H2O=4NaOH+O2↑。前者反应速率缓慢,后者反应剧烈。
(4)CaO2与H2O反应速率比Na2O2缓慢的主要原因是:
(5)小组讨论后,认为鱼类运输供氧选择CaO2更好,理由是
任务2:设计装置
(6)为保证不同鱼类在运输中的存活率,需要监测水中溶氧量和温度。同学们在老师指导下,设计了如图4的鱼类运输供氧箱,其中微孔输氧棒的作用是

您最近一年使用:0次
综合应用题
|
较难
(0.4)
名校
解题方法
【推荐1】(Ⅰ)尿素【CO(NH2)2】是一种常用化肥,下图为利用空气等制尿素的主要流程。

(1)图中分离空气的过程,原理是利用混合物中各成分的______ 不同。
(2)下列属于物质X用途的是______。
(3)由CH4在该流程中的作用表明:化学反应中发生物质变化的同时也会伴随______ 变化。
(4)合成塔中,制备尿素的化学方程式为______ 。
(Ⅱ)物质王国中的A~F及X七种物质玩“独木桥”游戏,其中A~F分别是盐酸、氧化铜、一氧化碳、碳酸钙、氧气、甲烷六种物质中的一种。

(5)搭桥:规则是A~F搭桥后相邻的物质之间能发生化学反应(所涉及反应均为初中常见化学反应)。已知氧化铜能与盐酸反应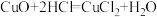 ;C为黑色固体, F是一种气体。
;C为黑色固体, F是一种气体。
①C的化学式是______ ;
②E与F反应的化学方程式是______ ;
③E能转化为C,该转化反应的基本反应类型为______ 。
(6)过桥:若A~F分别通过一步反应能直接转化为X,则X可成功过桥,物质X是______ (写名称)。

(1)图中分离空气的过程,原理是利用混合物中各成分的
(2)下列属于物质X用途的是______。
| A.航天 | B.灭火 | C.保护气 | D.低温冷冻 |
(4)合成塔中,制备尿素的化学方程式为
(Ⅱ)物质王国中的A~F及X七种物质玩“独木桥”游戏,其中A~F分别是盐酸、氧化铜、一氧化碳、碳酸钙、氧气、甲烷六种物质中的一种。

(5)搭桥:规则是A~F搭桥后相邻的物质之间能发生化学反应(所涉及反应均为初中常见化学反应)。已知氧化铜能与盐酸反应
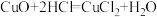 ;C为黑色固体, F是一种气体。
;C为黑色固体, F是一种气体。①C的化学式是
②E与F反应的化学方程式是
③E能转化为C,该转化反应的基本反应类型为
(6)过桥:若A~F分别通过一步反应能直接转化为X,则X可成功过桥,物质X是
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐2】小苏打和食盐是厨房中常用物质。现有一包白色固体,可能由NaHCO3和NaCl中的一种或两种组成。某科学小组同学展开了系列拓展性研究。

(一)定性分析:
【实验目的】确定白色固体的组成:
【实验方案】
【实验结论】
该白色固体由NaHCO3和NaCl两种物质组成。
(1)实验步骤①中选用稀硝酸而不用稀盐酸的原因是__________ ;
(2)实验步骤②化学反应方程式为___________ 。
(3)实验步骤③生成白色沉淀的化学反应方程式为___________ 。
(二)定量分析:
【实验目的】测定该白色固体中NaHCO3的质量分数:
方案Ⅰ:用气体法测定样品中NaHCO3的质量分数。实验装置如下:

(1)用上述装置完成本实验的连接顺序是A
______  C(填字母编号,装置不重复使用)。
C(填字母编号,装置不重复使用)。
(2)D装置中稀硫酸和固体样品发生反应的化学方程式为____________ 。
(3)如果没有经A装置而直接通空气,会使测量结果________ (填“变大”、“变小”或“不变”)。
(4)C装置的作用是_________ ,可能发生反应的化学方程式为__________ 。
(5)D装置中的反应完全后,称量前,还需要进行的实验操作是__________ 。
方案Ⅱ:用沉淀法测定样品中NaHCO3的质量分数。操作流程如下:(查阅资料:NaHCO3 + NaOH = Na2CO3 + H2O)

(1)实验中需洗涤沉淀,判断沉淀已洗净的方法是:_____ 。
(2)实验测得样品中NaHCO3的质量分数________ ? (写出具体的解题过程)

(一)定性分析:
【实验目的】确定白色固体的组成:
【实验方案】
【实验结论】
该白色固体由NaHCO3和NaCl两种物质组成。
(1)实验步骤①中选用稀硝酸而不用稀盐酸的原因是
(2)实验步骤②化学反应方程式为
(3)实验步骤③生成白色沉淀的化学反应方程式为
(二)定量分析:
【实验目的】测定该白色固体中NaHCO3的质量分数:
方案Ⅰ:用气体法测定样品中NaHCO3的质量分数。实验装置如下:

(1)用上述装置完成本实验的连接顺序是A

 C(填字母编号,装置不重复使用)。
C(填字母编号,装置不重复使用)。(2)D装置中稀硫酸和固体样品发生反应的化学方程式为
(3)如果没有经A装置而直接通空气,会使测量结果
(4)C装置的作用是
(5)D装置中的反应完全后,称量前,还需要进行的实验操作是
方案Ⅱ:用沉淀法测定样品中NaHCO3的质量分数。操作流程如下:(查阅资料:NaHCO3 + NaOH = Na2CO3 + H2O)

(1)实验中需洗涤沉淀,判断沉淀已洗净的方法是:
(2)实验测得样品中NaHCO3的质量分数
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐3】用一定质量的电石渣【主要成分为(Ca(OH)2,还含有MgO等杂质】为原料生产纳米碳酸钙。
【实验过程】
①在预处理过的电石渣中加入氯化铵溶液浸取。
②向浸取液中滴入氨水,将镁元素全部转为氢氧化镁,过滤。③在滤液中继续通入氨水。
④在碳化塔中通入加了氨水的滤液和二氧化碳进行碳化反应,得到纳米碳酸钙粗产品
【查阅资料】
①NH4Cl溶液呈酸性,一定条件下,浓度大,酸性强。
②“浸取”时的主要反应为
③“碳化”时的主要反应为
④碱石灰是氧化钙和氢氧化钠的混合物,能吸收水和二氧化碳。
【实验分析与处理】
(1)根据资料分析,该实验过程中可循环利用的物质是______ 。
(2)用不同质量分数的NH4Cl溶液浸取电石渣时,Ca元素提取率和Mg元素去除率的数值如图1所示,你认为较适宜的NH4Cl质量分数是______ %。______ 处通入(填“A”或“B”)最佳。
(4)测得不同温度下碳化反应所需时间如下表(其他条件相同):
实际碳化反应的温度采用了60°C,温度不宜过高的原因可能是______ (写出一条即可)。
(5)该实验核心反应在“浸取”和“碳化”这两步,结合所学知识,写出由Ca(OH)2制备碳酸钙的总反应方程式______ 。
(6)用制得的纳米碳酸钙和稀盐酸反应,如下图,D中溶液增重2.2g,回答下列问题。______ 次。
②控制分液漏斗活塞,缓缓滴入稀盐酸的目的是______ 。
③计算需要含Ca(OH)2质量分数为74%的该电石渣原料的质量为______ g。
④实验中若无装置B、C、E,测得电石渣质量______ (填“偏大”或“偏小)。
【实验过程】
①在预处理过的电石渣中加入氯化铵溶液浸取。
②向浸取液中滴入氨水,将镁元素全部转为氢氧化镁,过滤。③在滤液中继续通入氨水。
④在碳化塔中通入加了氨水的滤液和二氧化碳进行碳化反应,得到纳米碳酸钙粗产品
【查阅资料】
①NH4Cl溶液呈酸性,一定条件下,浓度大,酸性强。
②“浸取”时的主要反应为

③“碳化”时的主要反应为

④碱石灰是氧化钙和氢氧化钠的混合物,能吸收水和二氧化碳。
【实验分析与处理】
(1)根据资料分析,该实验过程中可循环利用的物质是
(2)用不同质量分数的NH4Cl溶液浸取电石渣时,Ca元素提取率和Mg元素去除率的数值如图1所示,你认为较适宜的NH4Cl质量分数是

(4)测得不同温度下碳化反应所需时间如下表(其他条件相同):
温度 | 反应液浑浊所需时间(单位:秒) | 反应完全所需时间(单位:分钟) |
20°C | 480 | >180 |
40°C | 120 | 180 |
60°C | 1 | 50 |
80°C | 1 | 68 |
(5)该实验核心反应在“浸取”和“碳化”这两步,结合所学知识,写出由Ca(OH)2制备碳酸钙的总反应方程式
(6)用制得的纳米碳酸钙和稀盐酸反应,如下图,D中溶液增重2.2g,回答下列问题。

②控制分液漏斗活塞,缓缓滴入稀盐酸的目的是
③计算需要含Ca(OH)2质量分数为74%的该电石渣原料的质量为
④实验中若无装置B、C、E,测得电石渣质量
您最近一年使用:0次



