用沉淀法可测定食用碱样品中碳酸钠的质量分数。取11g食用碱样品(有少量的杂质氢氧化钠),加水完全溶解制成100g溶液,逐次滴加溶质质量分数相同的氯化钙溶液,实验数据如表:
请根据实验数据分析解答下列问题。
(1)表中数据M的值为______ 。
(2)计算该食用碱样品中碳酸钠的质量分数(写出过程,结果保留到0.1%)。
| 实验次数 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 | 第6次 |
| 加入CaCl2溶液的质量/g | 20.0 | 20.0 | 20.0 | 20.0 | 20.0 | 20.0 |
| 反应后溶液的总质量/g | 118.0 | 136.0 | 154.0 | M | 191.0 | 211.0 |
请根据实验数据分析解答下列问题。
(1)表中数据M的值为
(2)计算该食用碱样品中碳酸钠的质量分数(写出过程,结果保留到0.1%)。
更新时间:2022-05-19 22:41:48
|
相似题推荐
计算题
|
适中
(0.65)
名校
【推荐1】石灰石的主要成分是碳酸钙,煅烧石灰石时,其中的碳酸钙会分解生成氧化钙和二氧化碳(杂质不反应)。充分煅烧12.5g石灰石样品,反应完后称得剩余固体质量为8.1g。计算
(1)反应完全后固体减少了_________g,这是生成___________(填化学式)的质量。
(2)石灰石样品中碳酸钙的质量分数是多少(写出计算过程)。
(1)反应完全后固体减少了_________g,这是生成___________(填化学式)的质量。
(2)石灰石样品中碳酸钙的质量分数是多少(写出计算过程)。
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐2】实验室用氯酸钾和二氧化锰的混合物共8g制取氧气(发生反应的化学方程式为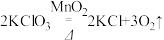 )。加热到不再产生氧气时,将剩余固体冷却后称量,质量为6.08g,则原混合物中二氧化锰的质量是多少克?
)。加热到不再产生氧气时,将剩余固体冷却后称量,质量为6.08g,则原混合物中二氧化锰的质量是多少克?
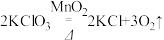 )。加热到不再产生氧气时,将剩余固体冷却后称量,质量为6.08g,则原混合物中二氧化锰的质量是多少克?
)。加热到不再产生氧气时,将剩余固体冷却后称量,质量为6.08g,则原混合物中二氧化锰的质量是多少克?
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐1】将12.9克NaCl和Na2CO3固体混合物完全溶于水中形成溶液,再将75克CaCl2溶液分5次加入到该溶液中,充分反应,测得的实验数据如下表。
试计算:
(1)表格中m的数值是______ 。
(2)原固体混合物中Na2CO3的质量分数。(精确到0.1%)
| 实验序号 | 1 | 2 | 3 | 4 | 5 |
| 加入氯化钙溶液质量/g | 15 | 15 | 15 | 15 | 15 |
| 生成沉淀的总质量/g | 3 | m | 9 | 10 | 10 |
(1)表格中m的数值是
(2)原固体混合物中Na2CO3的质量分数。(精确到0.1%)
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐2】航天员王亚平在天和核心舱开展科普实验:
将泡腾片塞入一个蓝色水球里,泡腾片逐渐溶解并不断冒泡,水球变成“气泡球”。某同学为了测定泡腾片中的NaHCO3的含量,先将装有20.00g水的烧杯放在电子天平上,再将10.00g某泡腾片(成分见图1)投入水中并搅拌;当质量不再变化时,他又向烧杯中分次加入2.00g10%的稀硫酸(担心NaHCO3没有全部反应,见图2),总质量变化如下表:


【提示】泡腾片中的柠檬酸(用H3R表示)溶于水后,与NaHCO3反应的化学方程式为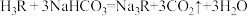 。
。
(1)这种泡腾片的主要成分中属于无机盐的是________ (写化学式)。
(2)泡腾片中的NaHCO3在表中________ (填编号)时已反应完全,产生的CO2质量为______ g。
(3)计算这种泡腾片中NaHCO3的质量分数,写出计算过程。
将泡腾片塞入一个蓝色水球里,泡腾片逐渐溶解并不断冒泡,水球变成“气泡球”。某同学为了测定泡腾片中的NaHCO3的含量,先将装有20.00g水的烧杯放在电子天平上,再将10.00g某泡腾片(成分见图1)投入水中并搅拌;当质量不再变化时,他又向烧杯中分次加入2.00g10%的稀硫酸(担心NaHCO3没有全部反应,见图2),总质量变化如下表:


编号 | ① | ② | ③ | ④ | ⑤ |
操作 | 刚投入 | 1分钟 | 2分钟 | 加入2.00g稀硫酸 | 再加入2.00g稀硫酸 |
总质量/g | 40.00 | 39.37 | 39.12 | 41.12 | 43.12 |
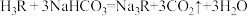 。
。(1)这种泡腾片的主要成分中属于无机盐的是
(2)泡腾片中的NaHCO3在表中
(3)计算这种泡腾片中NaHCO3的质量分数,写出计算过程。
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐1】鸡蛋壳的主要成分是CaCO3,现在取15g干燥的鸡蛋壳放入20g的烧杯中,向其中加入40g稀盐酸恰好完全反应(杂质不溶于水,且不与稀盐酸反应),反应后烧杯和物质的总质量为70.6g,计算鸡量中的CaCO3的质量分数是多少?(结果保留到0.1%)
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐2】为测定某工业废水中硫酸铜的含量,进行如图所示的实验。(废水中的其他物质不与BaCl2反应)

请分析并计算:
(1)反应生成沉淀的质量为
(2)计算该废水中硫酸铜的质量分数。
您最近一年使用:0次




