某研究小组对一款中小学生中盛行的炸包玩具进行了项目式探究。
【查阅资料】在炸包内,隐藏着一个小塑料袋,用手捏破塑料袋后,使液体与白色粉末接触产生二氧化碳气体,炸包会在3秒内迅速膨胀,产生“爆炸”效果。
任务一:炸包中小塑料袋内液体的酸碱性
取少量小塑料袋内液体于试管中,滴加几滴_______ 试液,若溶液_______ ,说明该塑料袋内液体呈酸性。
任务二:炸包中小塑料袋内白色固体成分
【提出猜想】猜想1:碳酸钙;猜想2:碳酸钠;猜想3:碳酸氢钠。
【查阅资料】碳酸钠受热不分解,碳酸氢钠受热分解生成碳酸钠、水和二氧化碳。
【进行实验】(1)将少量白色粉末放入水中搅拌,固体全部溶解,说明猜想_______ 不成立。
(2)另取炸包内的白色粉末又进行了如图实验进一步探究白色固体的成分,观察到_______ ,说明白色固体为碳酸氢钠。写出试管B中反应的化学方程式_______ 。
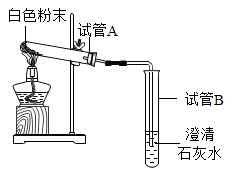
任务三:分析炸包中选用药品的依据结合资料及已有知识,回答下列问题:
(3)等质量的碳酸钠和碳酸氢钠分别与适量的酸完全反应,产生二氧化碳的体积为V1和V2,则V1_______ V2(填“大于”、“小于”或“等于”)。
(4)选择做为炸包中的药品,你认为还需要注意的是_______ 、_______ 。
【查阅资料】在炸包内,隐藏着一个小塑料袋,用手捏破塑料袋后,使液体与白色粉末接触产生二氧化碳气体,炸包会在3秒内迅速膨胀,产生“爆炸”效果。
任务一:炸包中小塑料袋内液体的酸碱性
取少量小塑料袋内液体于试管中,滴加几滴
任务二:炸包中小塑料袋内白色固体成分
【提出猜想】猜想1:碳酸钙;猜想2:碳酸钠;猜想3:碳酸氢钠。
【查阅资料】碳酸钠受热不分解,碳酸氢钠受热分解生成碳酸钠、水和二氧化碳。
【进行实验】(1)将少量白色粉末放入水中搅拌,固体全部溶解,说明猜想
(2)另取炸包内的白色粉末又进行了如图实验进一步探究白色固体的成分,观察到

任务三:分析炸包中选用药品的依据结合资料及已有知识,回答下列问题:
(3)等质量的碳酸钠和碳酸氢钠分别与适量的酸完全反应,产生二氧化碳的体积为V1和V2,则V1
(4)选择做为炸包中的药品,你认为还需要注意的是
2022·安徽·模拟预测 查看更多[6]
(已下线)黄金卷03-【赢在中考·黄金8卷】备战2023年中考化学全真模拟卷(安徽专用)2023中考化学压轴题 题型11 实验探究题 创新类型 项目式探究(已审)2022年安徽省滁州市琅琊区中考二模化学试题2022年安徽省中考模拟化学试题(三)2022年安徽省城名校中考三模化学试题2022年安徽省合肥市合肥十校中考模拟化学试题(一)
更新时间:2022-07-18 09:34:15
|
相似题推荐
【推荐1】古玩市场惊现“三星堆”遗址出土的同款黄金面具,某化学兴趣小组的同学为鉴别其真假进行了如下探究活动。
【查阅资料】(1)铜锌合金(又称:假黄金)外发和黄金相似,常被不法商贩以假乱真。
(2)标准状况下,氢气密度p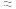 0.09g/L。
0.09g/L。
【进行实验】同学们设计了如下不同的探究方案,均验证了该黄金面具是假黄金,请帮他们完成实验报告。
方案一:截取小块黄金面具放在酒精灯上加热。实验现象为________ 。
方案二:截取小块黄金面具于试管中,加入一定量稀硫酸,有气泡产生。反应的化学方程式为______ 。
方案三:截取小块黄金面具于另一支试管中,如入适量硫酸铜溶液。实验现象为_______ 。
【深入探究】为了定量分析黄金面具中金属锌的质量分数,李阳同学设计了如下实验:
Ⅰ.按如图所示组装实验装置后,应检查装置的________ 。

Ⅱ.向锥形瓶中加入5.0g黄金面具样品,注射器中吸入25mL稀硫酸。
Ⅲ.将注射器中的稀硫酸平均分5次推入锥形瓶中:每次推入稀硫酸、待不再产生气泡后,记录收集气体的总体积,如表。
(1)分析上表中的数据,加入第_________ 次盐酸后,黄金面具中的锌已经反应完。
(2)分析数据、完全反应后生成氢气的体积V=_________ mL。
【数据处理】此黄金面具中锌的质量分数ω1=_______ 。
【反思评价】
(1)王明对李阳的方案和数据处理进行分析,认为求黄金面具中锌的质量分数还有更简便的方法。他将锥形瓶内反应后的剩余物经系列操作:_______ →洗涤→干燥→称量。得到固体剩余物的质量,也可求出黄金面具中锌的质量分数ω2。
(2)ω1和ω2略有差异,王明对李阳的方案和数据处理提出了质疑,认为自己的更准确,请说出王明质疑的理由__________ 。
(3)按照李阳的实验方案,生成的氢气会部分滞留在锥形瓶中,若这部分氢气没有计算在内,对最后锌的质量分数的影响会__________ (填“偏大”、“偏小”或“无影响”)。
【查阅资料】(1)铜锌合金(又称:假黄金)外发和黄金相似,常被不法商贩以假乱真。
(2)标准状况下,氢气密度p
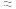 0.09g/L。
0.09g/L。【进行实验】同学们设计了如下不同的探究方案,均验证了该黄金面具是假黄金,请帮他们完成实验报告。
方案一:截取小块黄金面具放在酒精灯上加热。实验现象为
方案二:截取小块黄金面具于试管中,加入一定量稀硫酸,有气泡产生。反应的化学方程式为
方案三:截取小块黄金面具于另一支试管中,如入适量硫酸铜溶液。实验现象为
【深入探究】为了定量分析黄金面具中金属锌的质量分数,李阳同学设计了如下实验:
Ⅰ.按如图所示组装实验装置后,应检查装置的

Ⅱ.向锥形瓶中加入5.0g黄金面具样品,注射器中吸入25mL稀硫酸。
Ⅲ.将注射器中的稀硫酸平均分5次推入锥形瓶中:每次推入稀硫酸、待不再产生气泡后,记录收集气体的总体积,如表。
| 次数 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
| 收集气体的总体积/mL | 200 | 400 | 515 | 520 | 525 |
(2)分析数据、完全反应后生成氢气的体积V=
【数据处理】此黄金面具中锌的质量分数ω1=
【反思评价】
(1)王明对李阳的方案和数据处理进行分析,认为求黄金面具中锌的质量分数还有更简便的方法。他将锥形瓶内反应后的剩余物经系列操作:
(2)ω1和ω2略有差异,王明对李阳的方案和数据处理提出了质疑,认为自己的更准确,请说出王明质疑的理由
(3)按照李阳的实验方案,生成的氢气会部分滞留在锥形瓶中,若这部分氢气没有计算在内,对最后锌的质量分数的影响会
您最近半年使用:0次
【推荐2】“自热食品”中的发热包加水能加热食物。兴趣小组对网购的某食品专用发热包(部分标签如图所示)进行了探究。
I.初步探究
将一包撕开塑料袋后的发热包平放在烧杯底部,加入200mL常温水,插入温度计。观察到温度计示数逐渐升至92℃,冒出大量白雾,液体底部产生大量气泡。
(1)甲同学认为热量来自于氧化钙和水的反应,其反应方程式为_____ 。
(2)使用方法中要求加常温水而不是热水的目的是_____ 。
Ⅱ.深入探究
探究一:注意事项中为什么要求“远离明火,严禁在密闭场所中使用”?
【猜想假设】生成的气体是可燃性气体。
【查阅资料】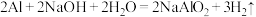 ,反应放热。
,反应放热。
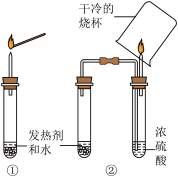
【进行实验】按图中①所示进行实验,发现气体无法被点燃。思考后利用改进后的②装置进行实验,观察到预期现象。_____ 。
稀硫酸
探究二:如何简单自制发热包?
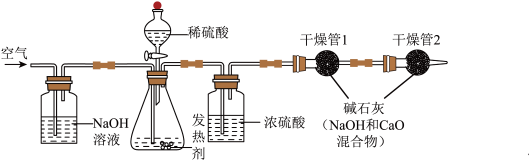
【实验测定】①实验装置如图所示。检查装置气密性。 。
。
③滴加足量的稀硫酸,待锥形瓶中无气泡产生,合理操作,称得干燥管1的质量为 ,且
,且 -
- =0.33g。
=0.33g。
(4)实验步骤③中划线处的合理操作是_____ 。
(5)若需将碳酸钠充分利用,则一包(50克)的发热包中,含有的氧化钙质量至少为_____ 。
【粗略制作】根据计算结果,将一定质量的碳酸钠粉末、氧化钙粉末(稍过量)、铝粉混合均匀,倒入无纺布袋中封口,将无纺布袋放入塑料自封袋中密封保存。
【拓展延伸】
(6)将某自制发热包加水后,反应中的温度和pH变化如图所示。下列说法错误的是_____ 。

| [品名]食品专用发热包 [主要成分]氧化钙、铝粉、碳酸钠 [净含量]150g [使用方法]抛开塑料袋后加常温水 [注意事项]使用时要远离明火,严禁在密闭场所中使用。 |
将一包撕开塑料袋后的发热包平放在烧杯底部,加入200mL常温水,插入温度计。观察到温度计示数逐渐升至92℃,冒出大量白雾,液体底部产生大量气泡。
(1)甲同学认为热量来自于氧化钙和水的反应,其反应方程式为
(2)使用方法中要求加常温水而不是热水的目的是
Ⅱ.深入探究
探究一:注意事项中为什么要求“远离明火,严禁在密闭场所中使用”?
【猜想假设】生成的气体是可燃性气体。
【查阅资料】
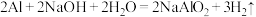 ,反应放热。
,反应放热。【进行实验】按图中①所示进行实验,发现气体无法被点燃。思考后利用改进后的②装置进行实验,观察到预期现象。
稀硫酸
探究二:如何简单自制发热包?
【实验测定】①实验装置如图所示。检查装置气密性。
 。
。③滴加足量的稀硫酸,待锥形瓶中无气泡产生,合理操作,称得干燥管1的质量为
 ,且
,且 -
- =0.33g。
=0.33g。(4)实验步骤③中划线处的合理操作是
(5)若需将碳酸钠充分利用,则一包(50克)的发热包中,含有的氧化钙质量至少为
【粗略制作】根据计算结果,将一定质量的碳酸钠粉末、氧化钙粉末(稍过量)、铝粉混合均匀,倒入无纺布袋中封口,将无纺布袋放入塑料自封袋中密封保存。
【拓展延伸】
(6)将某自制发热包加水后,反应中的温度和pH变化如图所示。下列说法错误的是

| A.反应后溶液碱性较强,有腐蚀性,所以废液不能随意丢弃 |
B. 内, 内, 上升的原因仅是氧化钙和水生成氢氧化钙 上升的原因仅是氧化钙和水生成氢氧化钙 |
C. 内, 内, 变化的原因是氢氧化钠被铝粉逐渐消耗 变化的原因是氢氧化钠被铝粉逐渐消耗 |
D. 内,随着氢氧化钙溶解度逐浙变大, 内,随着氢氧化钙溶解度逐浙变大, 上升 上升 |
您最近半年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐3】木炭还原氧化铜和一氧化碳还原氧化铜的实验装置如图所示,某兴趣小组的同学对实验做进一步探究。
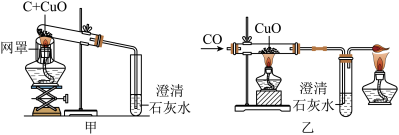
(1)图甲实验中,酒精灯上网罩的作用是___________ 。
(2)图乙实验前,先通入一段时间的CO的目的是___________ 。
【查阅资料】①木炭、一氧化碳分别与氧化铜反应也可能生成氧化亚铜(Cu2O);
②氧化亚铜是红色固体,能与稀硫酸反应:Cu2O+H2SO4=Cu+CuSO4+H2O;
③CuSO4溶液显蓝色。
【实验探究】为确定CO与CuO反应的最佳温度,小组同学利用原位X射线衍射仪来测定不同温度下图乙实验反应4小时后固体物质的成分,实验结果如图丙所示,据图回答下列问题。
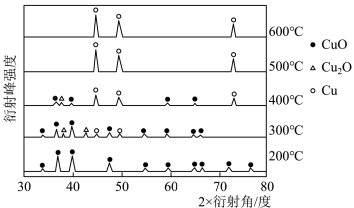
(3)600℃时,发生的反应的化学方程式为___________ 。
(4)用CO还原CuO制取纯净的Cu,反应温度要控制在___________ ℃及以上。
【拓展延伸】
(5)将图甲实验中的试管冷却后,观察到黑色固体全部变为红色。取3.6g红色固体于试管中,滴加足量________ ,充分反应,观察到_______ 时,再将试管中的物质过滤,将滤渣洗涤、干燥、称量,若称得滤渣的质量为mg,当________ (填m的范围)时,则红色固体是Cu和Cu2O的混合物。

(1)图甲实验中,酒精灯上网罩的作用是
(2)图乙实验前,先通入一段时间的CO的目的是
【查阅资料】①木炭、一氧化碳分别与氧化铜反应也可能生成氧化亚铜(Cu2O);
②氧化亚铜是红色固体,能与稀硫酸反应:Cu2O+H2SO4=Cu+CuSO4+H2O;
③CuSO4溶液显蓝色。
【实验探究】为确定CO与CuO反应的最佳温度,小组同学利用原位X射线衍射仪来测定不同温度下图乙实验反应4小时后固体物质的成分,实验结果如图丙所示,据图回答下列问题。

(3)600℃时,发生的反应的化学方程式为
(4)用CO还原CuO制取纯净的Cu,反应温度要控制在
【拓展延伸】
(5)将图甲实验中的试管冷却后,观察到黑色固体全部变为红色。取3.6g红色固体于试管中,滴加足量
您最近半年使用:0次
【推荐1】我国提出努力争取在2060年前实现“碳中和”伟大目标,充分体现了解决气候问题的大国担当。贵州某校活动小组开展了“低碳有我”科研活动,请回答下列问题。
(1)探究一:碳封存。“碳封存”技术也是实现“碳中和”的重要途径之一、某科研基地通过一定技术将二氧化碳压缩存入岩石层,实现二氧化碳的封存。从微观角度分析,这一技术能够实现的原因是___________ 。
探究二:碳捕集。该小组通过酸、碱和盐的性质来实现CO2的捕集。为比较吸收能力,小组同学设计如图1所示实验,装置a端连接气压传感器,测得烧瓶内压强与时间的关系曲线如图2所示。
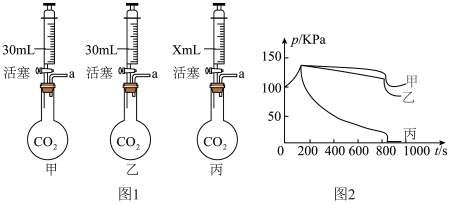
(2)图1中,甲、乙、丙注射器内的吸收试剂分别是水、饱和石灰水、氢氧化钠浓溶液,X的数值为___________ ;分析图2可吸收二氧化碳效果最好的吸收试剂是___________ 。
(3)进一步掌握碱的性质。
①氢氧化钠溶液滴加酚酞试剂的现象是___________ ,氢氧化钠溶液露置于空气中容易变质,反应的化学方程式为___________ 。
②为探究久置氢氧化钠溶液的变质程度,进行了如下实验:
【猜想与假设】猜想一:氢氧化钠溶液是部分变质
猜想二:氢氧化钠溶液是全部变质
(4)【实验过程】
【实验结论】
该氢氯化钠溶液部分变质。
【反思与评价】
(5)如何更好保护有限资源是对化学研究的要求,请你结合上述氢氧化钠溶液变质问题,简要写出除去变质的氢氧化钠溶液中的杂质和提纯得到氢氧化钠的过程:___________ 。
(1)探究一:碳封存。“碳封存”技术也是实现“碳中和”的重要途径之一、某科研基地通过一定技术将二氧化碳压缩存入岩石层,实现二氧化碳的封存。从微观角度分析,这一技术能够实现的原因是
探究二:碳捕集。该小组通过酸、碱和盐的性质来实现CO2的捕集。为比较吸收能力,小组同学设计如图1所示实验,装置a端连接气压传感器,测得烧瓶内压强与时间的关系曲线如图2所示。

(2)图1中,甲、乙、丙注射器内的吸收试剂分别是水、饱和石灰水、氢氧化钠浓溶液,X的数值为
(3)进一步掌握碱的性质。
①氢氧化钠溶液滴加酚酞试剂的现象是
②为探究久置氢氧化钠溶液的变质程度,进行了如下实验:
【猜想与假设】猜想一:氢氧化钠溶液是部分变质
猜想二:氢氧化钠溶液是全部变质
(4)【实验过程】
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量该溶液于试管中,向溶液中滴加过量的氯化钙溶液,充分反应 | 猜想一成立 | |
【实验结论】
该氢氯化钠溶液部分变质。
【反思与评价】
(5)如何更好保护有限资源是对化学研究的要求,请你结合上述氢氧化钠溶液变质问题,简要写出除去变质的氢氧化钠溶液中的杂质和提纯得到氢氧化钠的过程:
您最近半年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐2】点点和小组同学拟用水培法种植豆苗菜,为此买了市场上的通用营养液(分A、B两瓶),并开展了接下来的项目式学习。

项目一:探究营养液的成分
(1)营养液成分如上表所示,以下判断合理的是______(填字母序号)。
(2)验证营养液B中含有铵态氮肥:
【设计并实验】
项目二:探究营养液的适切性
【查阅资料】I.豆苗适宜生长的pH为6.5~7.5。
II.常见的营养液改良剂及其溶液的pH如下表:
(3)说明书中提示A、B两瓶是浓缩溶液,不能直接混合使用,必须稀释到一定浓度后才可混合使用,推测其原因是______ 。
(4)取10g营养液A,加水稀释后,溶液中溶质的质量分数为0.0945%,请问需加入水的质量是______ g。
(5)检测营养液的酸碱性
①取少量营养液A于试管中,向其中滴加几滴无色酚酞试液,观察到______ ,证明营养液A呈中性。有同学质疑该结论,他的理由应是______ 。
②经检测,A、B浓缩液按照配比稀释混合后,溶液pH为3.6,说明呈______ 性,不适用于种植豆苗。
【分析交流】
(6)若采用加入改良剂的方法来调控溶液酸碱度,肯定不能选用“查阅资料”II中的物质:______ 。
项目三:自制营养液
经研究,同学们决定利用从实验室中找到的KNO3、K2SO4、(NH4)2SO4、Na3PO4自制营养液。
已知部分酸碱盐的溶解性如下表(室温):
溶:该物质可溶于水;
不:该物质不溶于水:
徽:该物质微溶于水。
(7)不能用含Ca2+、Mg2+较多的自来水来配制营养液,请根据所给的溶解性表推测原因:______ 。
(8)配制过程中发现硫酸铵药品不足,需自制一些。请你从氢氧化钠、氨水(NH3·H2O)、盐酸、稀硫酸中选择两种药品制取硫酸铵:______ (用化学方程式表示)。
【总结反思】
(9)通过上述探究可知,配制无土栽培营养液选择物质时,除要考虑植物生长所需营养元素外,还应考虑的因素有_______ (答一条即可);同学们在水培豆苗菜的过程中不断改进营养液的配方,最终成功培植出新鲜的豆苗菜!

| 营养液A | 营养液B | |||
| 肥料名称 | 硝酸钙 | 硝酸钾 | 硫酸铵 | 磷酸二氢钙 |
| 溶质的质量分数(%) | 9.45 | 8.08 | 4.93 | 1.53 |
(1)营养液成分如上表所示,以下判断合理的是______(填字母序号)。
| A.两瓶营养液能提供N、P、K营养元素 |
| B.硝酸根离子和铵根离子都能提供氮元素 |
| C.营养液A含有大量的钙离子,它并不是植物生长所需要的营养元素 |
【设计并实验】
| 实验操作 | 实验现象 | 实验结论 |
| 取少量营养液B于试管中, | 营养液中含有铵态氮肥 |
项目二:探究营养液的适切性
【查阅资料】I.豆苗适宜生长的pH为6.5~7.5。
II.常见的营养液改良剂及其溶液的pH如下表:
| 改良剂 | 重过磷酸钙 | 熟石灰 | 草木灰 |
| 有效成分的化学式 | Ca(H2PO4)2 | Ca(OH)2 | K2CO3 |
| pH | 3.1 | 8.3 | 7.1 |
(4)取10g营养液A,加水稀释后,溶液中溶质的质量分数为0.0945%,请问需加入水的质量是
(5)检测营养液的酸碱性
①取少量营养液A于试管中,向其中滴加几滴无色酚酞试液,观察到
②经检测,A、B浓缩液按照配比稀释混合后,溶液pH为3.6,说明呈
【分析交流】
(6)若采用加入改良剂的方法来调控溶液酸碱度,肯定不能选用“查阅资料”II中的物质:
项目三:自制营养液
经研究,同学们决定利用从实验室中找到的KNO3、K2SO4、(NH4)2SO4、Na3PO4自制营养液。
已知部分酸碱盐的溶解性如下表(室温):
 | NO3- | Cl- | SO42- | PO43- |
| K+ | 溶 | 溶 | 溶 | 溶 |
| Na+ | 溶 | 溶 | 溶 | 溶 |
| Mg2+ | 溶 | 溶 | 溶 | 不 |
| Ca2+ | 溶 | 溶 | 微 | 不 |
不:该物质不溶于水:
徽:该物质微溶于水。
(7)不能用含Ca2+、Mg2+较多的自来水来配制营养液,请根据所给的溶解性表推测原因:
(8)配制过程中发现硫酸铵药品不足,需自制一些。请你从氢氧化钠、氨水(NH3·H2O)、盐酸、稀硫酸中选择两种药品制取硫酸铵:
【总结反思】
(9)通过上述探究可知,配制无土栽培营养液选择物质时,除要考虑植物生长所需营养元素外,还应考虑的因素有
您最近半年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐3】甲、乙、丙、丁四位同学在做碱溶液与酚酞作用的实验时,发现了一个意外的现象:氢氧化钠溶液中滴入几滴酚酞试液,溶液变成了红色,可是过了一会儿红色就消失了。于是他们对这一现象进行了探究。
【探究目的】探究溶液由红色变无色的原因。
【提出猜想】
甲:可能是酚酞变质造成的;
乙:可能是氢氧化钠溶液与空气中的二氧化碳反应的缘故;
丙:可能是酚酞与空气中的氧气反应,使红色消失;
丁:可能与氢氧化钠溶液浓度过大有关。
【设计与实验】
(1)甲同学的猜想遭到同学的否定,理由是:___________ 。
(2)丙同学认为乙同学的猜想也不正确,他的理由是:___________ 。
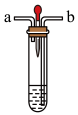
(3)为了验证丙同学的猜想,四位同学在装有该溶液的密闭试管中先通入一段时间纯净的H2,将试管内的空气排尽后滴加酚酞试液(装置如图)。氢气应由导管口___________ (选“a”或“b”)处通入。通过以上实验,四位同学观察到的现象是:溶液先变成红色,过了一会儿红色仍然消失。
(4)若丁同学的猜想正确,请大家能设计实验证明:________
【得出结论】丁同学的猜想正确,溶液褪色的原因与氢氧化钠溶液浓度过大有关。

【探究目的】探究溶液由红色变无色的原因。
【提出猜想】
甲:可能是酚酞变质造成的;
乙:可能是氢氧化钠溶液与空气中的二氧化碳反应的缘故;
丙:可能是酚酞与空气中的氧气反应,使红色消失;
丁:可能与氢氧化钠溶液浓度过大有关。
【设计与实验】
(1)甲同学的猜想遭到同学的否定,理由是:
(2)丙同学认为乙同学的猜想也不正确,他的理由是:
(3)为了验证丙同学的猜想,四位同学在装有该溶液的密闭试管中先通入一段时间纯净的H2,将试管内的空气排尽后滴加酚酞试液(装置如图)。氢气应由导管口
(4)若丁同学的猜想正确,请大家能设计实验证明:
【得出结论】丁同学的猜想正确,溶液褪色的原因与氢氧化钠溶液浓度过大有关。
您最近半年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐1】化学课堂上,同学们分小组合作探究碳酸钠的性质,请你参与探究并填空。
【实验记录与分析】
【反思与拓展】
(1)甲同学分析实验1得出:盐溶液_____ (填“一定”或“不一定”)显中性。
(2)乙同学用稀硫酸代替实验2中的稀盐酸进行探究,发现实验现象相同。从微观角度分析,这是因为稀盐酸和稀硫酸中都含有______ 。
(3)丙同学对比实验3和实验4的现象,从微观角度分析,两个反应的实质相同,溶液中相互结合的离子都是_____ 。写出实验三中反应的方程式:_____ 。
【实验记录与分析】
| 实验1 | 实验2 | 实验3 | 实验4 | |
| 实验操作 | 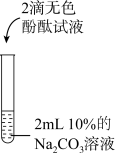 | 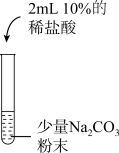 | 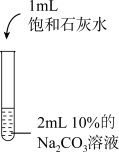 |  |
| 实验现象 | 溶液由无色变为红色 | 生成白色沉淀 | 生成白色沉淀 | |
| 实验结论 | 碳酸钠溶液显 | 碳酸钠能与盐酸发生反应 | 碳酸钠能与氢氧化钙发生反应 |
(1)甲同学分析实验1得出:盐溶液
(2)乙同学用稀硫酸代替实验2中的稀盐酸进行探究,发现实验现象相同。从微观角度分析,这是因为稀盐酸和稀硫酸中都含有
(3)丙同学对比实验3和实验4的现象,从微观角度分析,两个反应的实质相同,溶液中相互结合的离子都是
您最近半年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐2】嫩肉粉的主要成分是碳酸氢钠(NaHCO3),可破坏肉质纤维结构、促进肉类吸收水分,从而使肉质松软,达到鲜嫩爽滑的目的。小明发现将拌了嫩肉粉的肉类放到锅中加入食醋调味烧煮时产生了大量气体,她对此颇感兴趣,决定对其进行探究。
I.小明对气体的成分进行了猜测:气体中除了醋酸气体和水蒸气之外,还可能含有气体A,A是___________ 。
Ⅱ.小明对气体A的来源做了两种猜测:
猜测1:___________ ;猜测2:气体A可能是由碳酸氢钠受热分解产生的。
针对以上猜测,小明设计了以下实验:
实验结论:猜想①②都正确。
Ⅲ.实验2中,小明发现充分反应后,试管中仍留有一些白色粉末,他猜测可能是氢氧化钠或碳酸钠,请用物理、化学方法各一种进行鉴别。
(1)物理方法:___________ 。
(2)化学方法:___________ 。
I.小明对气体的成分进行了猜测:气体中除了醋酸气体和水蒸气之外,还可能含有气体A,A是
Ⅱ.小明对气体A的来源做了两种猜测:
猜测1:
针对以上猜测,小明设计了以下实验:
| 实验步骤 | 实验现象 | |
| 实验1 | ||
| 实验2 | 取碳酸氢钠样品少许加入试管中,加热使之充分反应,并把产生的气体通入澄清石灰水 | 试管口出现小水珠,澄清石灰水变浑浊 |
实验结论:猜想①②都正确。
Ⅲ.实验2中,小明发现充分反应后,试管中仍留有一些白色粉末,他猜测可能是氢氧化钠或碳酸钠,请用物理、化学方法各一种进行鉴别。
(1)物理方法:
(2)化学方法:
您最近半年使用:0次
科学探究题
|
适中
(0.65)
真题
解题方法
【推荐3】小强同学用三支试管,分别取适量的稀盐酸、澄清石灰水、碳酸钠溶液,进行相关实验探究。
步骤1:向三支试管中分别滴加酚酞后,Na2CO3溶液中显红色,说明Na2CO3溶液显_____ 性;
步骤2:小强把三支试管中的溶液同时倒入一只烧杯中,发现有气泡产生,最终有白色沉淀生成且溶液显红色;
步骤3:把烧杯中的混合物进行过滤,得到滤液,滤液中一定不含有________ 。
(选填答案:A.稀盐酸 B.澄清石灰水 C.碳酸钠溶液)
[实验猜想] 步骤3所得滤液中溶质可能为:
①NaCl、Na2CO3; ②NaCl、CaCl2和NaOH; ③NaCl、Na2CO3和NaOH; ④……
[实验验证](提示:CaCl2溶液显中性)
[反思评价] 有同学提出将CaCl2溶液改为稀盐酸,若观察到有气泡产生且红色消失,则证明猜想③成立。小刚同学认为不正确,其理由是:___________________________ 。
步骤1:向三支试管中分别滴加酚酞后,Na2CO3溶液中显红色,说明Na2CO3溶液显
步骤2:小强把三支试管中的溶液同时倒入一只烧杯中,发现有气泡产生,最终有白色沉淀生成且溶液显红色;
步骤3:把烧杯中的混合物进行过滤,得到滤液,滤液中一定不含有
(选填答案:A.稀盐酸 B.澄清石灰水 C.碳酸钠溶液)
[实验猜想] 步骤3所得滤液中溶质可能为:
①NaCl、Na2CO3; ②NaCl、CaCl2和NaOH; ③NaCl、Na2CO3和NaOH; ④……
[实验验证](提示:CaCl2溶液显中性)
| 实验操作 | 实验现象 | 实验结论 |
| 取少量滤液于试管中,加入足量CaCl2溶液 | 猜想③成立 |
[反思评价] 有同学提出将CaCl2溶液改为稀盐酸,若观察到有气泡产生且红色消失,则证明猜想③成立。小刚同学认为不正确,其理由是:
您最近半年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐1】某兴趣小组发现一袋腌制松花蛋的泥料,配料表上的成分是氧化钙、纯碱和食盐.他们要探究在腌制过程中都哪些物质对鸭蛋起作用.于是取少量泥料在水中溶解,充分搅拌后过滤,取滤液探究其成分.
【提出问题】滤液中的溶质是什么?
【猜想与假设】
甲同学猜想:可能是NaCl、Ca(OH)2、Na2CO3
乙同学猜想:可能是NaCl、NaOH、Na2CO3
丙同学猜想:可能是___________ 。
丁同学猜想:可能是NaCl、NaOH
【交流与评价】大家一致认为甲同学的猜想不成立,理由是______________ 。
【活动与探究】
【解释与结论】丁同学的结论__________ 正确(填“是”或“不”).丁同学和乙同学使用了相同的试剂,却没看到气泡产生,你认为可能的原因是___________ 。
【提出问题】滤液中的溶质是什么?
【猜想与假设】
甲同学猜想:可能是NaCl、Ca(OH)2、Na2CO3
乙同学猜想:可能是NaCl、NaOH、Na2CO3
丙同学猜想:可能是
丁同学猜想:可能是NaCl、NaOH
【交流与评价】大家一致认为甲同学的猜想不成立,理由是
【活动与探究】
| 实验步骤 | 实验现象及相关的化学方程式 | 实验结论 |
| 乙同学取一定量的滤液于试管中,向其中加入一定量的盐酸 | 大量气泡产生,写出所可能发生的一个化学反应方程式 | 乙同学的猜想成立 |
| 丙同学 | 实验现象 | 丙同学的猜想不成立 |
| 丁同学取一定量的滤液于试管中,向其中滴加少量盐酸 | 无气泡产生 | 乙同学的猜想不成立 |
您最近半年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐2】化学实验小组在探究饱和的石灰水与碳酸钠浓溶液反应时发现,将两种溶液混合后,得到的沉淀总是很少,于是对该实验进行进一步如下探究活动。
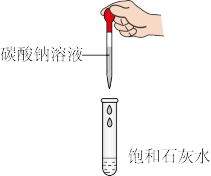
(1)写出上述反应的化学方程式___ 。得到的沉淀总是很少的原因可能是______ 。
(2)两种溶液混合充分反应后过滤,对得到的溶液的成分进行探究。
猜想一:反应后溶液中溶质是氢氧化钠;
猜想二:反应后溶液中溶质是氢氧化钠和碳酸钠;
猜想三:反应后溶液中溶质是_______ 。
(3)小组同学经过讨论,认为猜想二成立的可能性比较大,为确认猜想二成立,他们不再用含钙元素的试剂进行检验,而用三种不同类别的物质试剂进行验证,请你写出这三种不同类别物质的化学式___ 、____ 、____ 。

(1)写出上述反应的化学方程式
(2)两种溶液混合充分反应后过滤,对得到的溶液的成分进行探究。
猜想一:反应后溶液中溶质是氢氧化钠;
猜想二:反应后溶液中溶质是氢氧化钠和碳酸钠;
猜想三:反应后溶液中溶质是
(3)小组同学经过讨论,认为猜想二成立的可能性比较大,为确认猜想二成立,他们不再用含钙元素的试剂进行检验,而用三种不同类别的物质试剂进行验证,请你写出这三种不同类别物质的化学式
您最近半年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐3】某农村中学的化学兴趣小组在开展实验活动时,利用山泉水配制氢氧化钠溶液,结果几次配制所得的溶液都出现浑浊的现象,放置一段时间后,容器底部还出现白色沉淀物。该兴趣小组的同学针对此奇异的现象展开如下探究:
提出问题:用山泉水配制氢氧化钠溶液为什么会出现浑浊?白色沉淀物是什么物质?
作出猜想:Ⅰ、氢氧化钠样品不纯,含不溶性杂质;
Ⅱ、氢氧化钠与溶解在山泉水中的某物质发生反应生成难溶于水的物质。
(1)小明通过实验很快就排除了猜想Ⅰ,他的实验是_____ 。
查阅资料:本地山泉水是硬水,含较多的碳酸氢钙,碳酸氢钙[Ca(HCO3)2]受热会分解,也能与氢氧化钠反应,且都有碳酸钙生成。
(2)小红取来少量的山泉水于烧杯中,往其中加入适量的肥皂水,搅拌,观察到_____ 的现象,确认所取的山泉水是硬水。
(3)小明和小红取含有碳酸钙的沉淀物进行实验:取少量的沉淀物,加入适量的稀盐酸,实验现象是_____ ,反应的化学方程式是_____ 。
(4)该山泉水经过_____ (填操作名称),就可用于配制氢氧化钠溶液。
提出问题:用山泉水配制氢氧化钠溶液为什么会出现浑浊?白色沉淀物是什么物质?
作出猜想:Ⅰ、氢氧化钠样品不纯,含不溶性杂质;
Ⅱ、氢氧化钠与溶解在山泉水中的某物质发生反应生成难溶于水的物质。
(1)小明通过实验很快就排除了猜想Ⅰ,他的实验是
查阅资料:本地山泉水是硬水,含较多的碳酸氢钙,碳酸氢钙[Ca(HCO3)2]受热会分解,也能与氢氧化钠反应,且都有碳酸钙生成。
(2)小红取来少量的山泉水于烧杯中,往其中加入适量的肥皂水,搅拌,观察到
(3)小明和小红取含有碳酸钙的沉淀物进行实验:取少量的沉淀物,加入适量的稀盐酸,实验现象是
(4)该山泉水经过
您最近半年使用:0次



