实验室使用较浓的盐酸制得的 通入澄清石灰水中,发现没有变浑浊。圳圳同学发现问题后,在老师指导下设计如下实验进行探究。
通入澄清石灰水中,发现没有变浑浊。圳圳同学发现问题后,在老师指导下设计如下实验进行探究。
【查阅资料】
① 通入
通入 溶液无沉淀产生,氯化氢(
溶液无沉淀产生,氯化氢( )通入
)通入 溶液中产生沉淀。
溶液中产生沉淀。
②纯净的 气体通入饱和
气体通入饱和 溶液几乎不溶解,且不发生反应。
溶液几乎不溶解,且不发生反应。
【提出问题】为什么实验制得的 通入澄清石灰水中不变浑浊?
通入澄清石灰水中不变浑浊?
【提出猜想】
猜想一:澄清石灰水可能变质了。
猜想二:制取的 气体中可能含有其他气体。
气体中可能含有其他气体。
【实验探究】
(1)探究一:澄清石灰水是否变质
(2)探究二:制取的气体中是否含有其他气体
①将制取的气体通过盛有饱和NaHCO3溶液的装置A、B中,再通过装置C中的澄清石灰水,澄清石灰水变洋浊了;则CO2气体中含有其他气体。
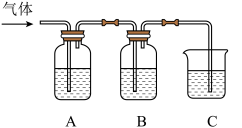
②将制取的 气体通入
气体通入 溶液中,产生白色沉淀,则说明该
溶液中,产生白色沉淀,则说明该 气体中混有
气体中混有_____ (填写化学式),B中饱和 溶液的作用是
溶液的作用是_____ 。
③写出探究二步骤①中该气体通过A装置发生反应的化学方程式_____ ,该反应基本类型是_____ 。
 通入澄清石灰水中,发现没有变浑浊。圳圳同学发现问题后,在老师指导下设计如下实验进行探究。
通入澄清石灰水中,发现没有变浑浊。圳圳同学发现问题后,在老师指导下设计如下实验进行探究。【查阅资料】
①
 通入
通入 溶液无沉淀产生,氯化氢(
溶液无沉淀产生,氯化氢( )通入
)通入 溶液中产生沉淀。
溶液中产生沉淀。②纯净的
 气体通入饱和
气体通入饱和 溶液几乎不溶解,且不发生反应。
溶液几乎不溶解,且不发生反应。【提出问题】为什么实验制得的
 通入澄清石灰水中不变浑浊?
通入澄清石灰水中不变浑浊?【提出猜想】
猜想一:澄清石灰水可能变质了。
猜想二:制取的
 气体中可能含有其他气体。
气体中可能含有其他气体。【实验探究】
(1)探究一:澄清石灰水是否变质
| 实验操作 | 实验现象 | 结论 |
取 该澄清石灰水于洁净的试管中 该澄清石灰水于洁净的试管中并逐滴加入  溶液 溶液 | 澄消石灰水变浑浊 | 发生该反应的化学方程式: 澄清石灰水 |
①将制取的气体通过盛有饱和NaHCO3溶液的装置A、B中,再通过装置C中的澄清石灰水,澄清石灰水变洋浊了;则CO2气体中含有其他气体。

②将制取的
 气体通入
气体通入 溶液中,产生白色沉淀,则说明该
溶液中,产生白色沉淀,则说明该 气体中混有
气体中混有 溶液的作用是
溶液的作用是③写出探究二步骤①中该气体通过A装置发生反应的化学方程式
更新时间:2023-07-10 13:55:16
|
相似题推荐
科学探究题
|
适中
(0.65)
解题方法
【推荐1】小军同学在学习酸碱盐有关知识时,对一些沉淀物质的颜色产生了兴趣。老师告诉他氢氧化铜是蓝色、氢氧化铁是红褐色,让他自己探究氢氧化亚铁的颜色。下面请你和他一起探究。
[查阅资料]
①铁有两种氢氧化物,它们可以分别由相对应的可溶性盐与碱溶液反应而制得。
②氢氧化亚铁在空气中立即被氧化。
③硫酸铜溶液是蓝色,硫酸亚铁溶液是浅绿色。
[提出猜想]氢氧化亚铁是浅绿色。
[实验过程]在2支试管里分别加入少量FeCl3和FeSO4溶液,然后滴入NaOH溶液,观察现象。请补充完成下表:
[学习交流]
(1)氢氧化亚铁是_______ 色而不是浅绿色。
(2)小军联系到CO2与C的反应,认为FeCl3溶液可以转化为FeCl2溶液。你认为小军的理由是____ 。化学方程式为_______ 。
[查阅资料]
①铁有两种氢氧化物,它们可以分别由相对应的可溶性盐与碱溶液反应而制得。
②氢氧化亚铁在空气中立即被氧化。
③硫酸铜溶液是蓝色,硫酸亚铁溶液是浅绿色。
[提出猜想]氢氧化亚铁是浅绿色。
[实验过程]在2支试管里分别加入少量FeCl3和FeSO4溶液,然后滴入NaOH溶液,观察现象。请补充完成下表:
| FeCl3溶液 | FeSO4溶液 | |
| 滴入NaOH溶液的现象 | 生成红褐色沉淀 | 先生成白色絮状沉淀,迅速变成灰绿色,最后变成红褐色沉淀。 |
| 化学方程式 | FesO4+2NaOH=Fe(OH)2↓+Na2SO4 |
(1)氢氧化亚铁是
(2)小军联系到CO2与C的反应,认为FeCl3溶液可以转化为FeCl2溶液。你认为小军的理由是
您最近一年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐2】碳酸钠、碳酸氢钠是我们初中化学中两种常见的碳酸盐,它们与酸反应的情形非常相似。两者与酸反应有区别吗?某研究小组通过控制变量法设计实验进行探究。
【实验1】:同时将40mL8%的稀盐酸(足量)分别倒入装有2克碳酸钠和碳酸氢钠的锥形瓶甲和锥形瓶乙中(如图)。______ 。
(2)探究甲、乙锥形瓶中化学反应速率,可采取的方法是______ 。
【实验2】:在两个锥形瓶中分别加入2g碳酸钠粉末,然后向其中一个锥形瓶中倒入20mL的蒸馏水,向另一个锥形瓶中倒入20mL质量分数15%的稀盐酸(足量),利用温度传感器测定其温度变化(如图a)。另取2g碳酸氢钠粉末,重复上述实验(如图b)。______ (选填“吸收”或“放出”)热量。
(4)从两种粉末状固体溶于水及与酸反应过程的能量变化判断,反应速率快的固体物质是______ (选填Na2CO3或NaHCO3)。
(5)该实验中,相同质量固体与足量稀盐酸反应结束产生的二氧化碳的量:Na2CO3______ NaHCO3(选填“>”、“<”或“=”)。
【实验3】
(6)研究小组还想继续通过实验检测二者的碱性强弱,请你设计一种简单的实验方法______ (只写方法,不写实验过程)。
Na2CO3和NaHCO3溶液均呈碱性,但在物质分类上不属于碱。以Na2CO3为例,它的水溶液为什么会呈碱性呢?
(7)Na2CO3在水溶液中呈离子状态:其实水本身也会分解为一小部分离子,请写出水分解会产生的阴阳两种离子符号______ 。
(8)Na2CO3在水溶液中的离子与水本身分解产生的离子,从复分解反应离子交换特征思考,会生成少量新物质。请你继续分析Na2CO3溶液呈碱性的原因______ 。
【实验1】:同时将40mL8%的稀盐酸(足量)分别倒入装有2克碳酸钠和碳酸氢钠的锥形瓶甲和锥形瓶乙中(如图)。

(2)探究甲、乙锥形瓶中化学反应速率,可采取的方法是
【实验2】:在两个锥形瓶中分别加入2g碳酸钠粉末,然后向其中一个锥形瓶中倒入20mL的蒸馏水,向另一个锥形瓶中倒入20mL质量分数15%的稀盐酸(足量),利用温度传感器测定其温度变化(如图a)。另取2g碳酸氢钠粉末,重复上述实验(如图b)。

(4)从两种粉末状固体溶于水及与酸反应过程的能量变化判断,反应速率快的固体物质是
(5)该实验中,相同质量固体与足量稀盐酸反应结束产生的二氧化碳的量:Na2CO3
【实验3】
(6)研究小组还想继续通过实验检测二者的碱性强弱,请你设计一种简单的实验方法
Na2CO3和NaHCO3溶液均呈碱性,但在物质分类上不属于碱。以Na2CO3为例,它的水溶液为什么会呈碱性呢?
(7)Na2CO3在水溶液中呈离子状态:其实水本身也会分解为一小部分离子,请写出水分解会产生的阴阳两种离子符号
(8)Na2CO3在水溶液中的离子与水本身分解产生的离子,从复分解反应离子交换特征思考,会生成少量新物质。请你继续分析Na2CO3溶液呈碱性的原因
您最近一年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐3】请回忆你和老师共同完成的酸和碱反应的实验探究,并按下列要求进行实验的设计与分析:
(1)请你依据下图设计一个酸和碱反应的探究实验:

(2)我选取BaCl2、酚酞、紫色石蕊三种溶液设计实验,分别探究上述酸、碱反应后烧杯中的硫酸是否过量,请你根据下表帮我判断正确的实验方案及分析方案错误的原因:
① 设计的三个方案中,有一个正确的方案是:方案 __________________ 。
②请分析另外两个方案,错误的原因:一个方案错误的原因是___________ 。另一方案错误的原因是 _____________ 。
(1)请你依据下图设计一个酸和碱反应的探究实验:

| 实验步骤 | 实验现象 | 结论 |
| ①向烧杯中加入10 mL氢氧化钠溶液,并滴入几滴酚酞溶液; ②再用滴管慢慢滴入稀硫酸,并不断搅拌溶液 | ①溶液颜色 ②不断搅拌溶液至溶液颜色恰好变成 | 酸和碱发生了中和反应,该反应属四种基本反应类型中的 |
| 实验方案 | 实验步骤 | 实验现象 | 实验结论 |
| 方案一 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 硫酸过量 |
| 方案二 | 取样,滴入几滴无色酚酞溶液 | 酚酞溶液不变色 | 酸、碱恰好反应 |
| 方案三 | 取样,滴入几滴紫色石蕊溶液 | 溶液变红 | 硫酸过量 |
②请分析另外两个方案,错误的原因:一个方案错误的原因是
您最近一年使用:0次
科学探究题
|
适中
(0.65)
名校
解题方法
【推荐1】化学老师将包有过氧化钠(Na2O2)粉末的脱脂棉放在石棉网上,向棉花上滴了几滴水,棉花立刻燃烧了起来。同学们产生了浓厚的兴趣,为什么脱脂棉会燃烧起来呢?

【提出猜想】
(1)a、小明认为过氧化钠(Na2O2)与水反应生成了可以支持燃烧的物质。
b、小刚又根据燃烧的条件,对小明的猜想进行了补充:___________ 。
【实验与分析】
(2)同学们设计了图乙的实验装置。
①打开分液漏斗的活塞,控制水滴加的速度,看到试管中有气泡产生,将带火星的木条靠近P出口,看到木条复燃,你推测此气体是___________ 。
②实验中还观察到,烧杯中的导气管口有气泡冒出,产生这一现象的原因是___________ 。
③完成了以上实验,老师介绍该反应的产物一共有两种,于是同学们又展开了进一步的研究,继续探究反应后生成的另一种物质。请你回答:另一种产物必含的元素是___________ 。
【老师介绍】
(3)过氧化钠不仅可以和水发生反应,也可以和二氧化碳反应,也能生成氧气。因此,过氧化钠经常被用于潜水艇提供氧气。请你写出:实验室检验二氧化碳的方程式___________ 。
【补充实验】
(4)明确了以上性质,小芳同学又设计了一个实验(如图丙):
将一团包有过氧化钠的粉末的棉花塞到漏斗的管中,漏斗下方点燃一支短蜡烛(蜡烛火焰与棉花不接触)。请回答:棉花___________ (填“能”或“不能”)燃烧。这主要是因为蜡烛燃烧生成能与过氧化钠(Na2O2)反应的物质___________ ,同时反应放热。

【提出猜想】
(1)a、小明认为过氧化钠(Na2O2)与水反应生成了可以支持燃烧的物质。
b、小刚又根据燃烧的条件,对小明的猜想进行了补充:
【实验与分析】
(2)同学们设计了图乙的实验装置。
①打开分液漏斗的活塞,控制水滴加的速度,看到试管中有气泡产生,将带火星的木条靠近P出口,看到木条复燃,你推测此气体是
②实验中还观察到,烧杯中的导气管口有气泡冒出,产生这一现象的原因是
③完成了以上实验,老师介绍该反应的产物一共有两种,于是同学们又展开了进一步的研究,继续探究反应后生成的另一种物质。请你回答:另一种产物必含的元素是
【老师介绍】
(3)过氧化钠不仅可以和水发生反应,也可以和二氧化碳反应,也能生成氧气。因此,过氧化钠经常被用于潜水艇提供氧气。请你写出:实验室检验二氧化碳的方程式
【补充实验】
(4)明确了以上性质,小芳同学又设计了一个实验(如图丙):
将一团包有过氧化钠的粉末的棉花塞到漏斗的管中,漏斗下方点燃一支短蜡烛(蜡烛火焰与棉花不接触)。请回答:棉花
您最近一年使用:0次
【推荐2】多种物质都可催化过氧化氢分解,如MnO2, CuSO4等,实验小组的同学探究漂白液(主要成分是NaClO和NaCl),FeCl3、K2SO4能否催化过氧化氢分解
(1)MnO2催化过氧化氢分解的文字表达式是______ 。
(2)如图所示,分别向三支试管中多次加入5%过氧化氢溶液,每次2mL,如有气泡产生,则将______ 伸入试管,检验是否有氧气生成。结果如下表。

(3)下列物质中,也可能是过氧化氢分解的催化剂的是______(填标号)。
(4)探究不同催化剂催化效果的实验方案:将等体积5%过氧化氢溶液加到不同催化剂中,比较用排水法收集50mL氧气的快慢。请从下图中选择合适的仪器(每种仪器限用一次),组成该探究的完整实验装置,不需要用到的是______ (填标号)。

(1)MnO2催化过氧化氢分解的文字表达式是
(2)如图所示,分别向三支试管中多次加入5%过氧化氢溶液,每次2mL,如有气泡产生,则将

| 研究对象 | 第1次 | 第2次 | 第3次 | 第4次 |
| 漂白液 | 大量气泡 | 较多气泡 | 少量气泡 | 无气泡 |
| FeCl3溶液 | 较多气泡 | 较多气泡 | 较多气泡 | 较多气泡 |
| K2SO4溶液 | ||||
| 实验结论 | i、实验中产生的气体都是氧气 (查阅得知: 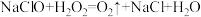 ) )ii、K2SO4不能催化过氧化氢分解。 iii、 Iv、…… | |||
| A.CuCl2 | B.Fe2(SO4)3 | C.Na2SO4 | D.KCl |

您最近一年使用:0次
科学探究题
|
适中
(0.65)
名校
解题方法
【推荐3】电石的成分为碳化钙(CaC2),实验室常用电石和水反应制取乙炔(C2H2)气体,同时还生成一种碱,请回答下列问题:
(1)请写出碳化钙和水反应的化学方程式______ 。
(2)某校实验室有一瓶久置的碳化钙,我校化学兴趣小组的同学欲探究该久置的碳化钙的组成。请你一起完成实验
【作出假设】
猜想Ⅰ:碳化钙
猜想Ⅱ:碳化钙、氢氧化钙
猜想Ⅲ:碳酸钙
猜想Ⅳ:氢氧化钙、碳酸钙
猜想Ⅴ:______
【实验验证】
(3)请写出步骤2中的产生气泡的化学方程式______ 。
(4)根据上述碳化钙的性质的描述。你认为保存电石时应该______ 。
(1)请写出碳化钙和水反应的化学方程式
(2)某校实验室有一瓶久置的碳化钙,我校化学兴趣小组的同学欲探究该久置的碳化钙的组成。请你一起完成实验
【作出假设】
猜想Ⅰ:碳化钙
猜想Ⅱ:碳化钙、氢氧化钙
猜想Ⅲ:碳酸钙
猜想Ⅳ:氢氧化钙、碳酸钙
猜想Ⅴ:
【实验验证】
| 步骤 | 实验操作 | 实验现象 | 实验结论 |
| 步骤1 | 取样,向样品中加入足量的水 | 猜想Ⅲ、Ⅳ不成立 | |
| 步骤2 | 将步骤1的悬浊液过滤,向滤渣中加稀盐酸 | 有气泡产生 | 猜想Ⅴ |
(4)根据上述碳化钙的性质的描述。你认为保存电石时应该
您最近一年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐1】在学习第七单元《燃烧与灭火》时,有同学提出:只有氧气才能支持燃烧吗?某学习小组对这个问题进行如下探究。
【查阅资料】钠是一种银白色的金属,能与空气中的氧气与水蒸气反应。

【提出问题1】除氧气外,是否还有其他物质也能支持燃烧?
【进行实验一】如图,向盛有金属钠(Na)的硬质玻璃管中通入纯净、干燥的CO2,当观察到澄清石灰水中刚好出现浑浊时,点燃酒精灯,同时继续缓缓通入CO2,钠剧烈燃烧,产生白烟,燃烧结束后玻璃管中有黑色颗粒和白色固体生成。
【得出结论】二氧化碳______ (“能”或“不能”)支持某些物质燃烧。
【反思评价】点燃酒精灯前,要先向玻璃管中通一会儿二氧化碳,其目的______ 。
【提出问题2】黑色颗粒和白色固体是什么?
【猜想与假设】黑色颗粒可能是______ (用化学式填写)。
【进行实验二】现象:黑色颗粒逐渐减少,澄清石灰水变浑浊。请写出澄清石灰水变浑浊的化学方程式______ 。
【得出结论】实验二证明:黑色颗粒的猜想是正确的。
某同学对白色固体的成分做出猜想:(Ⅰ)碳酸钠(Ⅱ)氢氧化钠。
他认为猜想Ⅱ一定是错误的,理由是______ 。
【查阅资料】钠是一种银白色的金属,能与空气中的氧气与水蒸气反应。

【提出问题1】除氧气外,是否还有其他物质也能支持燃烧?
【进行实验一】如图,向盛有金属钠(Na)的硬质玻璃管中通入纯净、干燥的CO2,当观察到澄清石灰水中刚好出现浑浊时,点燃酒精灯,同时继续缓缓通入CO2,钠剧烈燃烧,产生白烟,燃烧结束后玻璃管中有黑色颗粒和白色固体生成。
【得出结论】二氧化碳
【反思评价】点燃酒精灯前,要先向玻璃管中通一会儿二氧化碳,其目的
【提出问题2】黑色颗粒和白色固体是什么?
【猜想与假设】黑色颗粒可能是
【进行实验二】现象:黑色颗粒逐渐减少,澄清石灰水变浑浊。请写出澄清石灰水变浑浊的化学方程式
【得出结论】实验二证明:黑色颗粒的猜想是正确的。
某同学对白色固体的成分做出猜想:(Ⅰ)碳酸钠(Ⅱ)氢氧化钠。
他认为猜想Ⅱ一定是错误的,理由是
您最近一年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐2】同学们利用假日去参观博物馆,发现一些青铜器(铜、锡合金)表面呈绿色。老师告诉他们,这是铜器长期暴路在空气中生成了铜锈的结果。为了弄清这种绿色铜锈的元素组成,回来后,他们在实验室进行了如下探究:

[查阅资料](1)铜锈俗称铜绿,受热易分解。
(2)无水硫酸铜是一种白色粉末,化学式为CuSO4,遇水变蓝,通常实验用作证明有无水分存在。
[实验设计1]采用如图装置进行实验。
[实验步骤]
(1)检查装置的气密性;
(2)装药品:
(3)固定、连接仪器;盛有铜绿的试管应_____ 固定在铁架台上;
(4)点燃酒精灯;
(5)停止加热。
[实验现象](1)B中观察到的现象为_____ ,证明铜绿受热生成了水。
(2)C中观察到澄清石灰水变浑浊,化学方程式为_____ 。
加热一会儿后,A试管中观察到固体由绿色变为黑色。生成的黑色物质是什么呢?他们进一步进行探究:
[实验设计2]
[实验结论]铜绿中含有_____ 元素。
[交流与反思]B与C装置能否互换位置,请说明原因:_____ 。

[查阅资料](1)铜锈俗称铜绿,受热易分解。
(2)无水硫酸铜是一种白色粉末,化学式为CuSO4,遇水变蓝,通常实验用作证明有无水分存在。
[实验设计1]采用如图装置进行实验。
[实验步骤]
(1)检查装置的气密性;
(2)装药品:
(3)固定、连接仪器;盛有铜绿的试管应
(4)点燃酒精灯;
(5)停止加热。
[实验现象](1)B中观察到的现象为
(2)C中观察到澄清石灰水变浑浊,化学方程式为
加热一会儿后,A试管中观察到固体由绿色变为黑色。生成的黑色物质是什么呢?他们进一步进行探究:
[实验设计2]
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量A中的黑色固体于试管中,加入足量的 | 黑色固体消失, | 黑色固体是氧化铜 |
[交流与反思]B与C装置能否互换位置,请说明原因:
您最近一年使用:0次
科学探究题
|
适中
(0.65)
真题
解题方法
【推荐3】水蒸气通过灼热的焦炭后得到的混合气体有哪些成分?某化学兴趣小组在老师的指导下,对此进行了实验探究。
【提出猜想】
1.该混合气体只含有一氧化碳、氢气
2.该混合气体含有一氧化碳、二氧化碳、氢气和水蒸气
3.该混合气体只含有二氧化碳、氢气和水蒸气
4.该混合气体只含有一氧化碳、二氧化碳和氢气
【查阅资料】
a.无水硫酸铜遇水由白色变为蓝色。
b.碱石灰是固体氢氧化钠和氧化钙的混合物。
c.浓硫酸具有强烈的吸水性,常用作某些气体的干燥剂
【实验过程】同学们在老师的指导下设计了如下图所示装置,并进行了实验(部分夹持仪器已略去)。

(1)装置A中无水硫酸铜变蓝,装置B中澄清石灰水变浑浊,由此得出的结论为混合气体中有_________ 。B中变化的化学方程式为 ___________________________ 。
(2)装置C中的药品为_________ 。
(3)E中氧化铜变红、F中无水硫酸铜变蓝、G中澄清石灰水变浑浊,说明混合气体中还存在的气体是__________ ; E中的变化说明氧化铜具有 _________ 性。
【实验结论】猜想______ 正确。
【实验反思】
经过讨论,同学们将上图中装置C~H进行了简化,只 用下图所示装置并自选必要试剂就能完成探究。其中,干燥管中碱石灰的作用为___________________ , 烧杯上能观察到的现象是 _____________ 。最后一步的实验操作及现象是 __________________________ 。

【提出猜想】
1.该混合气体只含有一氧化碳、氢气
2.该混合气体含有一氧化碳、二氧化碳、氢气和水蒸气
3.该混合气体只含有二氧化碳、氢气和水蒸气
4.该混合气体只含有一氧化碳、二氧化碳和氢气
【查阅资料】
a.无水硫酸铜遇水由白色变为蓝色。
b.碱石灰是固体氢氧化钠和氧化钙的混合物。
c.浓硫酸具有强烈的吸水性,常用作某些气体的干燥剂
【实验过程】同学们在老师的指导下设计了如下图所示装置,并进行了实验(部分夹持仪器已略去)。

(1)装置A中无水硫酸铜变蓝,装置B中澄清石灰水变浑浊,由此得出的结论为混合气体中有
(2)装置C中的药品为
(3)E中氧化铜变红、F中无水硫酸铜变蓝、G中澄清石灰水变浑浊,说明混合气体中还存在的气体是
【实验结论】猜想
【实验反思】
经过讨论,同学们将上图中装置C~H进行了简化,只 用下图所示装置并自选必要试剂就能完成探究。其中,干燥管中碱石灰的作用为

您最近一年使用:0次
【推荐1】某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验。向烧杯中的氢氧化钙溶液滴加一定量的稀盐酸后,发现忘记滴加指示剂,此时,他们停止滴加稀盐酸,并对烧杯内溶液中溶质的成分进行探究。
Ⅰ 写出该反应的化学方程式:________ 。
Ⅱ 探究烧杯内溶液中溶质成分。
【提出问题】该烧杯内溶液中的溶质是什么?
【作出猜想】猜想一:CaCl2 猜想二:CaCl2、Ca(OH)2 猜想三:_______ 。
【查阅资料】CaCl2溶液呈中性。
【进行实验】(1)取少量烧杯中的溶液于试管中,并向试管中滴加几滴氯化铁溶液,振荡,观察到没有______ 色沉淀产生,于是排除了猜想二。
(2)小宇想用碳酸钠溶液来验证猜想一、三,请你帮他完成实验,填写以下表格。
【反思交流】
(1)为确定猜想三正确,下列几种实验方案还可行的是________ (填字母序号)。
A 取少量烧杯中的溶液于试管中,加入镁粉冒气泡
B 取少量烧杯中的溶液于试管中,加入硝酸银溶液,生成白色沉淀
C 取少量烧杯中的溶液于试管中,滴加紫色石蕊试液变红色
D 取少量烧杯中的溶液于试管中,加入几滴滴有酚酞的NaOH的溶液,试管内溶液依然呈无色
(2)若猜想三正确,则在验证过程中下列有关溶液pH值的变化曲线正确的是_________ 。

Ⅰ 写出该反应的化学方程式:
Ⅱ 探究烧杯内溶液中溶质成分。
【提出问题】该烧杯内溶液中的溶质是什么?
【作出猜想】猜想一:CaCl2 猜想二:CaCl2、Ca(OH)2 猜想三:
【查阅资料】CaCl2溶液呈中性。
【进行实验】(1)取少量烧杯中的溶液于试管中,并向试管中滴加几滴氯化铁溶液,振荡,观察到没有
(2)小宇想用碳酸钠溶液来验证猜想一、三,请你帮他完成实验,填写以下表格。
| 实验步骤 | 现象 | 结论 |
| 取少量烧杯中的溶液于试管中,逐滴加入Na2CO3溶液至过量 | 只产生 | 猜想一正确 |
| 猜想三正确 |
(1)为确定猜想三正确,下列几种实验方案还可行的是
A 取少量烧杯中的溶液于试管中,加入镁粉冒气泡
B 取少量烧杯中的溶液于试管中,加入硝酸银溶液,生成白色沉淀
C 取少量烧杯中的溶液于试管中,滴加紫色石蕊试液变红色
D 取少量烧杯中的溶液于试管中,加入几滴滴有酚酞的NaOH的溶液,试管内溶液依然呈无色
(2)若猜想三正确,则在验证过程中下列有关溶液pH值的变化曲线正确的是

您最近一年使用:0次
【推荐2】某化学兴趣小组为探究氢氧化钠的性质,进行了如下系列实验。

(1)实验②:向试管中滴入紫色石蕊溶液后,试管内溶液变成____ 色。
(2)实验④:当滴加稀盐酸至溶液显无色时,此时溶液中的溶质:一定含有的氯化钠,还可能含的溶质有_____ (填化学式)。为检验可能含有的溶质,选用下列哪些试剂可达到检验目的_____ (填字母代号)。
A. AgNO3溶液 B. CuO C. Fe
(3)实验⑤:写出观察到蓝色沉淀的化学反应方程式______ 。
(4)实验⑥⑦为用软矿泉水瓶所做的对比实验,装氢氧化钠溶液的软矿泉水瓶变瘪更明显,原因是______ (用化学方程式表示)。
(5)判断一个反应能否进行,可以检验反应物的消失,也可以检验生成物的存在,请你设计实验方案证明⑥试管中有新物质的生成:______ (写出操作及其现象)。

(1)实验②:向试管中滴入紫色石蕊溶液后,试管内溶液变成
(2)实验④:当滴加稀盐酸至溶液显无色时,此时溶液中的溶质:一定含有的氯化钠,还可能含的溶质有
A. AgNO3溶液 B. CuO C. Fe
(3)实验⑤:写出观察到蓝色沉淀的化学反应方程式
(4)实验⑥⑦为用软矿泉水瓶所做的对比实验,装氢氧化钠溶液的软矿泉水瓶变瘪更明显,原因是
(5)判断一个反应能否进行,可以检验反应物的消失,也可以检验生成物的存在,请你设计实验方案证明⑥试管中有新物质的生成:
您最近一年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐3】松花蛋是我国特有的一种传统美食。某课外活动小组的同学对“松花蛋制作”进行了如下探究。
探究一:松花蛋的酸碱性。
(1)同学们取少量松花蛋粉(用于制作松花蛋泥的原料),加入足量水,搅拌,过滤。在滤液中滴入______ ,滤液变红色,证明滤液中含有碱性物质。此时滤液的pH______ (填“>”“<”或“=”)7。
探究二:滤液中的碱性物质。
【提出问题】滤液中的碱性物质是什么?
【查阅资料】松花蛋粉中主要含有生石灰、食盐、纯碱(Na2CO3)等。
【分析推理】
(2)松花蛋粉加水调和时发生如下反应: ,
,______ (写化学方程式)。
【提出猜想】
(3)猜想一:只有NaOH;猜想二:有NaOH和Ca(OH)2;猜想三:有______ 。
【实验探究】
(4)
【项目拓展】
(5)为了使松花蛋产生美丽的松花,传统工艺中加入密陀僧(主要成分为氧化铅),目前密陀僧已逐渐被硫酸锌取代,制得无铅松花蛋。从人体健康角度分析,这一工艺改进的原因是既能防止______ ,又能补充人体所需的锌元素。
探究一:松花蛋的酸碱性。
(1)同学们取少量松花蛋粉(用于制作松花蛋泥的原料),加入足量水,搅拌,过滤。在滤液中滴入
探究二:滤液中的碱性物质。
【提出问题】滤液中的碱性物质是什么?
【查阅资料】松花蛋粉中主要含有生石灰、食盐、纯碱(Na2CO3)等。
【分析推理】
(2)松花蛋粉加水调和时发生如下反应:
 ,
,【提出猜想】
(3)猜想一:只有NaOH;猜想二:有NaOH和Ca(OH)2;猜想三:有
【实验探究】
(4)
| 操作 | 现象 | 结论 |
| 取滤液少许,向其中加入过量的稀盐酸 | 无明显现象 | 猜想 |
| 另取滤液少许,向其中加入 | 猜想 |
【项目拓展】
(5)为了使松花蛋产生美丽的松花,传统工艺中加入密陀僧(主要成分为氧化铅),目前密陀僧已逐渐被硫酸锌取代,制得无铅松花蛋。从人体健康角度分析,这一工艺改进的原因是既能防止
您最近一年使用:0次



