空气中氧气含量测定的再认识
Ⅰ
(1)1774年,法国化学家拉瓦锡通过用金属汞在空气中加热生成氧化汞等实验,第一次明确得出空气是由氧气和氮气组成的结论,该反应的符号表达式为_____ 。
Ⅱ.用红磷测定空气中氧气的含量。
(2)请写出红磷在空气中燃烧的化学表达式_____ 。
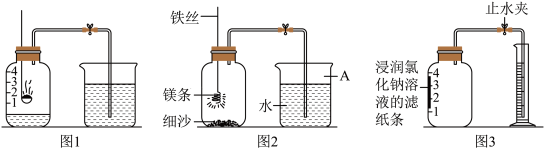
(3)如图1所示进行实验,测得空气中氧气的含量小于1∕5,可能的原因是_____(填序号)。
Ⅲ.用镁条测定空气中氧气的含量。
(4)请写出镁条在氧气中燃烧的化学表达式_____ 。
(5)某同学利用图2实验测定空气中氧气含量时发现,产物中还出现少许黄色固体。已知:镁能与氮气反应生成淡黄色的氮化镁(Mg3N2)固体。但在空气中燃烧镁条时很难观察到生成物中有淡黄色固体,原因是_____ 。在操作规范的情况下,该同学实验所测得的氧气体积分数_____ 1/5(填“大于”、“小于”或“等于”)。
Ⅳ.用铁粉测定空气中氧气的含量。
(6)已知铁常温下与空气中的氧气、水反应生成铁锈(主要成分是Fe2O3﹒xH2O)。试写出生活中防止铁生锈的一种方法是_____ 。
(7)某同学根据铁生锈的原理,用铁粉测定空气中氧气的含量,设计了如图3实验,8分钟后测得数据如表:
实验时该同学不是将铁粉堆在瓶底,而是将铁粉撒在浸润了氯化钠溶液的滤纸条上,再把该滤纸条贴在广口瓶内侧,其目的是_____ 。根据表中数据计算得出空气中氧气的体积分数为_____ (结果保留到0.1%)。与用红磷燃烧的方法相比,用该方法测定空气中氧气的含量的主要优点一是没有污染,二是_____ 。
V.拓展应用
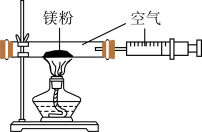
(8)取7.2g镁条在O2和N2的混合气体中完全燃烧,所得固体质量为ag,则a的取值范围是_____ g<ag<12g。
(9)已知:Fe2O3固体在一定的高温下能分解为一种复杂的铁的氧化物和一种气体。该气体可以用_____ 来检验。现将32.0gFe2O3固体加热到该温度下,发现固体质量减少了1.6g后质量不再改变。请回答:32.0gFe2O3固体中含有铁元素_____ g,该温度下复杂的铁的氧化物的化学式为_____ 。

Ⅰ
(1)1774年,法国化学家拉瓦锡通过用金属汞在空气中加热生成氧化汞等实验,第一次明确得出空气是由氧气和氮气组成的结论,该反应的符号表达式为
Ⅱ.用红磷测定空气中氧气的含量。
(2)请写出红磷在空气中燃烧的化学表达式
(3)如图1所示进行实验,测得空气中氧气的含量小于1∕5,可能的原因是_____(填序号)。
| A.燃烧匙伸入集气瓶太慢 | B.红磷量不足 |
| C.实验中发现导管口有气泡冒出 | D.装置漏气 |
Ⅲ.用镁条测定空气中氧气的含量。
(4)请写出镁条在氧气中燃烧的化学表达式
(5)某同学利用图2实验测定空气中氧气含量时发现,产物中还出现少许黄色固体。已知:镁能与氮气反应生成淡黄色的氮化镁(Mg3N2)固体。但在空气中燃烧镁条时很难观察到生成物中有淡黄色固体,原因是
Ⅳ.用铁粉测定空气中氧气的含量。
(6)已知铁常温下与空气中的氧气、水反应生成铁锈(主要成分是Fe2O3﹒xH2O)。试写出生活中防止铁生锈的一种方法是
(7)某同学根据铁生锈的原理,用铁粉测定空气中氧气的含量,设计了如图3实验,8分钟后测得数据如表:
| 实验前的体积 | 实验后的体积 | |
| 集气瓶内空气 | 量筒内水 | 量筒内剩余水 |
| 250mL | 180.0mL | 129.5mL |
V.拓展应用
(8)取7.2g镁条在O2和N2的混合气体中完全燃烧,所得固体质量为ag,则a的取值范围是

(9)已知:Fe2O3固体在一定的高温下能分解为一种复杂的铁的氧化物和一种气体。该气体可以用
更新时间:2023-12-13 09:27:15
|
相似题推荐
实验题
|
较难
(0.4)
【推荐1】河西区某中学实验小组为探究燃烧条件,进行如图实验。三支试管装好药品后,排尽试管内空气。初始温度25℃,水浴升温至60℃后,用注射器同时向②、③试管中迅速注入足量氧气。(已知白磷的着火点是40℃,红磷的着火点是240℃)

(1)有燃烧现象的是第_______ 支试管(填序号):
(2)由①、②实验对比,得出可燃物燃烧的条件之一是_______ 。
(3)若继续升高水温,试管③中_______ (填“不能”或“能”)出现燃烧现象。
(4)燃料的合理利用与开发是实现绿色化学的关键。
①从分类角度分析,“乙醇汽油”是_______ (填“化合物”或“混合物”):对乙醇汽油作汽车燃料的描述,不正确的是_______ (填字母)。
A.改善空气质量 B.不产生CO2,抑制温室效应 C.可避免石油过度开发
②一定条件下,有机物甲分解生成乙和丙(反应的化学计量数之比为1:1:1),反应的微观示意图如下。

4.6g甲与一定量氧气混合于密闭容器内,一定条件下,反应物全部转化为一氧化碳、二氧化碳和丙。则生成丙的质量为_______ g。

(1)有燃烧现象的是第
(2)由①、②实验对比,得出可燃物燃烧的条件之一是
(3)若继续升高水温,试管③中
(4)燃料的合理利用与开发是实现绿色化学的关键。
①从分类角度分析,“乙醇汽油”是
A.改善空气质量 B.不产生CO2,抑制温室效应 C.可避免石油过度开发
②一定条件下,有机物甲分解生成乙和丙(反应的化学计量数之比为1:1:1),反应的微观示意图如下。

4.6g甲与一定量氧气混合于密闭容器内,一定条件下,反应物全部转化为一氧化碳、二氧化碳和丙。则生成丙的质量为
您最近一年使用:0次
实验题
|
较难
(0.4)
【推荐2】古代中国炼铜工艺处于世界鼎盛地位,其中一种“竖炉法”炼铜是现代炼铁工艺的启蒙。其主要原理是利用二氧化碳产生一氧化碳,再利用一氧化碳还原氧化铜。如图为该方法的模拟装置,请回答下列问题(图中部分固定装置已略去)。

(1)实验步骤如下:( );装入碳粉和氧化铜;通入二氧化碳,让装置中充满二氧化碳气体;点燃a处和b处酒精喷灯和酒精灯;实验结束后先熄灭火源,再持续通入二氧化碳直至冷却。
(2)实验分析:硬质玻璃管中b处发生反应的化学方程式是_____ ,能否根据c处现象判定一氧化碳与氧化铜发生了反应 _____ (填“能”或“不能”)。b中玻璃管进入c中的气体成分是 _____ 。d装置的作用是 _____ 。
(3)如玻璃管中纯净氧化铜质量为Wg,全部反应后,b处固体质量为Mg,c处混合物增加的质量为Ng,请选择使用W、M、N等符号列式表示氧化铜中铜、氧元素的原子个数之比_____ (仅列式)。

(1)实验步骤如下:( );装入碳粉和氧化铜;通入二氧化碳,让装置中充满二氧化碳气体;点燃a处和b处酒精喷灯和酒精灯;实验结束后先熄灭火源,再持续通入二氧化碳直至冷却。
(2)实验分析:硬质玻璃管中b处发生反应的化学方程式是
(3)如玻璃管中纯净氧化铜质量为Wg,全部反应后,b处固体质量为Mg,c处混合物增加的质量为Ng,请选择使用W、M、N等符号列式表示氧化铜中铜、氧元素的原子个数之比
您最近一年使用:0次
实验题
|
较难
(0.4)
解题方法
【推荐3】大量使用一次性塑料方便袋造成的“白色污染”,已成为一个严重的社会问题。某化学研究小组的同学欲对某种塑料袋的组成进行分析探究(资料显示该塑料只含C、H两种元素),他们设计了如图所示的实验装置,使该塑料试样在纯氧中燃烧,观察实验现象,分析有关数据,推算元素含量。

(1)装置A中所发生反应的化学方程式为__________________________________ 。
(2)装置B的作用是__________________ 。
(3)装置E中的现象是_______________ 。
(4)若装置C的玻璃管中放入的塑料试样质量为Wg,塑料试样充分燃烧后,若装置D增重ag,则Wg该塑料试样中含氢元素的质量为________ g。(计算结果可为分数形式)
(5)若没有连接装置B,将使该塑料试样中氢元素质量的测算结果____________ (选填“偏小”“偏大”或“无影响”)。
(6)若该塑料袋是由聚氯乙烯塑料制成的,则要检验生成了氯化氢气体,应将装有足量____________ 溶液的试剂瓶添加到 ________ 和 ________ 装置之间。

(1)装置A中所发生反应的化学方程式为
(2)装置B的作用是
(3)装置E中的现象是
(4)若装置C的玻璃管中放入的塑料试样质量为Wg,塑料试样充分燃烧后,若装置D增重ag,则Wg该塑料试样中含氢元素的质量为
(5)若没有连接装置B,将使该塑料试样中氢元素质量的测算结果
(6)若该塑料袋是由聚氯乙烯塑料制成的,则要检验生成了氯化氢气体,应将装有足量
您最近一年使用:0次
实验题
|
较难
(0.4)
解题方法
【推荐1】某化学兴趣小组对铁与水蒸气的反应中所得产物展开探究。
查阅资料:
①常见铁的氧化物有关信息如表:
②铁的氧化物不与硫酸铜溶液反应
(1)取一定量的铁粉与湿棉花(棉花的成分不参加反应)于反应装置A中。按如图所示进行实验,观察到C处管口有淡蓝色火焰,烧杯内壁有水雾。说明铁与水蒸气反应产生的气体是_______ 。_______ 。A中剩余固体含有_______ 。
(3)乙同学取(2)中实验后的剩余物过滤、洗涤、干燥,称得固体质量为ng,则A中剩余固体中铁单质的质量分数为_______ (用含有m和n的式子表示)。
(4)若将(2)中实验后的剩余物置于空气中加热烘干,则计算出A中剩余固体中铁单质的质量分数将_______ 。(“变大”,“变小”,“不变”)
查阅资料:
①常见铁的氧化物有关信息如表:
| 铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色粉末 |
| 能否被磁铁吸引 | 否 | 否 | 能 |
(1)取一定量的铁粉与湿棉花(棉花的成分不参加反应)于反应装置A中。按如图所示进行实验,观察到C处管口有淡蓝色火焰,烧杯内壁有水雾。说明铁与水蒸气反应产生的气体是

(3)乙同学取(2)中实验后的剩余物过滤、洗涤、干燥,称得固体质量为ng,则A中剩余固体中铁单质的质量分数为
(4)若将(2)中实验后的剩余物置于空气中加热烘干,则计算出A中剩余固体中铁单质的质量分数将
您最近一年使用:0次
实验题
|
较难
(0.4)
名校
解题方法
【推荐2】沼气是一种清洁能源。沼气的主要成分是甲烷(CH4),另外还含有少量二氧化碳和一氧化碳。雅实化学兴趣小组的同学想通过实验证明沼气中含有甲烷、二氧化碳和一氧化碳,设计了下列实验。
【资料】①浓硫酸具有吸水性,能干燥常见的气体
②氢氧化钠溶液能吸收二氧化碳
③甲烷能在加热条件下还原氧化铜得到铜、二氧化碳和水,方程式为:CH4+ 4CuO 4Cu + CO2+2H2O
4Cu + CO2+2H2O

(1)同学们发现M中澄清石灰水变浑浊,说明沼气中含有______ 。
(2)小雅同学看到Q处烧杯内壁出现大量水雾,由此说明沼气中含有CH4。若没有P装置______ (填是或否)会对实验造成影响?
(3)实验过程中,小实同学将Q处烧杯倒转,再立即往烧杯中加入少量澄清石灰水,观察到澄清石灰水变浑浊,于是小实得出沼气中含有一氧化碳的结论。小雅同学认为小实的结论不正确,你认为小雅的理由是______ 。于是小实同学又设计了如图所示实验进一步证明沼气中还含有一氧化碳(装置内试剂均足量)。
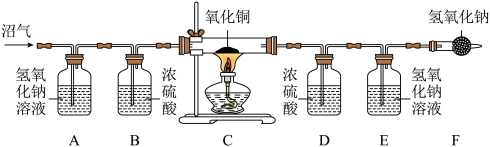
(4)装置B的作用为:______ 。
(5)实验结束时,应先停止加热,再通一段时间沼气,其目的是______ 。
(6)实验结束后,测得D装置质量增加了18克,则甲烷的质量为______ 克;同时测得E装置增加的质量为33克,则沼气中是否含一氧化碳?______ 。(若含有一氧化碳,请在横线上填写一氧化碳的质量,若不含一氧化碳请填写否。)
【资料】①浓硫酸具有吸水性,能干燥常见的气体
②氢氧化钠溶液能吸收二氧化碳
③甲烷能在加热条件下还原氧化铜得到铜、二氧化碳和水,方程式为:CH4+ 4CuO
 4Cu + CO2+2H2O
4Cu + CO2+2H2O
(1)同学们发现M中澄清石灰水变浑浊,说明沼气中含有
(2)小雅同学看到Q处烧杯内壁出现大量水雾,由此说明沼气中含有CH4。若没有P装置
(3)实验过程中,小实同学将Q处烧杯倒转,再立即往烧杯中加入少量澄清石灰水,观察到澄清石灰水变浑浊,于是小实得出沼气中含有一氧化碳的结论。小雅同学认为小实的结论不正确,你认为小雅的理由是

(4)装置B的作用为:
(5)实验结束时,应先停止加热,再通一段时间沼气,其目的是
(6)实验结束后,测得D装置质量增加了18克,则甲烷的质量为
您最近一年使用:0次
实验题
|
较难
(0.4)
【推荐3】蔗糖是生活中常用的调味品,贵港是广西蔗糖重要生产基地之一、某化学兴趣小组在完成水的电解实验后得到启发,设计了以下实验装置对蔗糖的组成元素进行定量探究。

【查阅资料】①蔗糖完全燃烧只生成CO2和H2O;②无水CaCl2能吸水,可用作干燥剂;
③固体NaOH可吸收H2O和CO2.请根据资料及所学知识回答下列问题:
(1)由以上资料可知,蔗糖的组成元素中一定含有___________ 元素;
(2)实验过程中装置D内发生反应的化学方程式为___________ ;
(3)从定量研究的角度看,实验装置对蔗糖燃烧后产物的吸收要做到“不多不少”:①以上装置中能防止非燃烧产物对实验造成干扰的是___________ ;(填装置序号)②为了全部吸收蔗糖燃烧后生成的H2O和CO2,实验时应注意的操作是___________ ;
(4)下表是小奕同学完成的实验报告表,请帮她完成填写:
(5)若装置B中没有Fe2O3,可能会对实验结果产生的影响是___________ 。

【查阅资料】①蔗糖完全燃烧只生成CO2和H2O;②无水CaCl2能吸水,可用作干燥剂;
③固体NaOH可吸收H2O和CO2.请根据资料及所学知识回答下列问题:
(1)由以上资料可知,蔗糖的组成元素中一定含有
(2)实验过程中装置D内发生反应的化学方程式为
(3)从定量研究的角度看,实验装置对蔗糖燃烧后产物的吸收要做到“不多不少”:①以上装置中能防止非燃烧产物对实验造成干扰的是
(4)下表是小奕同学完成的实验报告表,请帮她完成填写:
| 实验事实 | 数据分析和结论 |
| 3.42g蔗糖完全反应,生成5.28gCO2和1.98gH2O | 蔗糖中含C、H、O三种元素,且C和H元素的原子个数比为 |
(5)若装置B中没有Fe2O3,可能会对实验结果产生的影响是
您最近一年使用:0次
实验题
|
较难
(0.4)
【推荐1】某研究性学习小组设计了如图所示的装置,探究空气中氧气的体积分数,其中A是底面积为 、高20cm的圆筒状玻璃容器(带密封盖),上面标有以cm为单位的刻度,B是带刻度的敞口玻璃管(其他辅助装置略)。他们的操作过程如下:
、高20cm的圆筒状玻璃容器(带密封盖),上面标有以cm为单位的刻度,B是带刻度的敞口玻璃管(其他辅助装置略)。他们的操作过程如下:
a.检查装置的气密性
b.加入水并调整B的高度,使A中的液面至刻度15cm处;
c.将过量的铜粉平铺在惰性电热板上,盖紧密封盖;
d.通电加热铜粉,待充分反应后冷却到原来的状况,调整B的高度使容器A、B中的液面保持水平,记录液面刻度。(注:A容器内固态物质所占的体积忽略不计)

(1)在操作a中检查装置气密性的方法是__________________________________________________ 。
(2)在上述实验中,下列物质不能代替铜粉的是__________ (填字母)。
A 红磷 B 木炭 C 镁粉
(3)操作d中调整B的高度使容器A、B中的液面保持水平的目的是________________________________________________________________________________ 。
(4)在操作d结束时,装置A中液面的刻度约为__________ cm(填整数)。如果在操作d结束时,装置A中液面刻度在11cm处,则实验结果比理论值__________ (填“偏大”或“偏小”)。
(5)该小组中有同学提出,用木炭代替铜粉也能测定空气中氧气的体积分数,只要将水换成一种溶液,则该溶液是__________ 溶液,其原因是(用化学方程式表示)______________________________ 。
 、高20cm的圆筒状玻璃容器(带密封盖),上面标有以cm为单位的刻度,B是带刻度的敞口玻璃管(其他辅助装置略)。他们的操作过程如下:
、高20cm的圆筒状玻璃容器(带密封盖),上面标有以cm为单位的刻度,B是带刻度的敞口玻璃管(其他辅助装置略)。他们的操作过程如下:a.检查装置的气密性
b.加入水并调整B的高度,使A中的液面至刻度15cm处;
c.将过量的铜粉平铺在惰性电热板上,盖紧密封盖;
d.通电加热铜粉,待充分反应后冷却到原来的状况,调整B的高度使容器A、B中的液面保持水平,记录液面刻度。(注:A容器内固态物质所占的体积忽略不计)

(1)在操作a中检查装置气密性的方法是
(2)在上述实验中,下列物质不能代替铜粉的是
A 红磷 B 木炭 C 镁粉
(3)操作d中调整B的高度使容器A、B中的液面保持水平的目的是
(4)在操作d结束时,装置A中液面的刻度约为
(5)该小组中有同学提出,用木炭代替铜粉也能测定空气中氧气的体积分数,只要将水换成一种溶液,则该溶液是
您最近一年使用:0次
实验题
|
较难
(0.4)
解题方法
【推荐2】某化学兴趣小组开展“测定密闭容器中氧气的体积分数”的实验探究。
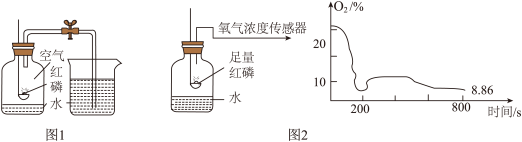
Ⅰ.图 1 为我们熟悉的测定空气中氧气含量的实验。
(1)红磷燃烧的主要现象为______ ,反应的化学式表达式是______ ,反应的基本类型是______ 。
(2)若实验过程中,发现烧杯中导管口出现气泡,则最终测得数据会______ 。(填“偏大” 或“偏小”或“无影响”)
Ⅱ.图 2 实验中,小组成员利用传感器记录集气瓶内氧气浓度随时间变化的情况。
(3)从以上数据分析,最终集气瓶中的氧气没有消耗完的依据是______ 。
(4)实验开始时氧气的含量持续下降,氧气被消耗,但在 200 s 时氧气的含量又有所上升,若实验过程中红磷量充足,其可能原因是______ 。
Ⅲ.小组成员通过查阅资料对书本实验进行改进, 利用四硫化钠(Na2S4)固体可替代红磷进行实验,其反应原理为:Na2S4+O2+H2O→S+NaOH(S 和 NaOH 均为固体,对实验结果无影响),实验设计如下图。

实验步骤如下:
①取足量的四硫化钠(Na2S4)固体置于试管中,加入适量的水,并迅速塞紧橡胶塞,再充分振荡;
②测量液面至橡胶塞下沿的距离,记录数据 h1;
③将该试管插入水中,取下橡胶塞,观察到试管内液面上升;
④当管内液面稳定时塞紧橡胶塞.将试管取出倒转过来,测量液面至橡胶塞下沿的距离记录数据 h2。
(5)步骤 a 中进行充分振荡的目的是______ 。
(6)空气中氧气的体积分数约为______ 。(用含 h1 和 h2 的式子表示)
(7)该实验与课本上的实验相比,有什么优点______ 。(写出一点即可)

Ⅰ.图 1 为我们熟悉的测定空气中氧气含量的实验。
(1)红磷燃烧的主要现象为
(2)若实验过程中,发现烧杯中导管口出现气泡,则最终测得数据会
Ⅱ.图 2 实验中,小组成员利用传感器记录集气瓶内氧气浓度随时间变化的情况。
(3)从以上数据分析,最终集气瓶中的氧气没有消耗完的依据是
(4)实验开始时氧气的含量持续下降,氧气被消耗,但在 200 s 时氧气的含量又有所上升,若实验过程中红磷量充足,其可能原因是
Ⅲ.小组成员通过查阅资料对书本实验进行改进, 利用四硫化钠(Na2S4)固体可替代红磷进行实验,其反应原理为:Na2S4+O2+H2O→S+NaOH(S 和 NaOH 均为固体,对实验结果无影响),实验设计如下图。

实验步骤如下:
①取足量的四硫化钠(Na2S4)固体置于试管中,加入适量的水,并迅速塞紧橡胶塞,再充分振荡;
②测量液面至橡胶塞下沿的距离,记录数据 h1;
③将该试管插入水中,取下橡胶塞,观察到试管内液面上升;
④当管内液面稳定时塞紧橡胶塞.将试管取出倒转过来,测量液面至橡胶塞下沿的距离记录数据 h2。
(5)步骤 a 中进行充分振荡的目的是
(6)空气中氧气的体积分数约为
(7)该实验与课本上的实验相比,有什么优点
您最近一年使用:0次
实验题
|
较难
(0.4)
解题方法
【推荐3】下图1、2、3三个实验均可用于测定空气中氧气的含量。
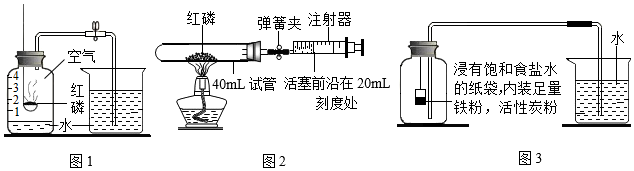
【查阅资料】铁粉与氧气、水在常温下反应发生锈蚀,氯化钠、活性炭会加速该反应。
(1)实验室常用红磷燃烧的方法测定空气中氧气的含量(如图1),写出红磷燃烧的文字表达式:______ 。测出氧气的体积常常低于空气总体积的1/5,可能的原因是______ (写一条即可)。
(2)兴趣小组同学对图1实验进行了改进,设计了如图2的实验。实验前,打开弹簧夹,将体积为60mL的注射器活塞前沿从20mL刻度处推至15mL刻度处,然后松开手,若活塞能返回至原处,则说明______ 。实验时,先夹紧弹簧夹,用酒精灯加热红磷,燃烧结束后,等到试管冷却后再松开弹簧夹,注射器活塞会从原来的20mL刻度处开始移动,最终将停留在约为______ (填整数,下同)mL刻度处;若不使用弹簧夹,用酒精灯加热红磷,充分反应,装置冷却后,注射器活塞最终又将停留在约为______ mL刻度处。
(3)图3所示实验中,测得的数据如下:
该实验中测得的氧气的体积分数为______ (写出计算式即可)。

【查阅资料】铁粉与氧气、水在常温下反应发生锈蚀,氯化钠、活性炭会加速该反应。
(1)实验室常用红磷燃烧的方法测定空气中氧气的含量(如图1),写出红磷燃烧的文字表达式:
(2)兴趣小组同学对图1实验进行了改进,设计了如图2的实验。实验前,打开弹簧夹,将体积为60mL的注射器活塞前沿从20mL刻度处推至15mL刻度处,然后松开手,若活塞能返回至原处,则说明
(3)图3所示实验中,测得的数据如下:
项目 | 实验前烧杯中水的体积 | 实验后烧杯中水的体积 | 集气瓶的容积 |
体积/mL | 160 | 108 | 250 |
该实验中测得的氧气的体积分数为
您最近一年使用:0次
实验题
|
较难
(0.4)
解题方法
【推荐1】白磷、红磷都是可燃物,都可以在一定条件下燃烧。以下是利用它们的可燃性进行的三个实验,请分别回答问题。
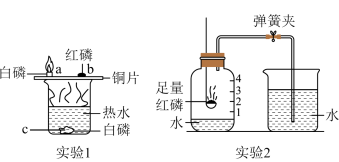
(1)通过实验1可以探究燃烧的条件,烧杯中放有80度热水,实验中只有a处的白磷燃烧,a与c对比说明燃烧需要的条件是___________ ,白磷燃烧的文字表达式为___________ 。
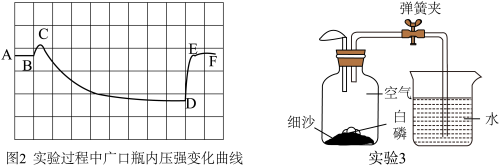
(2)实验2是测定空气中氧气含量,图中压强由B变为C的原因是___________ 。实验过程绘制出图2所示的压强变化曲线,则引起DE段气压变化的操作是___________ 。
(3)实验3是对实验2的改进实验,操作步骤如下:①装入药品②按图所示连接好装置,夹紧弹簧夹③先将集气瓶底部放入热水中④白磷被引燃后将集气瓶从热水中取出。以上实验操作缺少一个重要的步骤是___________ ,将集气瓶底部放入热水中的目的是___________ ,整个实验过程中气球会出现的现象是___________ 。
(4)综合上述实验分析,下列说法正确的是___________ 。
①实验1中的热水只起隔绝空气的作用
②实验2中红磷可以换成木炭
③实验2若未达到实验目的,可能是由于装置气密性不好
④实验3中的气球起到了平衡瓶内外气体压强的作用
⑤实验3中的气球作用是收集产生的气体
⑥实验3锥形瓶内事先放少量细沙的作用是防止瓶底炸裂。
(5)综合应用:煤矿发生特大瓦斯爆炸后,由于井下情况特别复杂,事故处理专家针对矿井既有瓦斯又有火且可能发生连续爆炸,采用注水或注液氮的灭火方案,注入液氮可以灭火的原因___________ 。


(1)通过实验1可以探究燃烧的条件,烧杯中放有80度热水,实验中只有a处的白磷燃烧,a与c对比说明燃烧需要的条件是
(2)实验2是测定空气中氧气含量,图中压强由B变为C的原因是
(3)实验3是对实验2的改进实验,操作步骤如下:①装入药品②按图所示连接好装置,夹紧弹簧夹③先将集气瓶底部放入热水中④白磷被引燃后将集气瓶从热水中取出。以上实验操作缺少一个重要的步骤是
(4)综合上述实验分析,下列说法正确的是
①实验1中的热水只起隔绝空气的作用
②实验2中红磷可以换成木炭
③实验2若未达到实验目的,可能是由于装置气密性不好
④实验3中的气球起到了平衡瓶内外气体压强的作用
⑤实验3中的气球作用是收集产生的气体
⑥实验3锥形瓶内事先放少量细沙的作用是防止瓶底炸裂。
(5)综合应用:煤矿发生特大瓦斯爆炸后,由于井下情况特别复杂,事故处理专家针对矿井既有瓦斯又有火且可能发生连续爆炸,采用注水或注液氮的灭火方案,注入液氮可以灭火的原因
您最近一年使用:0次
实验题
|
较难
(0.4)
解题方法
【推荐2】用来测定空气成分的方法很多。
(一)如图所示的是小明用红磷在空气中燃烧来定氧气在空气中含量的方法实验过程是

第一步:在集气瓶内加入少量水,并将水面上方空间分为五等份,并做好标记;
第二步:点燃红磷,伸入集气瓶中,塞紧塞子;
第三步:待红磷熄灭并冷却后,打开弹簧夹观察到现象。请回答下列问题。
(1)写出红磷燃烧的反应方程式______ ,上面的实验同时证明了氮气有______ 的化学性质。
(2)实验完毕,若进入集气中水的体积不到集气瓶中原空气总体积的1/5,你认为导致这一结果的原因可能是______ 、______ (写两点)
(3)上述实验中的红不能用木炭或硫代替,原因是______ ,结合你的学习经验,若要寻找红磷的替代物,该替代物应满足的条件是______ 。
(二)小华同学打算设计如下方案:选用实际容积为40mL的试管作反应容器,将过量的白磷放入试管,用橡皮紧试管,通过导管与实际容积为60mL且润滑性很好的针筒注射器组成如图的实验装置。假设此实验能够按照小华的设正常进行,且白磷所占体积与导管内的气体体积忽略不计,请回答下列问题。

(4)实验前,打开弹簧夹,将注射器活塞前沿从20mL刻度处推至15mL刻度处,然后松开手,若活塞仍能返回至20mL刻度处,则说明______ 。
(5)若先夹紧弹簧夹,用酒精灯加热白磷,燃烧结东,等到试管冷却后再松开弹簧夹,可观察到活停留在______ 。
(6)着不使用弹簧夹,用酒精灯加热白磷,充分反应直至燃烧结束,试管冷却,可观察到活塞停留在______ 。
(7)此方案相比图1的实验,其优点是______ 。
(一)如图所示的是小明用红磷在空气中燃烧来定氧气在空气中含量的方法实验过程是

第一步:在集气瓶内加入少量水,并将水面上方空间分为五等份,并做好标记;
第二步:点燃红磷,伸入集气瓶中,塞紧塞子;
第三步:待红磷熄灭并冷却后,打开弹簧夹观察到现象。请回答下列问题。
(1)写出红磷燃烧的反应方程式
(2)实验完毕,若进入集气中水的体积不到集气瓶中原空气总体积的1/5,你认为导致这一结果的原因可能是
(3)上述实验中的红不能用木炭或硫代替,原因是
(二)小华同学打算设计如下方案:选用实际容积为40mL的试管作反应容器,将过量的白磷放入试管,用橡皮紧试管,通过导管与实际容积为60mL且润滑性很好的针筒注射器组成如图的实验装置。假设此实验能够按照小华的设正常进行,且白磷所占体积与导管内的气体体积忽略不计,请回答下列问题。

(4)实验前,打开弹簧夹,将注射器活塞前沿从20mL刻度处推至15mL刻度处,然后松开手,若活塞仍能返回至20mL刻度处,则说明
(5)若先夹紧弹簧夹,用酒精灯加热白磷,燃烧结东,等到试管冷却后再松开弹簧夹,可观察到活停留在
(6)着不使用弹簧夹,用酒精灯加热白磷,充分反应直至燃烧结束,试管冷却,可观察到活塞停留在
(7)此方案相比图1的实验,其优点是
您最近一年使用:0次
实验题
|
较难
(0.4)
【推荐3】测定空气中氧气含量的实验:实验甲用红磷燃烧的方法;实验乙在集气瓶内壁用水均匀涂抹除氧剂(其中辅助成分不干扰实验)。请回答下列问题:

(1)按实验甲所示进行实验,若集气瓶的体积为250mL(瓶内装满空气),红磷熄灭,将装置冷却至室温后打开止水夹,用量筒测得进入集气瓶中水的体积为______ mL,得出氧气体积占空气的1/5。
(2)由实验甲可知剩余气体具有的一条物理性质是______ ,实验甲中数据偏小可能的原因是______ 、______ 。
(3)实验乙中得到的实验数据如下表:
由数据可计算得出空气中氧气的含量约为______ ,实验乙在集气瓶内壁用水均匀涂抹除氧剂的目的是______ 。
(4)连接数字传感器,测得甲、乙中氧气的体积分数随时间变化的关系分别如下图所示。由图中信息可知乙的测定方法更准确,其原因是______ 。


(1)按实验甲所示进行实验,若集气瓶的体积为250mL(瓶内装满空气),红磷熄灭,将装置冷却至室温后打开止水夹,用量筒测得进入集气瓶中水的体积为
(2)由实验甲可知剩余气体具有的一条物理性质是
(3)实验乙中得到的实验数据如下表:
| 实验前的体积 | 实验后的体积 | |
| 集气瓶内空气(含导管内空气) | 烧杯内水 | 烧杯内剩余水 |
| 250 mL | 100 mL | 52 mL |
(4)连接数字传感器,测得甲、乙中氧气的体积分数随时间变化的关系分别如下图所示。由图中信息可知乙的测定方法更准确,其原因是

您最近一年使用:0次



