随着我国“资源节约型”与“环境友好型”社会的建设,城市垃圾的处理成为了一项重要工程。某校实践小组的同学们在老师的组织下,带着极大的兴趣对垃圾的焚烧产物及宣传活动等展开了项目化学习。
【提出问题】垃圾焚烧产生的气体中是否含有SO2、CO、CO2?
【调查资料】①SO2能使红色的品红溶液褪色,常用于检验SO2;
②紫红色酸性高锰酸钾溶液可与SO2反应而褪色,常用于除去SO2;
③SO2也能使澄清石灰水变浑浊。
【进行实验】
(1)设计实验方案,探究垃圾焚烧产生的气体成分。

【反思评价】
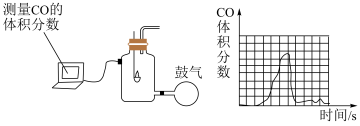
(2)步骤②中,气体先通过图1装置的目的是_________ 。
(3)步骤②中,澄清石灰水变浑浊的化学方程式为_________ 。
(4)小组同学通过一定手段,测得焚烧垃圾时间段内CO体积分数出现异常增大,其原因可能是_________ 。
【成果分享】
(5)同学们通过各种方式,学到了垃圾减量化、无害化、资源化的分类管理知识。那么,废旧金属垃圾的处理方式___________ 。
【提出问题】垃圾焚烧产生的气体中是否含有SO2、CO、CO2?
【调查资料】①SO2能使红色的品红溶液褪色,常用于检验SO2;
②紫红色酸性高锰酸钾溶液可与SO2反应而褪色,常用于除去SO2;
③SO2也能使澄清石灰水变浑浊。
【进行实验】
(1)设计实验方案,探究垃圾焚烧产生的气体成分。
| 实验步骤 | 实验现象 | 实验结论 |
| ①将除尘后的气体通入盛有少量品红溶液的试管中 | 红色褪去 | |
| ②将除尘后的气体先通过图1装置后,再通入盛有澄清石灰水的试管中 | 澄清石灰水变浑浊 | 含有CO2 |

【反思评价】
(2)步骤②中,气体先通过图1装置的目的是
(3)步骤②中,澄清石灰水变浑浊的化学方程式为
(4)小组同学通过一定手段,测得焚烧垃圾时间段内CO体积分数出现异常增大,其原因可能是

【成果分享】
(5)同学们通过各种方式,学到了垃圾减量化、无害化、资源化的分类管理知识。那么,废旧金属垃圾的处理方式
更新时间:2024-01-16 20:15:05
|
相似题推荐
科学探究题
|
适中
(0.65)
解题方法
【推荐1】市面上有一种名为“炸包”的整蛊玩具,由于其能产生一定的“爆炸”效果,从而深得中小学生的喜爱。某化学小组的同学对该玩具产生了浓厚的兴趣,在老师的指导下,他们对“炸包”展开了项目式学习。
探究一:分析“炸包”爆炸的原因
(1)小组同学发现在“炸包”内隐藏着一个小塑料袋,用手捏破小塑料袋后,小塑料袋中的液体与“炸包”中的白色粉末接触,“炸包”会迅速膨胀,产生“爆炸”效果。请你结合所学知识,分析“炸包”“爆炸”的原因可能是_____ 。
探究二:测定“炸包”中小塑料袋内液体的酸碱性
(2)取少量小塑料袋内的液体于试管中,_____ (写出实验操作及现象),说明小塑料袋内的液体呈酸性。
探究三:探究“炸包”中白色固体的成分
(3)在老师的指导下,同学们推测该白色固体的成分可能是CaCO3、Na2CO3和NaHCO3中的一种,并设计了如下实验讲行验证:
【实验1】
【实验2】同学们利用“炸包”内的白色固体又设计了如下实验进一步探究,图1中澄清石灰水变浑浊,图2中澄清石灰水不变浑浊。

由上述实验可得出“炸包”内的白色固体为碳酸氢钠,图1澄清石灰水所在试管中发生反应的化学方程式为_____ 。
探究四:分析“炸包”选用碳酸氢钠的原因
【信息检索】
①钠盐与酸的反应速率比钙盐与酸的反应速率快;
②小组同学在老师的帮助下,从相关厂家获知了部分碳酸盐和碳酸氢盐的价格,如下表:
【交流讨论】
(4)从反应速率、原料成本等角度分析,“炸包”选用碳酸氢钠的原因是_____ 。
(5)有同学了解到,“炸包玩具使用的酸为柠檬酸,柠檬酸是天然的防腐剂和食品添加剂。但部分“炸包”玩具厂家为了压低成本,使用了具有腐蚀性和能挥发出毒性气体的工业废酸,具有非常大的安全隐患。你对青少年及家长选购玩具时的建议是_____ 。
探究一:分析“炸包”爆炸的原因
(1)小组同学发现在“炸包”内隐藏着一个小塑料袋,用手捏破小塑料袋后,小塑料袋中的液体与“炸包”中的白色粉末接触,“炸包”会迅速膨胀,产生“爆炸”效果。请你结合所学知识,分析“炸包”“爆炸”的原因可能是
探究二:测定“炸包”中小塑料袋内液体的酸碱性
(2)取少量小塑料袋内的液体于试管中,
探究三:探究“炸包”中白色固体的成分
(3)在老师的指导下,同学们推测该白色固体的成分可能是CaCO3、Na2CO3和NaHCO3中的一种,并设计了如下实验讲行验证:
【实验1】
| 实验操作 | 实验现象 | 实验结论 |
| ①取适量白色固体于烧杯中,加入足量蒸馏水充分搅拌 | 白色固体中不含CaCO3 | |
| ②取①中少许溶液于试管中,滴加适量 | 有气泡产生 | 白色固体中含有Na2CO3或NaHCO3中的一种 |

由上述实验可得出“炸包”内的白色固体为碳酸氢钠,图1澄清石灰水所在试管中发生反应的化学方程式为
探究四:分析“炸包”选用碳酸氢钠的原因
【信息检索】
①钠盐与酸的反应速率比钙盐与酸的反应速率快;
②小组同学在老师的帮助下,从相关厂家获知了部分碳酸盐和碳酸氢盐的价格,如下表:
| 盐的种类 | Na2CO3 | CaCO3 | NaHCO3 | K2CO3 | Ca(HCO3)2 |
| 价格(元/吨) | 2200 | 600 | 1700 | 6100 | 3000 |
(4)从反应速率、原料成本等角度分析,“炸包”选用碳酸氢钠的原因是
(5)有同学了解到,“炸包玩具使用的酸为柠檬酸,柠檬酸是天然的防腐剂和食品添加剂。但部分“炸包”玩具厂家为了压低成本,使用了具有腐蚀性和能挥发出毒性气体的工业废酸,具有非常大的安全隐患。你对青少年及家长选购玩具时的建议是
您最近一年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐2】某兴趣小组的化学探究浓硫酸与铁钉(碳素钢)反应后产生气体的成分。
【查阅资料】①Fe与浓H2SO4 反应,加热,有SO2生成 ,
②C与浓H2SO4 反应,加热,有CO2和SO2生成,
③SO2 可使澄清石灰水变浑浊,
④SO2可使口红溶液的红色褪去,而CO2不能。
⑤SO2可使酸性高锰酸钾溶液褪色,而CO2不能。
⑥碱石灰的主要成分是NaOH和CaO
【实验探究】称取24.0克铁钉放入60.0ml浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。甲同学通过实验测定并推知气体Y中SO2的体积分数为66.7%。同学们认为气体Y中还可能含有H2和Z气体,则Z气体可能是_____ 。探究实验的主要装置如下图所示:

⑵装置A中试剂的作用是_____ 。
⑶为确认Z的存在,需将装置甲(如图所示)拉入上述装置(填编号)_____ 之间。装置甲中的液体名称是 _______ 。

⑷在实验中,如果观察到装置D中____________________________ ,且装置E中 ______________________ ,则可确认Y中含有H2气体。
⑸如果需要测定限定体积气体Y中H2的含量,(H2约为0.01克)。除可用测量H2体积的方法外,_______ (选填“能”或“不能”)用称量上图装置D装置E的质量变化的方法,通过计算并说明你判断的理由 ___________ 。
【查阅资料】①Fe与浓H2SO4 反应,加热,有SO2生成 ,
②C与浓H2SO4 反应,加热,有CO2和SO2生成,
③SO2 可使澄清石灰水变浑浊,
④SO2可使口红溶液的红色褪去,而CO2不能。
⑤SO2可使酸性高锰酸钾溶液褪色,而CO2不能。
⑥碱石灰的主要成分是NaOH和CaO
【实验探究】称取24.0克铁钉放入60.0ml浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。甲同学通过实验测定并推知气体Y中SO2的体积分数为66.7%。同学们认为气体Y中还可能含有H2和Z气体,则Z气体可能是

⑵装置A中试剂的作用是
⑶为确认Z的存在,需将装置甲(如图所示)拉入上述装置(填编号)

⑷在实验中,如果观察到装置D中
⑸如果需要测定限定体积气体Y中H2的含量,(H2约为0.01克)。除可用测量H2体积的方法外,
您最近一年使用:0次
科学探究题
|
适中
(0.65)
真题
解题方法
【推荐3】用如图所示装置制取干燥的CO2,并对CO2的部分性质进行探究。_______ 。
(2)①装置B中饱和NaHCO3溶液的作用是_______ 。
②装置C中试剂X应该选用_______ (填字母)。
a.稀H2SO4 b.浓H2SO4 c.KOH溶液
(3)收集CO2并验满。将集满CO2的锥形瓶与盛有足量NaOH溶液的注射器和传感器密封连接,缓慢的将NaOH溶液注入到锥形瓶中,采集信息形成图像。见图。_______ 。
②随着反应的进行,锥形瓶中压强降低的原因是_______ 。
③反应结束后锥形瓶中的压强保持在40kPa说明_______ 。
(4)取2mL饱和澄清石灰水于试管中,用4mL蒸馏水稀释,向其中缓慢通入足量CO2。测定反应体系的电导率变化如图所示。(忽略反应前后溶液体积的变化)
材料一:溶液的导电力越强,溶液的电导率越大。
材料二:单位体积溶液中某离子的个数越多,则该离子的浓度越大,溶液的导电能力越强。相同浓度的不同离子导电能力不同。
材料三:Ca(OH)2溶于水能完全解离出Ca2+和OH-。
CaCO3遇到溶有CO2的水时,能反应生成易溶于水的Ca(HCO3)2,Ca(HCO3)2在水中能完全解离出Ca2+和 ;。
;。
①石灰水中通入CO2气体,溶液的电导率先逐渐降低的主要原因是_______ 。
②反应最终电导率的稳定值低于初始值的可能原因是_______ 、_______ 。

(2)①装置B中饱和NaHCO3溶液的作用是
②装置C中试剂X应该选用
a.稀H2SO4 b.浓H2SO4 c.KOH溶液
(3)收集CO2并验满。将集满CO2的锥形瓶与盛有足量NaOH溶液的注射器和传感器密封连接,缓慢的将NaOH溶液注入到锥形瓶中,采集信息形成图像。见图。

②随着反应的进行,锥形瓶中压强降低的原因是
③反应结束后锥形瓶中的压强保持在40kPa说明
(4)取2mL饱和澄清石灰水于试管中,用4mL蒸馏水稀释,向其中缓慢通入足量CO2。测定反应体系的电导率变化如图所示。(忽略反应前后溶液体积的变化)

材料一:溶液的导电力越强,溶液的电导率越大。
材料二:单位体积溶液中某离子的个数越多,则该离子的浓度越大,溶液的导电能力越强。相同浓度的不同离子导电能力不同。
材料三:Ca(OH)2溶于水能完全解离出Ca2+和OH-。
CaCO3遇到溶有CO2的水时,能反应生成易溶于水的Ca(HCO3)2,Ca(HCO3)2在水中能完全解离出Ca2+和
 ;。
;。①石灰水中通入CO2气体,溶液的电导率先逐渐降低的主要原因是
②反应最终电导率的稳定值低于初始值的可能原因是
您最近一年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐1】化学实验小组发现,实验室一瓶长时间放置的氢氧化钠溶液的试剂瓶口有白色粉末状固体,于是对白色粉末可能的成分进行了猜想:①可能含有氢氧化钠;②可能含有碳酸钠。
(1)写出氢氧化钠变质的化学方程式。____
(2)白色粉末还有可能含有哪些物质,请写出你的猜想。_____
(3)设计实验验证你的猜想。_____
(1)写出氢氧化钠变质的化学方程式。
(2)白色粉末还有可能含有哪些物质,请写出你的猜想。
(3)设计实验验证你的猜想。
您最近一年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐2】火神山医院在建造过程中用到了HDPE膜,同学们对HDPE膜的组成元素产生了浓厚的兴趣,进行了如下探究。
[提出问题] HDPE膜由什么元素组成?
[查阅资料]①HDPE膜能够燃烧,燃烧可能生成一氧化碳; ②碱石灰主要成分是氢氧化钠固体和氧化钙固体。
[实验探究]如图所示,先通入干燥氮气,再将4.2g的HDPE膜样品在一定质量的氧气中点燃,并将燃烧产物依次通过装置A、B、C、D (装置中每步反应均进行完全)。

[实验记录]
[实验分析]
(1)装置A中浓硫酸的作用是______________________ 。
(2)实验中观察到装置B中黑色粉末变成红色,证明燃烧产物中有________________ 。
(3)装置B中发生的化学反应方程式为___________________ 。
(4)装置D的作用是_______________ 。
[数据处理]
(5)原样品中含氢元素的质量为_____________ g, 含碳元素的质量为____________ g。
[实验结论]
(6) HDPE膜由______________ (填元素符号)元素组成。
[实验反思]
(7)若装置C中药品过量,则反应后装置C中的溶质有______________ (填化学式) 。
[提出问题] HDPE膜由什么元素组成?
[查阅资料]①HDPE膜能够燃烧,燃烧可能生成一氧化碳; ②碱石灰主要成分是氢氧化钠固体和氧化钙固体。
[实验探究]如图所示,先通入干燥氮气,再将4.2g的HDPE膜样品在一定质量的氧气中点燃,并将燃烧产物依次通过装置A、B、C、D (装置中每步反应均进行完全)。

[实验记录]
| 装置质量 | 装置A的质量 | 装置C的质量 |
| 实验前 | 100.0g | 100.0g |
| 实验后 | 105.4g | 113.2g |
(1)装置A中浓硫酸的作用是
(2)实验中观察到装置B中黑色粉末变成红色,证明燃烧产物中有
(3)装置B中发生的化学反应方程式为
(4)装置D的作用是
[数据处理]
(5)原样品中含氢元素的质量为
[实验结论]
(6) HDPE膜由
[实验反思]
(7)若装置C中药品过量,则反应后装置C中的溶质有
您最近一年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐3】小组同学收集了某种铝制易拉罐,剪成条状并打磨后进行如图所示实验,发现纯铝片表面有划痕。
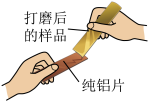
【发现问题】根据所学知识,合金的硬度比组成它的纯金属硬度更大,结合上述现象,可得出该易拉罐不是纯铝制作。那么易拉罐中除铝外,还含有什么金属呢?
【查阅资料】①铝制易拉罐中的主要成分是铝,可能还含有镁、铁。
②铝能与氢氧化钠溶液反应:2Al +2NaOH +2H2O=2NaAlO2 +3H2↑;镁和铁不能与氢氧化钠溶液反应。
【作出猜想】该易拉罐的金属组成除铝外,可能还含有镁、铁中的一种或两种。
【实验设计】小明取打磨后的铝制易拉罐样品按如下方案进行实验:
【实验结论】小明得出该易拉罐是由铝和铁组成。
【反思评价】其他同学分析后认为小明的实验方案不严谨,理由是______ ;大家认为应该补充下列实验:取步骤(1)中少量黑色粉末于试管中,加入某种金属化合物的溶液后,既能有明显现象,又能证明结论正确,你认为加入的这种金属化合物的溶液阳离子对应的金属,理论上可以是______ 。
【拓展应用】下图为国家颁布的“城市生活垃圾分类标志”,废弃易拉罐应放入标有______ (填序号)图标的垃圾桶内。


【发现问题】根据所学知识,合金的硬度比组成它的纯金属硬度更大,结合上述现象,可得出该易拉罐不是纯铝制作。那么易拉罐中除铝外,还含有什么金属呢?
【查阅资料】①铝制易拉罐中的主要成分是铝,可能还含有镁、铁。
②铝能与氢氧化钠溶液反应:2Al +2NaOH +2H2O=2NaAlO2 +3H2↑;镁和铁不能与氢氧化钠溶液反应。
【作出猜想】该易拉罐的金属组成除铝外,可能还含有镁、铁中的一种或两种。
【实验设计】小明取打磨后的铝制易拉罐样品按如下方案进行实验:
| 实验步骤 | 实验现象 | 解释与结论 |
| ①取一定量的样品于烧杯中,加入足量的 | 固体表面有大量气泡产生,过滤后得到黑色粉末。 | 样品中含铝 |
| ②取少量上述黑色粉末于试管中,加入足量的稀盐酸。 | 有气泡产生,溶液变成浅绿色。 | 样品中含铁 |
【反思评价】其他同学分析后认为小明的实验方案不严谨,理由是
【拓展应用】下图为国家颁布的“城市生活垃圾分类标志”,废弃易拉罐应放入标有

您最近一年使用:0次



