过碳酸钠(2Na2CO3·3H2O2)兼具碳酸钠和过氧化氢双重性质,广泛应用于洗涤、纺织、医药等领域。一种制备过碳酸钠的流程如下。
已知:过碳酸钠在异丙醇中的溶解度较低。______ 。
②结晶发生的化学反应方程式为______ ,加入异丙醇的作用是______ 。
(2)过碳酸钠中有效氧的含量越高,产品的品质越高。已知有效氧[O]%定义为: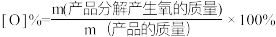
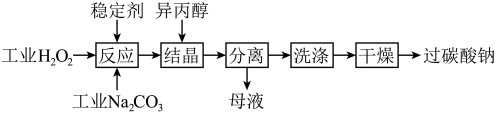
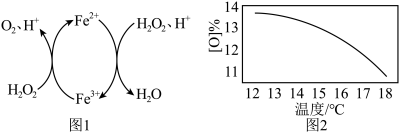
过碳酸钠的理论有效氧为15.29%。在过碳酸钠的制备过程中,温度对产品有效氧[O]%的影响如题28图2所示。取某次制备的产品,测量其有效氧的实验步骤如下:
步骤1:称量一定质量的样品加入锥形瓶中,加入10%硫酸至不再产生气体,将所得气体依次通过浓硫酸和碱石灰(由烧碱和氧化钙组成),充分吸收后碱石灰质量增加17.6g。
步骤2:称量与步骤1等质量的样品,放入坩埚中,加热,每隔10分钟测量一次坩埚和坩埚内固体的总质量,记录数据如下:
①计算样品的有效氧,写出计算过程______ 。
②产品有效氧低于理论有效氧的可能原因是______ 。
已知:过碳酸钠在异丙醇中的溶解度较低。
②结晶发生的化学反应方程式为
(2)过碳酸钠中有效氧的含量越高,产品的品质越高。已知有效氧[O]%定义为:
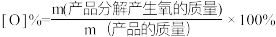
过碳酸钠的理论有效氧为15.29%。在过碳酸钠的制备过程中,温度对产品有效氧[O]%的影响如题28图2所示。取某次制备的产品,测量其有效氧的实验步骤如下:
步骤1:称量一定质量的样品加入锥形瓶中,加入10%硫酸至不再产生气体,将所得气体依次通过浓硫酸和碱石灰(由烧碱和氧化钙组成),充分吸收后碱石灰质量增加17.6g。
步骤2:称量与步骤1等质量的样品,放入坩埚中,加热,每隔10分钟测量一次坩埚和坩埚内固体的总质量,记录数据如下:
| 测量时间/min | 0 | 10 | 20 | 30 | 40 |
| 坩埚和坩埚内固体总质量/g | 109.4 | 102.2 | 95.8 | 92.4 | 92.4 |
②产品有效氧低于理论有效氧的可能原因是
2024·江苏无锡·一模 查看更多[2]
更新时间:2024-05-08 13:40:03
|
相似题推荐
【推荐1】兴趣小组以“KNO3的工业制备、使用与污染治理”为主题开展了项目式学习。
【任务一】模拟工业制备KNO3
步骤一:取硝酸钠与氯化钾固体按一定比例混合配成一定温度与浓度的溶液,然后将溶液冷却结晶,过滤,得粗硝酸钾和滤液A.
步骤二:将粗硝酸钾加热水溶解,经除杂、冷却结晶、过滤、洗涤、干燥得工业硝酸钾产品。
步骤三:将滤液A经蒸发结晶、过滤、洗涤、干操得副产品氯化钠。
(1)写出步骤一中反应的化学方程式:_________ 。
(2)结合题图,解释步骤一中选择“冷却结晶”而不用“蒸发结晶”原因:_________ 。
(3)硝酸钾是农业生产中广泛使用的一种化肥,它可以给植物提供的营养元素是_________ (填元素符号)。
(4)硝酸钾是制作黑火药的原料之一。黑火药在爆炸时会发生如下反应: 反应后,化合价降低的元素是
反应后,化合价降低的元素是_________ (填元素符号)。
【任务三】初步认识含氮废水治理原理
农业生产中KNO3的不当使用会导致水中氮元素(以NO3-、NH4+形式存在)含量偏高。在金属铂(Pt)、铜(Cu)、铱(Ir)的催化下,密闭容器中的H2可高效地将液体中的硝态氮(NO3-)转化为N2以达到降低含氮量的目的,工作原理的示意图如图所示。___________ 。
(6)若导电基体上的Pt颗粒增多,不利于降低液体中的含氮量,原因是___________ 。
(7)在液体中,H2将 转化为N2O的过程可描述为
转化为N2O的过程可描述为___________ 。
【任务一】模拟工业制备KNO3
步骤一:取硝酸钠与氯化钾固体按一定比例混合配成一定温度与浓度的溶液,然后将溶液冷却结晶,过滤,得粗硝酸钾和滤液A.
步骤二:将粗硝酸钾加热水溶解,经除杂、冷却结晶、过滤、洗涤、干燥得工业硝酸钾产品。
步骤三:将滤液A经蒸发结晶、过滤、洗涤、干操得副产品氯化钠。
(1)写出步骤一中反应的化学方程式:
(2)结合题图,解释步骤一中选择“冷却结晶”而不用“蒸发结晶”原因:

(3)硝酸钾是农业生产中广泛使用的一种化肥,它可以给植物提供的营养元素是
(4)硝酸钾是制作黑火药的原料之一。黑火药在爆炸时会发生如下反应:
 反应后,化合价降低的元素是
反应后,化合价降低的元素是【任务三】初步认识含氮废水治理原理
农业生产中KNO3的不当使用会导致水中氮元素(以NO3-、NH4+形式存在)含量偏高。在金属铂(Pt)、铜(Cu)、铱(Ir)的催化下,密闭容器中的H2可高效地将液体中的硝态氮(NO3-)转化为N2以达到降低含氮量的目的,工作原理的示意图如图所示。

(6)若导电基体上的Pt颗粒增多,不利于降低液体中的含氮量,原因是
(7)在液体中,H2将
 转化为N2O的过程可描述为
转化为N2O的过程可描述为
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐2】海水中含80多种元素,是巨大的资源宝库。
Ⅰ.通过海水晒盐可以得到粗盐,将粗盐进一步提纯可获得化工原料NaCl。
(1)粗盐中含多种可溶性杂质( 、
、 、
、 等)及不溶性杂质(泥沙),为除去相应杂质,将粗盐溶于水后再加入稍过量的①NaOH溶液,②
等)及不溶性杂质(泥沙),为除去相应杂质,将粗盐溶于水后再加入稍过量的①NaOH溶液,② 溶液,③
溶液,③ 溶液,加入试剂的先后顺序不合理的是________。(填字母)
溶液,加入试剂的先后顺序不合理的是________。(填字母)
(2)过滤后,加入_______ (填试剂名称),调节pH约为4,再经蒸发结晶可获得精盐。
Ⅱ.我国制碱工业先驱侯德榜先生改进西方制碱工艺并发明了侯氏制碱法,使氯化钠的利用率大大提高,为纯碱和氮肥工业发展做出了杰出贡献。某学习小组在实验室模拟侯氏制碱法,用精制饱和食盐水、、作为原料制取 ,设计如图装置。
,设计如图装置。
已知:
①极易溶于水(1体积水溶解700体积)。
②20℃时,NaCl溶解度为36.0g, 溶解度为37.2g,
溶解度为37.2g, 溶解度为9.6g。
溶解度为9.6g。

(3)M、N为实验制备 或
或 的发生装置。实验开始时,先打开
的发生装置。实验开始时,先打开_______ (填“ ”或“
”或“ ”),通入一段时间
”),通入一段时间_______ (填化学式)后,再打开_______ (填“ ”或“
”或“ ”)。
”)。
(4)图1中饱和碳酸氢钠溶液的作用为_______ 。
(5)此过程的化学方程式为:①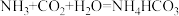 ;②
;②_______ 。
(6)反应结束后,将三颈烧瓶内的混合物过滤后即可获得碳酸氢钠晶体。向滤液中加入食盐细粉后又析出一种晶体,该物质可做化肥,其化学式为_______ ,再次过滤后的滤液可循环利用,大大提高了NaCl的利用率,降低了生产成本。
(7)取5.00g产品,充分受热分解(杂质受热不分解且不与 反应),冷却至室温后称量,最终得到残留固体3.45g,则产品的纯度为
反应),冷却至室温后称量,最终得到残留固体3.45g,则产品的纯度为_______ 。
Ⅰ.通过海水晒盐可以得到粗盐,将粗盐进一步提纯可获得化工原料NaCl。
(1)粗盐中含多种可溶性杂质(
 、
、 、
、 等)及不溶性杂质(泥沙),为除去相应杂质,将粗盐溶于水后再加入稍过量的①NaOH溶液,②
等)及不溶性杂质(泥沙),为除去相应杂质,将粗盐溶于水后再加入稍过量的①NaOH溶液,② 溶液,③
溶液,③ 溶液,加入试剂的先后顺序不合理的是________。(填字母)
溶液,加入试剂的先后顺序不合理的是________。(填字母)| A.①③② | B.②①③ | C.③②① | D.③①② |
(2)过滤后,加入
Ⅱ.我国制碱工业先驱侯德榜先生改进西方制碱工艺并发明了侯氏制碱法,使氯化钠的利用率大大提高,为纯碱和氮肥工业发展做出了杰出贡献。某学习小组在实验室模拟侯氏制碱法,用精制饱和食盐水、、作为原料制取
 ,设计如图装置。
,设计如图装置。已知:
①极易溶于水(1体积水溶解700体积)。
②20℃时,NaCl溶解度为36.0g,
 溶解度为37.2g,
溶解度为37.2g, 溶解度为9.6g。
溶解度为9.6g。
(3)M、N为实验制备
 或
或 的发生装置。实验开始时,先打开
的发生装置。实验开始时,先打开 ”或“
”或“ ”),通入一段时间
”),通入一段时间 ”或“
”或“ ”)。
”)。(4)图1中饱和碳酸氢钠溶液的作用为
(5)此过程的化学方程式为:①
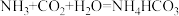 ;②
;②(6)反应结束后,将三颈烧瓶内的混合物过滤后即可获得碳酸氢钠晶体。向滤液中加入食盐细粉后又析出一种晶体,该物质可做化肥,其化学式为
(7)取5.00g产品,充分受热分解(杂质受热不分解且不与
 反应),冷却至室温后称量,最终得到残留固体3.45g,则产品的纯度为
反应),冷却至室温后称量,最终得到残留固体3.45g,则产品的纯度为
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐3】金属及其化合物是中学化学学习的重要内容。
(1)铝是活泼金属,为什么通常铝锅却很耐腐蚀?_____________ 。
(2)如图是阳阳同学探究钢铁腐蚀的实验装置图。该装置气密性良好,且开始时U型管两端的红墨水液面相平。经过一段时间后,可预期观察到什么现象?_____________ 。

(3)利用如图所示的微型实验装置模拟赤铁矿炼铁。
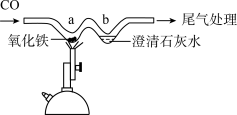
①写出a处反应的化学方程式_____________ ;
②从环保角度考虑,写出一种尾气处理方法:_____________ ;
③请写出b处发生反应的化学方程式?_____________ 。
(4)为探究实验室废液的综合利用,某化学小组设计并完成了以下实验。

①加入Y时,发生反应的化学方程式为_____________ 。
②操作I时玻璃棒的作用是_____________ 。
(5)工业上可利用铝和氧化铁在高温下发生置换反应制得铁来焊接钢轨。若用足量铝与80kg氧化铁反应,理论上可制得铁的质量是多少?
(1)铝是活泼金属,为什么通常铝锅却很耐腐蚀?
(2)如图是阳阳同学探究钢铁腐蚀的实验装置图。该装置气密性良好,且开始时U型管两端的红墨水液面相平。经过一段时间后,可预期观察到什么现象?

(3)利用如图所示的微型实验装置模拟赤铁矿炼铁。

①写出a处反应的化学方程式
②从环保角度考虑,写出一种尾气处理方法:
③请写出b处发生反应的化学方程式?
(4)为探究实验室废液的综合利用,某化学小组设计并完成了以下实验。

①加入Y时,发生反应的化学方程式为
②操作I时玻璃棒的作用是
(5)工业上可利用铝和氧化铁在高温下发生置换反应制得铁来焊接钢轨。若用足量铝与80kg氧化铁反应,理论上可制得铁的质量是多少?
您最近一年使用:0次
综合应用题
|
较难
(0.4)
【推荐1】某种钾肥样品,其成分为碳酸钾、氯化钾和少量不含钾元素的难溶杂质。为定该钾肥样品中钾元素的含量,进行如下实验:①称取10g该样品溶于水,过滤出去难溶杂质,得到滤液;②在所得滤液中逐滴加入溶质质量分数为10%的稀盐酸,至恰好完全反应时测得所消耗的稀盐酸质量为36.5g;③将反应后的溶液蒸干,称得所得白色固体为10.2g。
请你根据实验数据计算:
(1)样品中碳酸钾的质量;_____
(2)样品中钾元素的质量分数;_____
(3)用pH试纸测定第②步反应后溶液的pH,结果溶液pH大于7,你认为上述实验测得样品中钾元素的质量分数比实际值_____ (填“大”、“小”或“不变”)理由是_____ 。
请你根据实验数据计算:
(1)样品中碳酸钾的质量;
(2)样品中钾元素的质量分数;
(3)用pH试纸测定第②步反应后溶液的pH,结果溶液pH大于7,你认为上述实验测得样品中钾元素的质量分数比实际值
您最近一年使用:0次
综合应用题
|
较难
(0.4)
名校
【推荐2】为测定某石灰石的纯度(石灰石中所含杂质不与盐酸反应,不溶于盐酸也不溶于水),某同学实验并记录如下:

(1)写出高温煅烧石灰石所发生反应的化学方程式__________________________________________ ;(2)根据已知条件列出求解B中参加反应的碳酸钙质量(x)的比例式______________________ ;
(3)此石灰石的纯度为___________ ;
(4)配制上述实验所用的稀盐酸,需要质量分数为36.5%的浓盐酸的质量是_________ ;
(5)向E烧杯内加入232.8克的水,得到的溶质的质量分数为_____________ 。

(1)写出高温煅烧石灰石所发生反应的化学方程式
(3)此石灰石的纯度为
(4)配制上述实验所用的稀盐酸,需要质量分数为36.5%的浓盐酸的质量是
(5)向E烧杯内加入232.8克的水,得到的溶质的质量分数为
您最近一年使用:0次
综合应用题
|
较难
(0.4)
名校
解题方法
【推荐3】铁及其化合物在生产生活中有广泛的应用。
(一)铁的性质与应用
(1)人体缺Fe2+影响健康(已知:Fe2+在空气中易被氧化成Fe3+),硫酸亚铁糖衣片亦能补铁,糖衣除包装药物外,另一作用是_________ 。
(2)“暖宝宝”含铁粉和氧化钠等。使用时其反应可看作是铁、氧气和水作用产生Fe(OH)3。铁、氧气和水反应的化学方程式为________ 。
(二)铁的化合物制备
用废铁屑制备FeSO4▪7H2O和铁红(主要成分为Fe2O3)的部分流程如图所示:
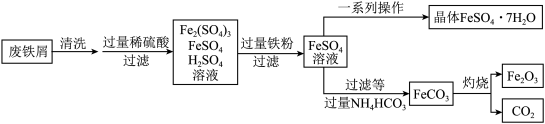
(3)在空气中灼烧FeCO3的反应为_______ (写化学方程式)。
(三)测定还原性供粉的细成
工业级还原性铁粉中含有少量FeO和Fe3C杂质。为测定还原铁粉中单质铁的含量,取10.00g还原性铁粉样品,在科研人员指导下,按如图进行实验;

查阅资料:
①
②
③浓硫酸吸收H2O2,碱石灰吸收H2O和CO2,不吸收CH4
(4)实验开始时应先对___ 处装置加热(填“A”或“C”)
(5)充分反应后。测得实验数据如表:装置B和E的质量变化。
①样品中单质铁的质量分数为_____ 。
②反思:实验中,实际测得装置D增重的质量大于CH4与Fe2O3反应生成H2O的的质量,原因是______________ 。
(一)铁的性质与应用
(1)人体缺Fe2+影响健康(已知:Fe2+在空气中易被氧化成Fe3+),硫酸亚铁糖衣片亦能补铁,糖衣除包装药物外,另一作用是
(2)“暖宝宝”含铁粉和氧化钠等。使用时其反应可看作是铁、氧气和水作用产生Fe(OH)3。铁、氧气和水反应的化学方程式为
(二)铁的化合物制备
用废铁屑制备FeSO4▪7H2O和铁红(主要成分为Fe2O3)的部分流程如图所示:

(3)在空气中灼烧FeCO3的反应为
(三)测定还原性供粉的细成
工业级还原性铁粉中含有少量FeO和Fe3C杂质。为测定还原铁粉中单质铁的含量,取10.00g还原性铁粉样品,在科研人员指导下,按如图进行实验;

查阅资料:
①

②

③浓硫酸吸收H2O2,碱石灰吸收H2O和CO2,不吸收CH4
(4)实验开始时应先对
(5)充分反应后。测得实验数据如表:装置B和E的质量变化。
| 反应前 | 200.00 | 200.00 |
| 反应后 | 200.18 | 200.44 |
②反思:实验中,实际测得装置D增重的质量大于CH4与Fe2O3反应生成H2O的的质量,原因是
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐1】小刚收集到一瓶浑浊的河水,他要模拟自来水厂的净水过程,最终制成蒸馏水。其实验过程如图所示,请回答下列问题:
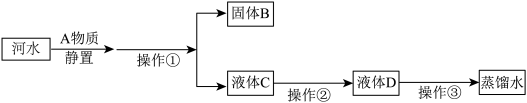
(1)最常用的A物质是____ ,其作用是 _______ 。
(2)操作①的名称是______ ,若经过操作①后,所得液体C中仍有浑浊,其原因可能是 _______ (选填字母)。
a漏斗内的滤纸有破损 b漏斗下端未紧靠烧杯内壁 c漏斗内液面高于滤纸的边缘
(3)操作②主要是利用物质的_____ (选填“物理”或“化学”)性质。
(4)下图中的甲、乙、丙是初中化学中常见的三种物质,其中乙是水,它们之间的转化关系如图所示。“→”表示由一种物质转化成另一种物质(图中部分反应条件及物质略去)。

①请分析:甲可能是________ 。
②写出下列转化的化学方程式:甲→丙+乙:________ ;丙→乙: ________ 。

(1)最常用的A物质是
(2)操作①的名称是
a漏斗内的滤纸有破损 b漏斗下端未紧靠烧杯内壁 c漏斗内液面高于滤纸的边缘
(3)操作②主要是利用物质的
(4)下图中的甲、乙、丙是初中化学中常见的三种物质,其中乙是水,它们之间的转化关系如图所示。“→”表示由一种物质转化成另一种物质(图中部分反应条件及物质略去)。

①请分析:甲可能是
②写出下列转化的化学方程式:甲→丙+乙:
您最近一年使用:0次
【推荐2】(1)某化学实验探究小组对一暗紫色固体化合物 A 进行实验,实验过程如下图。请回答下列问题:

①写出下列物质的化学符号:A_____ ;B _____ ;G _____ 。
②写出⑤的化学反应符号表达式:_____ 。
③反应④、⑤中固体 C 的作用是_____ ;在①至⑤中,属于分解反应的是 _____ 。
④上述反应中属于化合反应又是氧化反应的,写出其化学反应符号表达式:_____ ; 该反应的现象 _____ 。
(2)分离空气可以获得稀有气体、纯度较高的氮气和液氧。分离空气的简易流程如下:
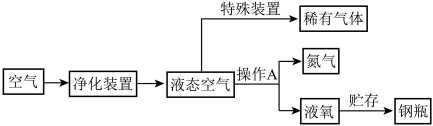
根据流程图回答下列问题。
①空气中二氧化碳约占总体积的________ 。
②空气的净化装置除了除去空气中的一些污染物外还除去了空气组成中的________ 。
A 氮气 B 氧气 C 稀有气体 D 二氧化碳 E 水
③稀有气体充入灯泡使灯泡经久耐用的原因是_________ ;用于飞艇的稀有气体是 ______ 。
④操作A的名称是_________ ,分离的原理是利用氮气和氧气的 ________ (“熔点”或“沸点”)不同,发生 ______ (填“化学”或“物理”)变化;贮存液氧的钢瓶外壁涂 _____ 色。

①写出下列物质的化学符号:A
②写出⑤的化学反应符号表达式:
③反应④、⑤中固体 C 的作用是
④上述反应中属于化合反应又是氧化反应的,写出其化学反应符号表达式:
(2)分离空气可以获得稀有气体、纯度较高的氮气和液氧。分离空气的简易流程如下:

根据流程图回答下列问题。
①空气中二氧化碳约占总体积的
②空气的净化装置除了除去空气中的一些污染物外还除去了空气组成中的
A 氮气 B 氧气 C 稀有气体 D 二氧化碳 E 水
③稀有气体充入灯泡使灯泡经久耐用的原因是
④操作A的名称是
您最近一年使用:0次
综合应用题
|
较难
(0.4)
名校
【推荐3】下图是实验室常用的制取气体的发生装置和收集装置。
(1)实验室用A装置制取氧气的化学方程式是______________ ,实验室用B装置制取氧气的化学方程式是________________ 。

(2)实验室常用块状固体硫化亚铁(FeS)和稀硫酸在常温下制取硫化氢气体,有关化学方程式为: ,硫化氢气体是一种有臭鸡蛋气味的有毒的气体,能溶于水,根据上述信息回答:实验室制取硫化氢的发生装置为
,硫化氢气体是一种有臭鸡蛋气味的有毒的气体,能溶于水,根据上述信息回答:实验室制取硫化氢的发生装置为___________ (用字母序号填空),收集装置为___________ (用字母序号填空)。
(3)某实验小组的同学用碳酸钠粉末、粒状大理石、稀盐酸、浓盐酸、稀硫酸这几种药品,探究哪两种药品的反应适合在实验室制取CO2。请你参与下列的探究并回答问题。
【提出问题】上述酸和碳酸盐的反应是否适合在实验室制取CO2?
【方案设计】大家经过讨论,一致认为浓盐酸不适合用于实验室制取CO2,你认为原因是_________________ 。
讨论后大家设计了如下三个实验进行对比分析。

【实验与结论】
根据探究结论,实验室制取二氧化碳选择第C组药品,该药品制取二氧化碳的反应原理为___________________________ (用化学方程式表示)_______________ ;验满方法是______________ ; 检验方法二氧化碳的是__________________ 。
【拓展与迁移】
(4)由上述探究可知,在确定实验室制取气体的反应原理时,要考虑诸多因素,例如反应速率要适中,便于收集等。请你再写出一种需要考虑的因素:________________________ 。
(5)如图:为了探究二氧化碳能否与水反应,现取用三朵紫色石蕊染成的干花(石蕊是一种色素,它遇酸变成红色)进行实验。

现象:第一朵紫色干花喷上水,紫花不变色 ;第二朵紫色干花直接放入盛满二氧化碳的集气瓶中,紫花也不变色;第三朵紫色干花先喷上水,再放入盛二氧化碳的集气瓶中,紫花_______ (填写关于颜色的现象)。
结论:以上实验现象说明:________________ 。反应的化学方程式是:___________________________________
(1)实验室用A装置制取氧气的化学方程式是

(2)实验室常用块状固体硫化亚铁(FeS)和稀硫酸在常温下制取硫化氢气体,有关化学方程式为:
 ,硫化氢气体是一种有臭鸡蛋气味的有毒的气体,能溶于水,根据上述信息回答:实验室制取硫化氢的发生装置为
,硫化氢气体是一种有臭鸡蛋气味的有毒的气体,能溶于水,根据上述信息回答:实验室制取硫化氢的发生装置为(3)某实验小组的同学用碳酸钠粉末、粒状大理石、稀盐酸、浓盐酸、稀硫酸这几种药品,探究哪两种药品的反应适合在实验室制取CO2。请你参与下列的探究并回答问题。
【提出问题】上述酸和碳酸盐的反应是否适合在实验室制取CO2?
【方案设计】大家经过讨论,一致认为浓盐酸不适合用于实验室制取CO2,你认为原因是
讨论后大家设计了如下三个实验进行对比分析。

【实验与结论】
| 实验 | 实验现象 | 实验内容 |
| A | 剧烈反应,迅速放出大量气泡 | 反应速率过快,气体不便收集,不宜于实验室制取二氧化碳 |
| B | 产生气泡,速率迅速减慢,反应几乎停止。 | 无法持续产生CO2,不能用于实验室制取CO2 |
| C | 产生气泡,速率适中 | 速率适中持续产生CO2,能用于实验室制取CO2 |
根据探究结论,实验室制取二氧化碳选择第C组药品,该药品制取二氧化碳的反应原理为
【拓展与迁移】
(4)由上述探究可知,在确定实验室制取气体的反应原理时,要考虑诸多因素,例如反应速率要适中,便于收集等。请你再写出一种需要考虑的因素:
(5)如图:为了探究二氧化碳能否与水反应,现取用三朵紫色石蕊染成的干花(石蕊是一种色素,它遇酸变成红色)进行实验。

现象:第一朵紫色干花喷上水,紫花不变色 ;第二朵紫色干花直接放入盛满二氧化碳的集气瓶中,紫花也不变色;第三朵紫色干花先喷上水,再放入盛二氧化碳的集气瓶中,紫花
结论:以上实验现象说明:
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐1】味精是常用的调味品,它的鲜味来自于其中的主要成分“谷氨酸钠”(化学式是C5H8NO4Na,易溶于水,与AgNO3不反应),另外还含有NaCl,其它成分不考虑。请回答下列问题:
(1)味精中至少含有__________ (填数字)种元素。
(2)称取5.0g味精配制成50g溶液,量取蒸馏水的量筒规格是_________(填字母)。
(3)下图是配制过程,正确的操作顺序为___________(填字母) 。
(4)为测定NaCl在味精中的质量分数,进行如下实验:
①向所配制的50g溶液中加入AgNO3溶液充分反应,检验沉淀是否完全的方法是:静置后,在上层清液中加入___________ (填化学式)溶液,观察是否有沉淀生成。
②在其它操作均正确的情况下,若在配制溶液过程中,仰视刻度量取蒸馏水,则所配制溶液中,谷氨酸钠的质量分数_________ (填“偏大”、“偏小”或“无影响”),所测定的味精中NaCI的质量分数______________ (填“偏大”、“偏小”或“无影响”)。
③向所配制的50g溶液中加入足量的AgNO3溶液充分反应后,将沉淀_________ 、洗涤、干燥,精确测定(假定实验过程中沉淀无损耗)沉淀质量为2.87 g,则该味精中NaCl的质量分数为_________ 。(计算结果精确到0.1% )
(1)味精中至少含有
(2)称取5.0g味精配制成50g溶液,量取蒸馏水的量筒规格是_________(填字母)。
| A.5mL | B.10 mL | C.50 mL | D.100 mL |
(3)下图是配制过程,正确的操作顺序为___________(填字母) 。
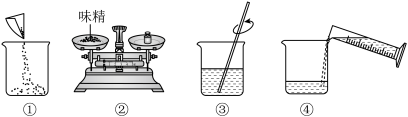
| A.①②③④ | B.②①④③ | C.②④①③ |
(4)为测定NaCl在味精中的质量分数,进行如下实验:
①向所配制的50g溶液中加入AgNO3溶液充分反应,检验沉淀是否完全的方法是:静置后,在上层清液中加入
②在其它操作均正确的情况下,若在配制溶液过程中,仰视刻度量取蒸馏水,则所配制溶液中,谷氨酸钠的质量分数
③向所配制的50g溶液中加入足量的AgNO3溶液充分反应后,将沉淀
您最近一年使用:0次
综合应用题
|
较难
(0.4)
【推荐2】实验室对含有MgCl2的粗盐进行提纯,步骤如图

(1)步骤①中,称量20g粗盐需补充的主要仪器是___________ 。
(2)步骤②中,玻璃棒的作用是___________ 。
(3)步骤④中,所得滤液仍浑浊,可能的原因是___________ 。
(4)步骤③中,滴加过量NaOH溶液除去MgCl2,步骤⑤中,为中和过量的NaOH,应滴加的“试剂a”是___________ (填字母)。
A 稀盐酸
B 稀硫酸
C 稀硝酸
(5)步骤⑥的操作名称是___________ ,当___________ 时,停止加热。
(6)为测定粗盐(含少量氯化镁)的纯度,做如下实验:取该样品20g,加入80g氢氧化钠溶液,充分反应,直到不再产生沉淀后过滤,所得滤液质量为97.1g.请计算:
①生成沉淀的质量为___________ g。
②样品中氯化钠的质量分数_________ 。

(1)步骤①中,称量20g粗盐需补充的主要仪器是
(2)步骤②中,玻璃棒的作用是
(3)步骤④中,所得滤液仍浑浊,可能的原因是
(4)步骤③中,滴加过量NaOH溶液除去MgCl2,步骤⑤中,为中和过量的NaOH,应滴加的“试剂a”是
A 稀盐酸
B 稀硫酸
C 稀硝酸
(5)步骤⑥的操作名称是
(6)为测定粗盐(含少量氯化镁)的纯度,做如下实验:取该样品20g,加入80g氢氧化钠溶液,充分反应,直到不再产生沉淀后过滤,所得滤液质量为97.1g.请计算:
①生成沉淀的质量为
②样品中氯化钠的质量分数
您最近一年使用:0次
综合应用题
|
较难
(0.4)
名校
【推荐3】酸、碱、盐在我们的生活中有着重要作用。
(1)下列关于酸、碱、盐的说法不正确的是_____
①酸、碱、盐中一定含有非金属元素;
②酸、碱、盐的水溶液均可导电;
③大多数的酸和碱都有腐蚀性;
④所有的酸、碱、盐之间都能发生复分解反应
(2)只用一种试剂一次就可鉴别出稀硫酸、澄清石灰水、氯化钠溶液,这种试剂是____ 。
(3)用氢氧化钠中一定量的盐酸时,溶液的pH与加入的氢氧化钠质量的关系入如图所示。当加入氢氧化钠mg时,溶液中的溶质为___ 。若改用ng氢氧化钙与相同量盐酸反应,所得溶液的pH___ (填“>”“<”或“=”)7。

(4)食盐是一种重要的化工原料。粗盐中常含有少量的CaCl2、MgCl2、Na2SO4等杂质。将粗盐进行精致的流程如图:
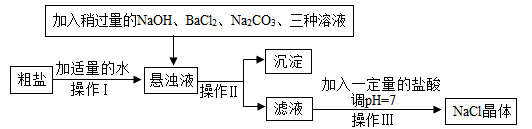
①加入NaOH、BaCl2、Na2CO3的顺序还可以改变吗?若能改变则写出改变的顺序,若不能改变,请说明理由____ 。
②通过操作Ⅱ所得滤液中的溶质有那些?____ 。
③在操作Ⅲ中玻璃棒的作用是什么?____ 。
(5)现有25g久置于空气中的氢氧化钠样品,为测定该样品变质的情况,将其配制成400mL溶液,取出200mL,滴入足量BaCl2,测得产生BaCO3的质量为19.7g。请通过计算判断样品是完全变质还是部分变质?____ 。
(1)下列关于酸、碱、盐的说法不正确的是
①酸、碱、盐中一定含有非金属元素;
②酸、碱、盐的水溶液均可导电;
③大多数的酸和碱都有腐蚀性;
④所有的酸、碱、盐之间都能发生复分解反应
(2)只用一种试剂一次就可鉴别出稀硫酸、澄清石灰水、氯化钠溶液,这种试剂是
(3)用氢氧化钠中一定量的盐酸时,溶液的pH与加入的氢氧化钠质量的关系入如图所示。当加入氢氧化钠mg时,溶液中的溶质为

(4)食盐是一种重要的化工原料。粗盐中常含有少量的CaCl2、MgCl2、Na2SO4等杂质。将粗盐进行精致的流程如图:

①加入NaOH、BaCl2、Na2CO3的顺序还可以改变吗?若能改变则写出改变的顺序,若不能改变,请说明理由
②通过操作Ⅱ所得滤液中的溶质有那些?
③在操作Ⅲ中玻璃棒的作用是什么?
(5)现有25g久置于空气中的氢氧化钠样品,为测定该样品变质的情况,将其配制成400mL溶液,取出200mL,滴入足量BaCl2,测得产生BaCO3的质量为19.7g。请通过计算判断样品是完全变质还是部分变质?
您最近一年使用:0次



