实验与探究是化学学习的重要方法和内容,李明看到家里多年未用的铜制火锅上有绿色的锈迹,他对绿色锈迹的成分和性质产生了浓厚兴趣。
【查阅资料】
①绿色锈迹是碱式碳酸铜[Cu2(OH)2CO3],受热易分解;
②无水硫酸铜为白色粉末,遇水变蓝;
③碱石灰是CaO和NaOH的固体混合物,NaOH与CO2反应生成碳酸钠固体和水;
④氧化铜与稀硫酸反应生成蓝色溶液,碳粉不与稀硫酸反应也不溶解在稀硫酸中。
【发现问题】
查阅资料后,该同学将少量碱式碳酸铜放入试管中加热,发现试管中的固体由绿色变成黑色,同时试管壁上有无色液滴生成。
为了进一步确定碱式碳酸铜受热分解的产物,进行了如下探究:
探究一:碱式碳酸铜受热分解生成的黑色固体成分。
【猜想与假设】该黑色固体可能是①碳粉;②____________ ;③碳和氧化铜的混合物。
【设计方案】请帮助该同学完成下述实验报告:
探究二:碱式碳酸铜受热分解还会生成CO2和H2O.
【进行实验】选择如下图所示装置进行验证:
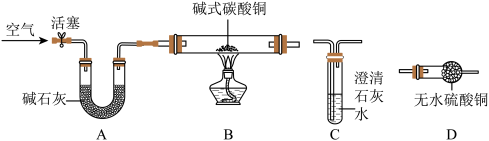
步骤一:连接A和B,打开活塞,通入一段时间的空气;
步骤二:点燃酒精灯,依次连接装置A→B→______ →______ (填“C”,“D”);
步骤三:点燃酒精灯,观察到明显现象后,停止加热。
【解释与结论】
①当观察到____________________________ ,说明碱式碳酸铜受热分解生成了CO2和H2O,写出装置C中反应的化学方程式_________________________ ;
②写出Cu2(OH)2CO3受热分解的化学方程式___________________________ 。
【反思与评价】
上述装置中A的作用是____________________________ 。
【查阅资料】
①绿色锈迹是碱式碳酸铜[Cu2(OH)2CO3],受热易分解;
②无水硫酸铜为白色粉末,遇水变蓝;
③碱石灰是CaO和NaOH的固体混合物,NaOH与CO2反应生成碳酸钠固体和水;
④氧化铜与稀硫酸反应生成蓝色溶液,碳粉不与稀硫酸反应也不溶解在稀硫酸中。
【发现问题】
查阅资料后,该同学将少量碱式碳酸铜放入试管中加热,发现试管中的固体由绿色变成黑色,同时试管壁上有无色液滴生成。
为了进一步确定碱式碳酸铜受热分解的产物,进行了如下探究:
探究一:碱式碳酸铜受热分解生成的黑色固体成分。
【猜想与假设】该黑色固体可能是①碳粉;②
【设计方案】请帮助该同学完成下述实验报告:
| 实验操作与现象 | 实验结论 |
| 猜想②正确 |
【进行实验】选择如下图所示装置进行验证:

步骤一:连接A和B,打开活塞,通入一段时间的空气;
步骤二:点燃酒精灯,依次连接装置A→B→
步骤三:点燃酒精灯,观察到明显现象后,停止加热。
【解释与结论】
①当观察到
②写出Cu2(OH)2CO3受热分解的化学方程式
【反思与评价】
上述装置中A的作用是
2016·山东泰安·中考真题 查看更多[6]
2016年初中毕业升学考试(山东泰安卷)化学(已下线)专题09 物质的性质的探究(中考题)-决胜2018中考化学压轴题全揭秘精品山西农业大学附属学校2018届九年级中考适应性训练化学试题第四章 科学探究上海市光明中学2018届九年级中考模拟一化学试题山东省淄博市张店区新元学校2022-2023学年九年级上学期12月月考化学试题
更新时间:2016-11-28 14:01:56
|
相似题推荐
科学探究题
|
较难
(0.4)
【推荐1】实验课上,同学们利用澄清石灰水检验空气中的二氧化碳,实验中发现各组石灰水混浊程度存在较大差异,于是设计实验探究影响石灰水混浊程度的因素。
【进行实验】装置图如下所示。
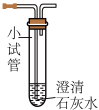
实验1:取饱和澄清石灰水进行实验。
实验2:利用向饱和石灰水中添加蒸馏水来调节石灰水浓度进行实验。
【解释与结论】
(1)小试管中石灰水变浑浊反应的化学方程式为_________ 。
(2)实验1的目的是:探究在通入空气体积相同、石灰水浓度相同的条件下,______ 。
(3)实验2中a的合理数据是________ 。
(4)实验2的结论是________ 。
【拓展延伸】同学们查阅资料,得知:CaCO3+CO2+H2O=Ca(HCO3)2。于是他们又补充做了下列一组实验。
实验3:在一支盛有3mL澄清石灰中通缓慢通入CO2气体,记录不同时间后实验现象
(5)由此可以推测出Ca(HCO3)2的一条物理性质是_______ 。Ca(HCO3)2由______ 种元素组成。
【进行实验】装置图如下所示。

实验1:取饱和澄清石灰水进行实验。
| 实验序号 | 1-1 | 1-2 | 1-3 | 1-4 |
| 饱和澄清石灰水体积/mL | 2.0 | 1.5 | 1.0 | 0.5 |
| 缓慢通入2L空气后的浑浊程度 | 不明显 | 明显 | 非常明显 | 明显 |
| 实验序号 | 2-1 | 2-2 | 2-3 | 2-4 |
| 饱和澄清石灰水体积/mL | 2.0 | 1.5 | 1.0 | 0.5 |
| 加入蒸馏水体积/mL | 0 | 0.5 | a | 1.5 |
| 缓慢通入3 L空气后的浑浊程度 | 非常明显 | 明显 | 不明显 | 无现象 |
(1)小试管中石灰水变浑浊反应的化学方程式为
(2)实验1的目的是:探究在通入空气体积相同、石灰水浓度相同的条件下,
(3)实验2中a的合理数据是
(4)实验2的结论是
【拓展延伸】同学们查阅资料,得知:CaCO3+CO2+H2O=Ca(HCO3)2。于是他们又补充做了下列一组实验。
实验3:在一支盛有3mL澄清石灰中通缓慢通入CO2气体,记录不同时间后实验现象
| 实验序号 | 3-1 | 3-2 | 3-3 | 3-4 | 3-5 |
| 缓慢通入CO2时间 | 第10s | 第20s | 第25s | 第30s | 第40s |
| 缓慢通入CO2后的浑浊程度 | 稍浑浊 | 浑浊 | 最浑浊 | 稍浑浊 | 澄清 |
您最近一年使用:0次
科学探究题
|
较难
(0.4)
真题
【推荐2】MgO在医药建筑等行业应用广泛。硫酸镁和木炭高温煅烧的产物为MgO(固体)、SO2、CO2、CO、硫蒸气。
(1)工业上,SO2的任意排放会引起的环境问题是_____ 。化石燃料燃烧是产生SO2的主要原因,下列做法能减少SO2排放的是_____ (填字母)。
a开发新能源替代化石燃料 b向高空排放SO2
(2)在高温、催化剂条件下,CO和H2可化合成燃料甲醇(CH3OH),该反应中CO和H2的分子个数比为_____ 。若CO和H2中混有H2S气体,H2S会与催化剂中的Cu在高温下发生置换反应,其中一种产物为CuS,该反应的化学方程式为_____ 。
(3)利用如图装置对硫酸镁和木炭进行高温煅烧,并对产生的四种气体进行分步吸收或收集。
已知:常温下,硫为固体;SO2、CO2均能与NaOH溶液反应。
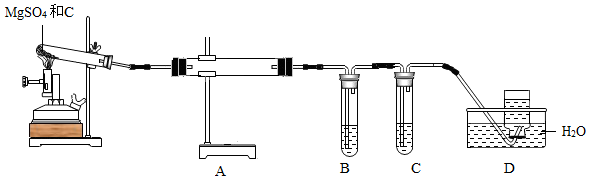
①装置B、C中的溶液分别是_____ 、_____ 。(填字母)
a NaOH溶液
b KMnO4溶液
②装置B、C的作用分别是_____ 、_____ 。
③装置D的作用是_____ 。
④若将装置A中的固体隔绝空气加热至500℃,就会变成蒸气,其中有一种相对分子质量为128的气体。该气体的化学式为_____ 。
(1)工业上,SO2的任意排放会引起的环境问题是
a开发新能源替代化石燃料 b向高空排放SO2
(2)在高温、催化剂条件下,CO和H2可化合成燃料甲醇(CH3OH),该反应中CO和H2的分子个数比为
(3)利用如图装置对硫酸镁和木炭进行高温煅烧,并对产生的四种气体进行分步吸收或收集。
已知:常温下,硫为固体;SO2、CO2均能与NaOH溶液反应。

①装置B、C中的溶液分别是
a NaOH溶液
b KMnO4溶液
②装置B、C的作用分别是
③装置D的作用是
④若将装置A中的固体隔绝空气加热至500℃,就会变成蒸气,其中有一种相对分子质量为128的气体。该气体的化学式为
您最近一年使用:0次
科学探究题
|
较难
(0.4)
【推荐3】某化学兴趣小组对复分解反应进行了如下探究。
【探究主题】水溶液中复分解反应的实质。
【查阅资料】
I、室温下,各物质的电导率数值如表(稀硫酸、Ba(OH)2溶液的浓度相同,设为c)。
Ⅱ、离子浓度越大,溶液的导电性越强,电导率越大。
Ⅲ、Ba(OH)2与NaOH具有相似的化学性质,BaCO3属于难溶物,硫酸钠溶液呈中性。
【实验设计与操作】
实验一:NaOH溶液与稀硫酸反应
往烧杯中加入一定量的NaOH溶液,滴入几滴酚酞试剂,再逐滴滴入稀硫酸。测得溶液的pH变化曲线如图所示。
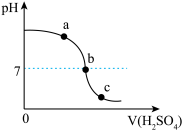
(1)a点溶液显______ (填“酸性”、“碱性”或“中性”)。
(2)写出该反应的化学方程式______ 。
(3)从a点到b点溶液的导电性逐渐______ (填“增强”,“减弱”或“不变”),其原因是______ 。
实验二:Ba(OH)2溶液与稀硫酸反应
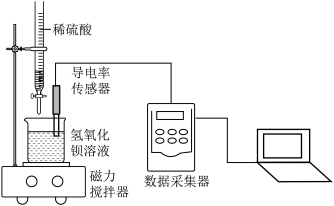
按如图所示装连接好仪器,在烧杯中加入浓度为c的Ba(OH)2溶液。开启磁力搅拌器,逐滴滴加相同浓度的稀硫酸,测得溶液的电导率变化曲线如图。
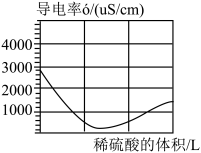
(4)实验开始前,测得Ba(OH)2溶液的电导率低于3273μS/cm的原因是______ (用化学方程式解释)。
(5)反应过程中,电导率最小值可能是______ μS/cm。
【实验结论】
(6)结合已学知识可知,溶液中复分解反应的实质是参与反应的离子,结合生成了沉淀、气体或水,导致其浓度______ (填“增大”或“减小”)。
【探究主题】水溶液中复分解反应的实质。
【查阅资料】
I、室温下,各物质的电导率数值如表(稀硫酸、Ba(OH)2溶液的浓度相同,设为c)。
物质 | 蒸馏水 | 稀硫酸 | Ba(OH)2溶液 | BaSO4悬浊液 |
电导率(μS/cm) | 3 | 3921 | 3273 | 3 |
Ⅲ、Ba(OH)2与NaOH具有相似的化学性质,BaCO3属于难溶物,硫酸钠溶液呈中性。
【实验设计与操作】
实验一:NaOH溶液与稀硫酸反应
往烧杯中加入一定量的NaOH溶液,滴入几滴酚酞试剂,再逐滴滴入稀硫酸。测得溶液的pH变化曲线如图所示。

(1)a点溶液显
(2)写出该反应的化学方程式
(3)从a点到b点溶液的导电性逐渐
实验二:Ba(OH)2溶液与稀硫酸反应
按如图所示装连接好仪器,在烧杯中加入浓度为c的Ba(OH)2溶液。开启磁力搅拌器,逐滴滴加相同浓度的稀硫酸,测得溶液的电导率变化曲线如图。


(4)实验开始前,测得Ba(OH)2溶液的电导率低于3273μS/cm的原因是
(5)反应过程中,电导率最小值可能是
【实验结论】
(6)结合已学知识可知,溶液中复分解反应的实质是参与反应的离子,结合生成了沉淀、气体或水,导致其浓度
您最近一年使用:0次
科学探究题
|
较难
(0.4)
名校
解题方法
【推荐1】在制取氧气的实验中,某同学手上不小心沾到了高锰酸钾而变成棕褐色。老师提供了稀草酸溶液给他洗手,棕褐色立刻消失。兴趣小组对草酸的性质进行探究。
【查阅资料】
Ⅰ、草酸(H2C2O4)是一种酸。草酸晶体无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。
Ⅱ、草酸钙(CaC2O4)难溶于水。
【实验探究】
1.探究草酸与碱的反应
向盛有草酸溶液的试管中加入适量石灰水,观察到溶液变浑浊,该反应的化学方程式为______ 。
2.探究草酸的分解
(1)同学们根据草酸中含有___________ (填名称)元素和氧元素,推测生成物中含有水。
(2)甲组同学用如图所示的装置,通过实验检验草酸晶体分解的其他产物。
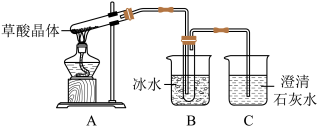
①小丽发现所组装的实验装置中有一处明显错误,请你改正:___________ 。
②同学们重新连接正确装置进行实验。实验中观察到装置C中澄清石灰水变浑浊,说明草酸晶体分解的产物中一定有___________ 。
(3)乙组同学认为草酸晶体分解的产物中还有CO,选用了甲组实验中的装置A、B和下图所示的装置进行实验验证。
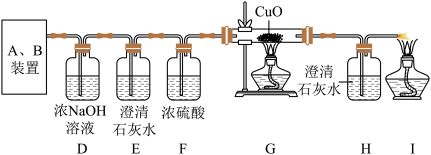
①其中装置D的作用是___________ 。
②若观察到装置G中的固体由黑色变为红色,且___________ (填序号),说明草酸晶体分解的产物中有CO。
a.装置E、H中溶液均无明显变化
b.装置E中溶液无明显变化,装置H中溶液变浑浊
c.装置E、H中溶液均变浑浊
d.装置E中溶液变浑浊,装置H中溶液无明显变化
【拓展延伸】某同学在网络上发现了一个实验视频:加了稀硫酸的高锰酸钾溶液与草酸溶液混合后,一段时间内都观察不到明显的褪色现象,但是一旦观察到溶液开始褪色后,溶液几乎瞬间就变为了无色。在老师的指导下,该同学利用以下试剂:加了稀硫酸的高锰酸钾溶液、草酸溶液、MnSO4溶液、蒸馏水,设计了验证实验:向盛有等体积加了稀硫酸的高锰酸钾溶液的两支试管中,___________ ,证明生成的Mn2+对反应有加快作用。
【查阅资料】
Ⅰ、草酸(H2C2O4)是一种酸。草酸晶体无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。
Ⅱ、草酸钙(CaC2O4)难溶于水。
【实验探究】
1.探究草酸与碱的反应
向盛有草酸溶液的试管中加入适量石灰水,观察到溶液变浑浊,该反应的化学方程式为
2.探究草酸的分解
(1)同学们根据草酸中含有
(2)甲组同学用如图所示的装置,通过实验检验草酸晶体分解的其他产物。

①小丽发现所组装的实验装置中有一处明显错误,请你改正:
②同学们重新连接正确装置进行实验。实验中观察到装置C中澄清石灰水变浑浊,说明草酸晶体分解的产物中一定有
(3)乙组同学认为草酸晶体分解的产物中还有CO,选用了甲组实验中的装置A、B和下图所示的装置进行实验验证。

①其中装置D的作用是
②若观察到装置G中的固体由黑色变为红色,且
a.装置E、H中溶液均无明显变化
b.装置E中溶液无明显变化,装置H中溶液变浑浊
c.装置E、H中溶液均变浑浊
d.装置E中溶液变浑浊,装置H中溶液无明显变化
【拓展延伸】某同学在网络上发现了一个实验视频:加了稀硫酸的高锰酸钾溶液与草酸溶液混合后,一段时间内都观察不到明显的褪色现象,但是一旦观察到溶液开始褪色后,溶液几乎瞬间就变为了无色。在老师的指导下,该同学利用以下试剂:加了稀硫酸的高锰酸钾溶液、草酸溶液、MnSO4溶液、蒸馏水,设计了验证实验:向盛有等体积加了稀硫酸的高锰酸钾溶液的两支试管中,
您最近一年使用:0次
科学探究题
|
较难
(0.4)
解题方法
【推荐2】如图1是化学课外活动小组设计的探究工业炼铁实验原理,其中A装置的作用是将二氧化碳和碳粉在高温下转化为一氧化碳,回答下列问题:
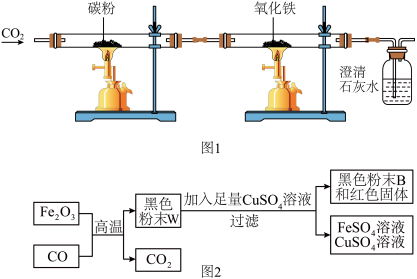
(1)写出装置A玻璃管中发生反应的化学方程式:__________________ ;
(2)整套装置还有一个明显的不足之处是:______________ ;
(3)B中得到的黑色产物W,该活动小组同学根据图2对产物W的成分进行探究
【提出问题】黑色粉末W可能是什么呢?
【查阅资料】
①铁的氧化物有氧化铁,氧化亚铁和四氧化三铁等,其中氧化铁为红棕色,其余都为黑色。
②铁的氧化物中四氧化三铁有磁性,能被磁铁吸引。
③铁的氧化物都难溶于水,却都能与稀盐酸反应而被溶解。
④铁的氧化物通常情况下不与CuSO4溶液反应。
【进行猜想】
①甲同学认为黑色粉末W全部是铁粉.请写出生成铁的化学反应方程式____________ ,该反应利用了CO的 ________________ 性。
②乙同学认为甲同学的猜想是错误的,理由是_______________ 。
③丙同学认为黑色粉末W中不含Fe2O3,理由是___________________ 。
丙同学提出如下猜想,请你结合所学知识帮他补充完整。
猜想1:黑色粉末W由铁粉和四氧化三铁(Fe3O4)组成;
猜想2:黑色粉末W由铁粉和氧化亚铁(FeO)组成;
猜想3:黑色粉末W由________________________ 。
【实验探究】
【得出结论】在高温下一氧化碳和氧化铁反应可生成铁、氧化亚铁、四氧化三铁。
【反思提高】
丁同学认为方案②和方案③中得出的结论不正确,其理由是__________________ 。
查阅资料知道:
Fe3O4溶于稀盐酸生成FeCl3、FeCl2和水,其反应方程式可表示为______________ 。
Fe3O4也能溶于稀硝酸(HNO3),反应生成 、NO和水,试写出反应的化学方程式
、NO和水,试写出反应的化学方程式 ______________ 。

(1)写出装置A玻璃管中发生反应的化学方程式:
(2)整套装置还有一个明显的不足之处是:
(3)B中得到的黑色产物W,该活动小组同学根据图2对产物W的成分进行探究
【提出问题】黑色粉末W可能是什么呢?
【查阅资料】
①铁的氧化物有氧化铁,氧化亚铁和四氧化三铁等,其中氧化铁为红棕色,其余都为黑色。
②铁的氧化物中四氧化三铁有磁性,能被磁铁吸引。
③铁的氧化物都难溶于水,却都能与稀盐酸反应而被溶解。
④铁的氧化物通常情况下不与CuSO4溶液反应。
【进行猜想】
①甲同学认为黑色粉末W全部是铁粉.请写出生成铁的化学反应方程式
②乙同学认为甲同学的猜想是错误的,理由是
③丙同学认为黑色粉末W中不含Fe2O3,理由是
丙同学提出如下猜想,请你结合所学知识帮他补充完整。
猜想1:黑色粉末W由铁粉和四氧化三铁(Fe3O4)组成;
猜想2:黑色粉末W由铁粉和氧化亚铁(FeO)组成;
猜想3:黑色粉末W由
【实验探究】
| 方案 | 实验操作 | 可能的现象 | 结论 |
| ① | 取适量黑色粉末W用磁铁吸引 | 黑色粉末全部被吸引 | 猜想1正确 |
| ② | 取适量黑色粉末W用磁铁吸引 | 黑色粉末部分被吸引 | 猜想2正确 |
| ③ | 取适量黑色粉末B用加入足量稀盐酸 | 黑色粉末全部溶解 | 猜想3正确 |
| ④ | 取适量黑色粉末B用磁铁吸引 | 猜想3正确 |
【反思提高】
丁同学认为方案②和方案③中得出的结论不正确,其理由是
查阅资料知道:
Fe3O4溶于稀盐酸生成FeCl3、FeCl2和水,其反应方程式可表示为
Fe3O4也能溶于稀硝酸(HNO3),反应生成
 、NO和水,试写出反应的化学方程式
、NO和水,试写出反应的化学方程式
您最近一年使用:0次
科学探究题
|
较难
(0.4)
解题方法
【推荐3】为探究盐酸的化学性质,某化学小组做了如下实验:
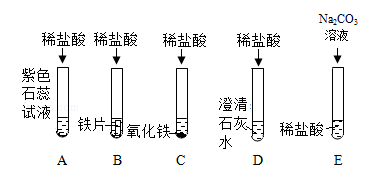
(1)上述反应中无明显现象的为_______________ (填字母序号,下同),有气泡产生的是____________ ;B 试管中所发生反应的化学方程式为____________ 。
(2)将反应后 D 和 E 试管中的废液倒入一洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质的成分进行 探究。
查阅资料得知:CaCl2+Na2CO3=2NaCl+CaCO3↓;Na2CO3+2HCl=2NaCl+H2O+CO2 。
。
【提出问题】滤液中溶质的成分是什么?
【假设与猜想】猜想一:NaCl;猜想二:NaCl 和 CaCl2 ;猜想三:NaCl、Ca(OH)2 和 HCl;猜想四:____________ 。
【讨论与交流】经讨论,同学们一致认为猜想____________ 是错误的。
【实验与结论】
【拓展与迁移】稀盐酸和稀硫酸有相似的化学性质,是因为它们的溶液中都存在____________ 。

(1)上述反应中无明显现象的为
(2)将反应后 D 和 E 试管中的废液倒入一洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质的成分进行 探究。
查阅资料得知:CaCl2+Na2CO3=2NaCl+CaCO3↓;Na2CO3+2HCl=2NaCl+H2O+CO2
 。
。【提出问题】滤液中溶质的成分是什么?
【假设与猜想】猜想一:NaCl;猜想二:NaCl 和 CaCl2 ;猜想三:NaCl、Ca(OH)2 和 HCl;猜想四:
【讨论与交流】经讨论,同学们一致认为猜想
【实验与结论】
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量滤液于试管中,滴加适量碳酸钠溶液 | 无现象 | 猜想四 成立 |
| 取少量滤液于试管中,滴加适量 |
【拓展与迁移】稀盐酸和稀硫酸有相似的化学性质,是因为它们的溶液中都存在
您最近一年使用:0次
科学探究题
|
较难
(0.4)
解题方法
【推荐1】皮蛋又称松花蛋,因其风味独特,深受人们喜爱。某兴趣小组在市场上获得了少许皮蛋的制作原料—料泥,拿到实验室进行实验。料泥为纯碱、生石灰、食盐等固体物质的混合物,将原料放于烧杯中,缓慢加入足量的蒸馏水,充分溶解后过滤,得到无色澄清滤液A。
【提出问题1】料泥加入水中,发生的反应:(任写一个)___________ 。
【提出问题2】无色滤液A中的溶质有哪些?
【作出猜想】滤液A中含有的溶质
猜想1:氯化钠、氢氧化钠
猜想2:氯化钠、氢氧化钠、碳酸钠
猜想3:氯化钠、氢氧化钠、氢氧化钙
猜想4:氯化钠、氢氧化钠、碳酸钠、氢氧化钙
小组同学一致认为猜想___________ 肯定不正确,理由是___________ 。
【实验验证】为证明滤液A中存在的溶质,甲、乙同学分别进行了如下实验。
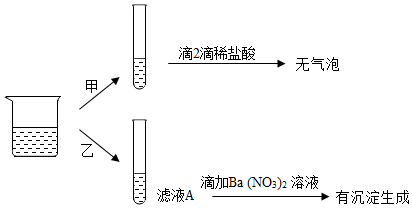
(1)甲同学认为:通过自己的实验可知猜想2一定不成立,丙认为甲的说法不正确,理由是___________ ;
(2)从乙同学的实验可知:猜想2成立。反应的方程式为___________ 。
该反应的基本反应类型是___________ 反应。
【提出问题3】腌制皮蛋结束后,剩余浸泡液中残留的NaOH可以重复利用,如何确定剩余浸泡液中NaOH的溶质质量分数?
【实验原理】利用稀盐酸和氢氧化钠的中和反应
(1)氢氧化钠溶液中滴加几滴酚酞,溶液由无色变为___________ 色。
(2)所加酚酞的作用是___________ 。
【实验步骤】取1g剩余浸泡液,稀释至20mL,滴加过量的Ba(NO3)2溶液后过滤,再向滤液中加入无色酚酞溶液做指示剂,滴加溶质质量分数为0.365%的稀盐酸,当溶液由红色恰好变为无色时,记录使用稀盐酸的质量m,重复做三次实验,得使用稀盐酸的质量m的平均值为10g。
【计算】:剩余浸泡液中NaOH的溶质质量分数__________ (写出计算过程)
【废料处理】该浸泡液利用多次后,最终需进行无害化处理后排放。如:用稀盐酸调pH为中性后再排放。
【提出问题1】料泥加入水中,发生的反应:(任写一个)
【提出问题2】无色滤液A中的溶质有哪些?
【作出猜想】滤液A中含有的溶质
猜想1:氯化钠、氢氧化钠
猜想2:氯化钠、氢氧化钠、碳酸钠
猜想3:氯化钠、氢氧化钠、氢氧化钙
猜想4:氯化钠、氢氧化钠、碳酸钠、氢氧化钙
小组同学一致认为猜想
【实验验证】为证明滤液A中存在的溶质,甲、乙同学分别进行了如下实验。

(1)甲同学认为:通过自己的实验可知猜想2一定不成立,丙认为甲的说法不正确,理由是
(2)从乙同学的实验可知:猜想2成立。反应的方程式为
该反应的基本反应类型是
【提出问题3】腌制皮蛋结束后,剩余浸泡液中残留的NaOH可以重复利用,如何确定剩余浸泡液中NaOH的溶质质量分数?
【实验原理】利用稀盐酸和氢氧化钠的中和反应
(1)氢氧化钠溶液中滴加几滴酚酞,溶液由无色变为
(2)所加酚酞的作用是
【实验步骤】取1g剩余浸泡液,稀释至20mL,滴加过量的Ba(NO3)2溶液后过滤,再向滤液中加入无色酚酞溶液做指示剂,滴加溶质质量分数为0.365%的稀盐酸,当溶液由红色恰好变为无色时,记录使用稀盐酸的质量m,重复做三次实验,得使用稀盐酸的质量m的平均值为10g。
【计算】:剩余浸泡液中NaOH的溶质质量分数
【废料处理】该浸泡液利用多次后,最终需进行无害化处理后排放。如:用稀盐酸调pH为中性后再排放。
您最近一年使用:0次
科学探究题
|
较难
(0.4)
解题方法
【推荐2】老师表演了一个“滴水生火”的小魔术:向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧。
小华同学对“脱脂棉为什么会燃烧”产生兴趣并结合所学知识对“物质燃烧的条件”进行如下实验探究:
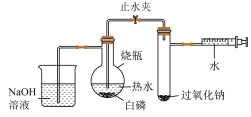
(1)打开止水夹,推动注射器活塞,观察到烧瓶中白磷燃烧,产生大量火烟,试管外壁发热。该现象说明,过氧化钠与水反应放热,生成______________ (填化学式)。白烟会污染环境,此实验中氢氧化钠溶液的作用是_______________ 。
(2)小华为进一步探究过氧化钠的性质,从实验室中找到一瓶未盖瓶盖的过氧化钠,取少量该固体加入足量水,未观察到气泡。他认变过氧化钠已经变质,请你和他一起进行探究:
【查阅资料】过氧化钠会与水反应生成氢氧化钠,还会与二氧化碳反应生成碳酸钠。
【提出问题】过氧化钠变质后的成分是什么?
【作出猜想】猜想一:NaOH猜想二:Na2CO3猜想三:NaOH和Na2CO猜想四:Na2O2、NaOH和Na2CO3
结合实验,你认为猜想_________ 不合理,理由是______________ 。
【进行实验】
【拓展延伸】过氧化钠与二氧化碳反应也生成氧气,潜水艇中常利用该反应来提供氧气。请写出过氧化钠与二氧化碳反应的化学方程式____________ 。
小华同学对“脱脂棉为什么会燃烧”产生兴趣并结合所学知识对“物质燃烧的条件”进行如下实验探究:

(1)打开止水夹,推动注射器活塞,观察到烧瓶中白磷燃烧,产生大量火烟,试管外壁发热。该现象说明,过氧化钠与水反应放热,生成
(2)小华为进一步探究过氧化钠的性质,从实验室中找到一瓶未盖瓶盖的过氧化钠,取少量该固体加入足量水,未观察到气泡。他认变过氧化钠已经变质,请你和他一起进行探究:
【查阅资料】过氧化钠会与水反应生成氢氧化钠,还会与二氧化碳反应生成碳酸钠。
【提出问题】过氧化钠变质后的成分是什么?
【作出猜想】猜想一:NaOH猜想二:Na2CO3猜想三:NaOH和Na2CO猜想四:Na2O2、NaOH和Na2CO3
结合实验,你认为猜想
【进行实验】
| 实验操作 | 实验现象 | 实验结论 |
| 向试管中继续滴加过量的氨水化钡溶液,过滤,向滤液中滴加几滴无色酚酞溶液。 | 猜想二成立 |
您最近一年使用:0次
科学探究题
|
较难
(0.4)
解题方法
【推荐3】牙膏中常用碳酸钙、二氧化硅作为摩擦剂.某同学对牙膏中摩擦剂碳酸钙的含量进行探究.
【实验原理】测定C装置中生成的BaCO3沉淀的质量,通过计算确定牙膏中CaCO3的质量分数.
【查阅资料】CO2+Ba(OH)2═BaCO3↓+H2O,牙膏中二氧化硅遇到盐酸时不反应.氢氧化钠溶液可以吸收二氧化碳
【实验装置】如图:
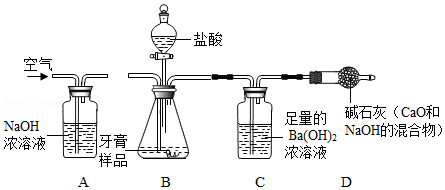
根据探究过程回答下列问题:
(1)装置B中发生反应的化学方程式_____ ;
(2)实验中判断牙膏样品中碳酸钙完全反应的依据是_____ ;
(3)碳酸钙完全反应后要缓缓通入一会空气,其作用是:_____ ;
(4)从C中过滤出BaCO3沉淀所需的玻璃仪器有烧杯、_____ 和玻璃棒;
(5)实验中准确称取三份牙膏样品,每份4.0g,进行三次测定,测得生成BaCO3的平均质量为1.97g.则样品中CaCO3的质量分数为_____ ;
(6)若没有A装置,直接通入空气,则测得CaCO3的质量分数_____ (填“偏大”、“偏小”或“不变”).
【实验原理】测定C装置中生成的BaCO3沉淀的质量,通过计算确定牙膏中CaCO3的质量分数.
【查阅资料】CO2+Ba(OH)2═BaCO3↓+H2O,牙膏中二氧化硅遇到盐酸时不反应.氢氧化钠溶液可以吸收二氧化碳
【实验装置】如图:

根据探究过程回答下列问题:
(1)装置B中发生反应的化学方程式
(2)实验中判断牙膏样品中碳酸钙完全反应的依据是
(3)碳酸钙完全反应后要缓缓通入一会空气,其作用是:
(4)从C中过滤出BaCO3沉淀所需的玻璃仪器有烧杯、
(5)实验中准确称取三份牙膏样品,每份4.0g,进行三次测定,测得生成BaCO3的平均质量为1.97g.则样品中CaCO3的质量分数为
(6)若没有A装置,直接通入空气,则测得CaCO3的质量分数
您最近一年使用:0次



