实验室常用的气体制取装置如图1,请回答:

(1)写出编号仪器的名称:Ⅰ_______________ ;Ⅱ_______________ 。
(2)实验室既可以制取CO2,又可以制取O2的发生装置为____________ (填装置编号),实验室制取CO2的化学方程式为______________________________ 。收集一瓶较纯净的O2可以选用的装置是____________ (填装置编号)。
(3)某同学利用空塑料输液袋收集二氧化碳(如图2),验满时,把燃着的木条放在玻璃管__________ (填“a”或“b”)端,如果熄灭则满了。

(4)小明用氯酸钾和二氧化锰反应制取氧气,反应中固体总质量随时间变化如图3所示:
①反应生成的氧气质量是__________ g。
②计算参加反应的氯酸钾的质量是_______________ 。(根据化学方程式计算)
③请分析图中 P 点固体的成分:______________________________ 。

(1)写出编号仪器的名称:Ⅰ
(2)实验室既可以制取CO2,又可以制取O2的发生装置为
(3)某同学利用空塑料输液袋收集二氧化碳(如图2),验满时,把燃着的木条放在玻璃管

(4)小明用氯酸钾和二氧化锰反应制取氧气,反应中固体总质量随时间变化如图3所示:
①反应生成的氧气质量是
②计算参加反应的氯酸钾的质量是
③请分析图中 P 点固体的成分:
2018·上海奉贤·一模 查看更多[5]
安徽省芜湖市无为县陡沟中学2017—2018学年九年级上学期期末化学试卷(已下线)2018年5月4日 二氧化碳的实验室制法——《每日一题》2017-2018学年九年级化学人教(下)(已下线)上海市奉贤区2018届九年级上学期期末考试化学试题(已下线)上海市奉贤区2018届九年级一模化学试题上海市奉贤区2018届九年级中考一模(上学期期末)化学试题
更新时间:2018-05-17 08:54:40
|
相似题推荐
实验题
|
适中
(0.65)
解题方法
【推荐1】过氧化钙(CaO2)是一种重要的化工产品,可用来改善地表水质、治理赤潮。过氧化钙产品中常含有氧化钙杂质。某小组设计如下实验测定过氧化钙产品的纯度,实验装置如图。

【资料在线】①CaO2是一种白色固体,能与盐酸反应: 。
。
②CaO是一种白色周体,能与盐酸反应: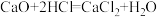 。
。
③MnO2与稀盐酸不反应。
【实验步骤】①连接仪器并检查装置气密性。
②称取过氧化钙产品及MnO2共12g
③缓慢通入N2一段时间后,加热铜网至红热。
④缓慢滴入过量稀盐酸,直至A中样品完全反应。
⑤缓慢通入N2一段时间后停止加热,待C中铜网冷却后,停止通入N2。
⑥将锥形瓶中的剩余物过滤、洗涤、干燥,得到滤渣2g
回答下列问题:
(1)A中MnO2的作用是______________ ,质量是______________ 。
(2)实验前先缓慢通入一段时间的N2,作用是______________ 。样品完全反应后,继续缓慢通入N2的目的是______________ 。
(3)装置B的作用:除去气体中的水蒸气、______________ 。
(4)实验测得C装置中铜网增重1.8g,增重的质量是_____________ 的质量。由此可以计算出H2O2的质量为______________ g,产品中过氧化钙的质量分数为______________ 。

【资料在线】①CaO2是一种白色固体,能与盐酸反应:
 。
。②CaO是一种白色周体,能与盐酸反应:
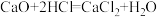 。
。③MnO2与稀盐酸不反应。
【实验步骤】①连接仪器并检查装置气密性。
②称取过氧化钙产品及MnO2共12g
③缓慢通入N2一段时间后,加热铜网至红热。
④缓慢滴入过量稀盐酸,直至A中样品完全反应。
⑤缓慢通入N2一段时间后停止加热,待C中铜网冷却后,停止通入N2。
⑥将锥形瓶中的剩余物过滤、洗涤、干燥,得到滤渣2g
回答下列问题:
(1)A中MnO2的作用是
(2)实验前先缓慢通入一段时间的N2,作用是
(3)装置B的作用:除去气体中的水蒸气、
(4)实验测得C装置中铜网增重1.8g,增重的质量是
您最近一年使用:0次
实验题
|
适中
(0.65)
【推荐2】化学兴趣小组查阅资料得知:氧化铜也能作过氧化氢分解的催化剂。小组同学进行了如图的实验探究。

(1)上述实验中,m=________________ ,过程中产生的氧气的质量为________________ g。
(2)计算参加反应的过氧化氢的质量(写出计算过程)。
(3)在答题卡上画出实验中水的质量与生成氧气质量之间的关系曲线图,并进行必要的标注。
(4)下列物质均可作为制取氧气的原料。理论上,等质量的下列物质完全分解制得氧气最多的是________________ (填字母序号)。
a.KMnO4 b.H2O2 c.KClO3 d.H2O

(1)上述实验中,m=
(2)计算参加反应的过氧化氢的质量(写出计算过程)。
(3)在答题卡上画出实验中水的质量与生成氧气质量之间的关系曲线图,并进行必要的标注。
(4)下列物质均可作为制取氧气的原料。理论上,等质量的下列物质完全分解制得氧气最多的是
a.KMnO4 b.H2O2 c.KClO3 d.H2O
您最近一年使用:0次
实验题
|
适中
(0.65)
解题方法
【推荐3】同学对上述部分反应前后物质的质量进行了称量,发现有的反应后物质质量增加,而有的质量减少。对此,该组同学展开进一步的定量探究,验证质量守恒定律。
(1)如图所示,实验前天平平衡。

①将注射器中适量的稀盐酸注入锥形瓶中,观察到天平的指针________ (填“偏左”、“偏右”或“在标尺中央”,下同)。上述实验的反应结束后,松开锥形瓶上的橡皮塞,天平的指针________ 。
②结论:为验证质量守恒定律,若有气体参与或生成的实验必须设计________ (“开放”或“密闭”)装置进行探究。
(2)某同学根据质量守恒定律研究物质W的组成。一定条件下,W在密闭容器内发生反应,反应前后各物质的质量如下图所示。
图中X=_____ g。物质W中碳、氢原子个数比为_______ (填最简整数比)。
(1)如图所示,实验前天平平衡。

①将注射器中适量的稀盐酸注入锥形瓶中,观察到天平的指针
②结论:为验证质量守恒定律,若有气体参与或生成的实验必须设计
(2)某同学根据质量守恒定律研究物质W的组成。一定条件下,W在密闭容器内发生反应,反应前后各物质的质量如下图所示。

图中X=
您最近一年使用:0次
实验题
|
适中
(0.65)
【推荐1】某化学兴趣小组的同学利用下图微型实验装置进行探究实验。

(1)写出左边双球管中第一个凹处反应的化学方程式______ 。
(2)挤压右滴管并微热燃烧管,白磷燃烧而红磷不燃烧,由此可说明燃烧需要什么条件?______ 。
(3)相同质量的磷、铁、镁分别在氧气中完全燃烧,消耗氧气最多的是______ 。

(1)写出左边双球管中第一个凹处反应的化学方程式
(2)挤压右滴管并微热燃烧管,白磷燃烧而红磷不燃烧,由此可说明燃烧需要什么条件?
(3)相同质量的磷、铁、镁分别在氧气中完全燃烧,消耗氧气最多的是
您最近一年使用:0次
实验题
|
适中
(0.65)
解题方法
【推荐2】如图是实验室中常见的气体制备、净化、收集和性质实验的部分仪器。

试根据题目要求,回答下列问题:
(1)在实验室中,用金属锌和稀盐酸制备氢气时,常会混有少量HCl。若收集一瓶干燥且不含HCl的氢气:
①所选装置的连接顺序为_____ 。
②制取气体前,需要先检查装置的_____ 。
③装置A中发生反应的化学方程式为_____ 。
④若用装置A制取CO2时,锥形瓶中应盛放的药品是_____ 。检验二氧化碳是否收集满的方法是_____ 。
(2)在实验室中,若以双氧水为原料(MnO2作催化剂)制备干燥的氧气,并用得到的氧气来测定10g由铜粉和炭粉组成的混合物样品中单质铜的含量,装置的连接顺序为:A→F→D→B(假设有关反应均恰好反应完全)。
①装置F的作用是_____ 。
②装置A中生成氧气的化学方程式为_____ 。
③D装置通入足量氧气,发生反应的类型是_____ 反应。充分反应后,室温下,称量玻璃管内剩余固体总质量变为8g,则原混合物样品中铜的质量分数是_____ 。
④实验结束后,要分离出装置A中锥形瓶内的固体,应采用的分离方法_____ 。

试根据题目要求,回答下列问题:
(1)在实验室中,用金属锌和稀盐酸制备氢气时,常会混有少量HCl。若收集一瓶干燥且不含HCl的氢气:
①所选装置的连接顺序为
②制取气体前,需要先检查装置的
③装置A中发生反应的化学方程式为
④若用装置A制取CO2时,锥形瓶中应盛放的药品是
(2)在实验室中,若以双氧水为原料(MnO2作催化剂)制备干燥的氧气,并用得到的氧气来测定10g由铜粉和炭粉组成的混合物样品中单质铜的含量,装置的连接顺序为:A→F→D→B(假设有关反应均恰好反应完全)。
①装置F的作用是
②装置A中生成氧气的化学方程式为
③D装置通入足量氧气,发生反应的类型是
④实验结束后,要分离出装置A中锥形瓶内的固体,应采用的分离方法
您最近一年使用:0次
实验题
|
适中
(0.65)
真题
解题方法
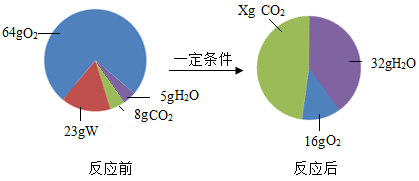
【推荐3】实验室利用 2KClO3 2KCl+3O2↑ 制取氧气,并用排水法收集。
2KCl+3O2↑ 制取氧气,并用排水法收集。
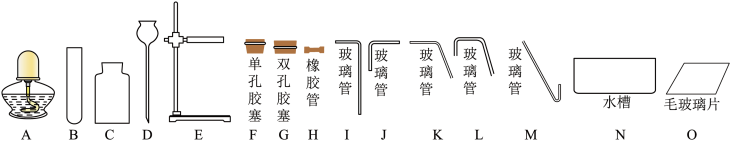
(1)根据实验要求和可供选择的仪器,回答下列问题。
①仪器 B 的名称是________ ;
②若制取 9.6gO2,至少需要_______ g的KClO3完全分解;
③组装整套装置时,需选用上图中的 B、C、E、F、H、K、M、O 和____ ;
④收集氧气的操作如下,其正确顺序为______ ;
a.当气泡连续并比较均匀地放出时,再将导管口伸入盛满水的集气瓶
b.当气体收集满时,在水面下用玻璃瓶盖住瓶口,移出水面正放在桌面上
c.将集气瓶盛满水,用玻璃瓶盖住瓶口,倒立在盛水的水槽内
(2)制取下列气体时,可采用③中整套装置的是_______。
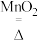 2KCl+3O2↑ 制取氧气,并用排水法收集。
2KCl+3O2↑ 制取氧气,并用排水法收集。 
(1)根据实验要求和可供选择的仪器,回答下列问题。
①仪器 B 的名称是
②若制取 9.6gO2,至少需要
③组装整套装置时,需选用上图中的 B、C、E、F、H、K、M、O 和
④收集氧气的操作如下,其正确顺序为
a.当气泡连续并比较均匀地放出时,再将导管口伸入盛满水的集气瓶
b.当气体收集满时,在水面下用玻璃瓶盖住瓶口,移出水面正放在桌面上
c.将集气瓶盛满水,用玻璃瓶盖住瓶口,倒立在盛水的水槽内
(2)制取下列气体时,可采用③中整套装置的是_______。
| A.锌粒和稀硫酸反应制取氢气 |
| B.加热无水醋酸钠与碱石灰的固体混合物制取难溶于水的甲烷 |
| C.加热碱石灰和氯化铵的固体混合物制取极易溶于水的氨气 |
您最近一年使用:0次
实验题
|
适中
(0.65)
名校
解题方法
【推荐1】如图是实验室制取气体的常用仪器,请根据要求填空:

(1)图1中标号仪器C的名称是_____ 。
(2)若要组装一套实验室制备二氧化碳气体并能随时添加液体药品的发生装置,可选择图中的B和___ 进行组合(填字母);若用H装置收集二氧化碳,气体应从___ 端通入。
(3)若用图中仪器组装一套制备O2并能控制反应速率的发生装置,可选择图中的A和_____ 进行组合(填字母),发生反应的化学方程式为___________ ;若用I装置排水法收集氧气,请将图I的收集装置补充完整并标出气体的流向_____ 。
(4)实验室常用块状硫化亚铁固体与稀硫酸反应制取硫化氢气体(H2S)。某化学兴趣小组利用如图2所示装置制取硫化氢气体,仪器B是圆筒状玻璃容器(带密封盖),底部放有带孔塑料隔板,其他夹持装置已略去。

①检查装置气密性的方法是:往A容器中加入一定量的水,关闭止水夹,将A容器适当上移或下移,若____ ,则气密性良好。
②制备硫化氢气体时,块状硫化亚铁固体先放在____ (填“A”或“B”)容器中,连接好装置,打开止水夹,然后______ 。

(1)图1中标号仪器C的名称是
(2)若要组装一套实验室制备二氧化碳气体并能随时添加液体药品的发生装置,可选择图中的B和
(3)若用图中仪器组装一套制备O2并能控制反应速率的发生装置,可选择图中的A和
(4)实验室常用块状硫化亚铁固体与稀硫酸反应制取硫化氢气体(H2S)。某化学兴趣小组利用如图2所示装置制取硫化氢气体,仪器B是圆筒状玻璃容器(带密封盖),底部放有带孔塑料隔板,其他夹持装置已略去。

①检查装置气密性的方法是:往A容器中加入一定量的水,关闭止水夹,将A容器适当上移或下移,若
②制备硫化氢气体时,块状硫化亚铁固体先放在
您最近一年使用:0次
实验题
|
适中
(0.65)
【推荐2】实验题。如图所示为实验室中常见的气体制备和收集装置。

请回答下列问题:
(1)实验室用高锰酸钾制取氧气,应选用的发生装置是_____ (填字母序号),反应的符号表达式为_____ ,若用装置D收集氧气,验满的方法是_____ 。
(2)实验室用过氧化氢溶液和二氧化锰制取氧气,若选用C做发生装置,你认为选用C的优点是_____ 。
(3)欲使用装置E用排空气法收集二氧化碳(二氧化碳密度比空气大),则气体应从_____ (填“a”或“b”)端通入;欲使用装置E用排水法收集氧气,写出实验操作过程_____ 。

请回答下列问题:
(1)实验室用高锰酸钾制取氧气,应选用的发生装置是
(2)实验室用过氧化氢溶液和二氧化锰制取氧气,若选用C做发生装置,你认为选用C的优点是
(3)欲使用装置E用排空气法收集二氧化碳(二氧化碳密度比空气大),则气体应从
您最近一年使用:0次
【推荐3】根据下列装置图,回答问题:

(1)仪器a的名称是______ 。
(2)实验室某小组选取B装置作为发生装置制取氧气,则可以选用______ 装置收集。若用C收集的氧气不纯,其原因可能是______ 。
(3)若选取F装置,采用排空气法收集氧气,氧气应从______ 端(填“m”或“n”)通入。如果将F装置装满水时,用排水法收集氧气,气体由______ 端通入(填“m”或“n”)。如果用水将F装置内的氧气排出,水由______ 端通入(填“m”或“n”)。

(1)仪器a的名称是
(2)实验室某小组选取B装置作为发生装置制取氧气,则可以选用
(3)若选取F装置,采用排空气法收集氧气,氧气应从
您最近一年使用:0次



