碳酸钠在生活和生产中都有广泛的用途。为探究碳酸钠的化学性质,同学们做了如下实验。

请根据实验回答问题。
(1)A试管中溶液变成红色,说明碳酸钠溶液显______________ 性。
(2)B试管中观察到的实验现象为_____________________ ,说明碳酸钠能与盐酸反应。
(3)C试管中有白色沉淀产生,写出该反应的化学方程式__________________________ 。实验结束后,同学们将三支试管中的物质倒入同一个洁净的烧杯中,静置段时间后,观察到烧杯底部有白色沉淀,上层溶液为无色。
【提出问题】无色溶液中除酚酞外还有哪些溶质?
【分析讨论】无色溶液中一定含有的溶质是______________ (填化学式,下同);可能含有的溶质是______________ 。
【实验验证】为检验无色溶液中可能含有的溶质是否存在,请你帮助他们设计实验方案___________ (写出实验操作、现象及结论)。

请根据实验回答问题。
(1)A试管中溶液变成红色,说明碳酸钠溶液显
(2)B试管中观察到的实验现象为
(3)C试管中有白色沉淀产生,写出该反应的化学方程式
【提出问题】无色溶液中除酚酞外还有哪些溶质?
【分析讨论】无色溶液中一定含有的溶质是
【实验验证】为检验无色溶液中可能含有的溶质是否存在,请你帮助他们设计实验方案
更新时间:2018-07-09 11:26:48
|
相似题推荐
科学探究题
|
适中
(0.65)
【推荐1】“极限挑战”化学创客团队对碳酸钠、碳酸氢钠分别与稀盐酸的反应进行了探究。
(1)分别在盛有少量碳酸钠(俗称______ )、碳酸氢钠固体的试管中加入足量稀盐酸,观察到都剧烈反应且产生大量气泡。其中,碳酸氢钠和稀盐酸反应的化学方程式为______ 。
【提出问题】碳酸钠、碳酸氢钠和稀盐酸反应产生二氧化碳的快慢是否相同?

【设计与实验】
(2)甲设计的实验如图1所示。同时全部推出足量稀盐酸后,观察到图2所示现象。于是他得出碳酸氢钠和稀盐酸反应产生二氧化碳较快的结论。
(3)乙同学提出质疑:等质量两种固体分别与足量稀盐酸反应,碳酸氢钠产生二氧化碳的质量更多,应取含碳元素质量相同的碳酸钠和碳酸氢钠进行实验。若碳酸钠的质量仍为0.318g,应称取碳酸氢钠的质量为______ 。
(4)甲、乙同学在老师指导下设计了如图3所示的实验。

①图3装置中连通管的作用是______ 。
②分别取等体积、含碳元素质量相同的碳酸钠和碳酸氢钠稀溶液(各滴2滴酚酞溶液),以及相同体积、相同浓度的足量稀盐酸进行实验。实验时,溶液颜色变化记录如表,广口瓶内压强随时间变化如图4所示。
【实验结论】
(5)分析图4所示的实验数据可得到的结论是:相同条件下,______ 和稀盐酸反应产生二氧化碳较快。你判断的理由是______ 。
(6)甲、乙同学分析上表记录的实验现象和图4数据,得出另一物质和稀盐酸反应产生二氧化碳较慢的原因是反应是该物质与稀盐酸是分步进行的,其中第一步发生反应的化学方程式为______ 。
(1)分别在盛有少量碳酸钠(俗称
【提出问题】碳酸钠、碳酸氢钠和稀盐酸反应产生二氧化碳的快慢是否相同?

【设计与实验】
(2)甲设计的实验如图1所示。同时全部推出足量稀盐酸后,观察到图2所示现象。于是他得出碳酸氢钠和稀盐酸反应产生二氧化碳较快的结论。
(3)乙同学提出质疑:等质量两种固体分别与足量稀盐酸反应,碳酸氢钠产生二氧化碳的质量更多,应取含碳元素质量相同的碳酸钠和碳酸氢钠进行实验。若碳酸钠的质量仍为0.318g,应称取碳酸氢钠的质量为
(4)甲、乙同学在老师指导下设计了如图3所示的实验。

①图3装置中连通管的作用是
②分别取等体积、含碳元素质量相同的碳酸钠和碳酸氢钠稀溶液(各滴2滴酚酞溶液),以及相同体积、相同浓度的足量稀盐酸进行实验。实验时,溶液颜色变化记录如表,广口瓶内压强随时间变化如图4所示。
| 滴入酚酞溶液 | 滴入稀盐酸,溶液颜色变化 | |
| 碳酸钠溶液 | 红色 | 红色→浅红色→无色 |
| 碳酸氢钠溶液 | 浅红色 | 浅红色→无色 |
(5)分析图4所示的实验数据可得到的结论是:相同条件下,
(6)甲、乙同学分析上表记录的实验现象和图4数据,得出另一物质和稀盐酸反应产生二氧化碳较慢的原因是反应是该物质与稀盐酸是分步进行的,其中第一步发生反应的化学方程式为
您最近一年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐2】碳酸氢钠是小苏打的主要成分,在生产和生活中有许多重要的用途。在化学课上,同学们为了解碳酸氢钠的性质,将一定质量的碳酸氢钠与稀硫酸混合,充分反应后,有气体逸出,该反应的化学方程式为 ,同学们对反应后溶液中溶质的成分进行了探究:认为除一定含有硫酸钠外,可能还含有其他成分,因此进行了猜想并做了如下实验:
,同学们对反应后溶液中溶质的成分进行了探究:认为除一定含有硫酸钠外,可能还含有其他成分,因此进行了猜想并做了如下实验:
[实验用品] pH试纸、锌片、氧化铜粉末、稀硫酸、氢氧化钠溶液、氯化钡溶液
[猜想与假设]反应后溶液中溶质的可能组成成分
猜想一:硫酸钠;
猜想二:硫酸钠、碳酸氢钠;
猜想三: 硫酸钠、硫酸
[实验探究]同学们取反应后的物质用不同方案进行如下实验,请根据结论完成下表:
[得出结论]猜想三正确。
[评价反思]
(1)老师对同学们能用多种方案进行探究,并且得出正确的实验结论给予了肯定,同时指出探究中存在一处明显的错误操作:_____________ 。
(2)有同学对实验方案B的结论提出了质疑,认为仅凭此现象不能得出猜想三正确,请说明理由:______ 。
[总结提高]依据所给实验用品,设计不同的方案确认猜想三是正确的。请写出你的实验方案的化学方程式_______ 。
 ,同学们对反应后溶液中溶质的成分进行了探究:认为除一定含有硫酸钠外,可能还含有其他成分,因此进行了猜想并做了如下实验:
,同学们对反应后溶液中溶质的成分进行了探究:认为除一定含有硫酸钠外,可能还含有其他成分,因此进行了猜想并做了如下实验:[实验用品] pH试纸、锌片、氧化铜粉末、稀硫酸、氢氧化钠溶液、氯化钡溶液
[猜想与假设]反应后溶液中溶质的可能组成成分
猜想一:硫酸钠;
猜想二:硫酸钠、碳酸氢钠;
猜想三: 硫酸钠、硫酸
[实验探究]同学们取反应后的物质用不同方案进行如下实验,请根据结论完成下表:
| 实验方案 | 实验操作 | 实验现象及解释 | 实验结论 |
| A | 向反应后的溶液中滴加稀硫酸 | 无气体放出 | 猜想二不正确 |
| B | 向反应后的溶液中滴加氯化钡溶液 | 产生白色沉淀, 其反应的化学方程式为 | 猜想三正确 |
| C | 用镊子取一片pH试纸浸入反应后的溶液中 | 试纸变色,对照标准比色卡,PH | 猜想三正确 |
| D | 向反应后的溶液中加入锌片 | 猜想三正确 |
[得出结论]猜想三正确。
[评价反思]
(1)老师对同学们能用多种方案进行探究,并且得出正确的实验结论给予了肯定,同时指出探究中存在一处明显的错误操作:
(2)有同学对实验方案B的结论提出了质疑,认为仅凭此现象不能得出猜想三正确,请说明理由:
[总结提高]依据所给实验用品,设计不同的方案确认猜想三是正确的。请写出你的实验方案的化学方程式
您最近一年使用:0次
科学探究题
|
适中
(0.65)
名校
解题方法
【推荐3】胃液中主要含有盐酸,盐酸若分泌过少,常引起消化不良,若分泌过多,对胃和十二指肠黏膜有侵蚀作用.止酸剂的主要作用机理是利用其有效成分与盐酸反应,治疗胃酸过多.某兴趣小组的同学对市面上常见的几种止酸剂展开了探究.
【活动一】止酸剂的反应原理
(1)兴趣小组的同学在调查市面上常见的止酸剂后,选取了实验室中的碳酸氢钠(俗称_____ )氢氧化铝、氧化镁模拟止酸剂与胃酸反应,请写出氢氧化铝与胃酸反应的化学方程式______ 。
【活动二】比较止酸剂的止酸效果
查阅资料:胃液的PH为0.9~1.5,胃蛋白酶作用的最适pH为2~3.5,随着pH的升高,酶活性逐步降低,当pH超过6时,将发生不可逆转的变性而失去活性。
实验步骤:小组同学搭建如图所示装置,气球中加入固体物质,三颈烧瓶中放入稀盐酸,实验时将气球中的固体物质放入瓶中,用压强、pH传感器测定实验过程中的变化。

(2)装置中气球的作用是______ 。
(3)三种物质与稀盐酸反应后的压强变化如图1所示,可知曲线①对应的物质是______ ,由此推断服用过后可能会引起胃胀。

(4)三种物质与稀盐酸反应后的pH变化如图2所示,根据资料信息,推断止酸效果较好的物质是_______ 。

【活动三】测定某胃药中碳酸氢钠的含量。
兴趣小组的同学定量测定某品牌胃药中碳酸氢钠的含量,步骤如下:
①分别配制7.3%的稀盐酸和4%的氢氧化钠;
②取一粒药片(1.0g)研碎后加入20mL蒸馏水溶解;
③用4%的NaOH溶液去中和,共用去10g;
④加入10g7.3%的稀盐酸
(5)测定过程正确的操作顺序是_____ ,根据实验数据,计算药片中NaHCO3的质量分数为______ 。
【活动四】课后拓展
(6)小组同学还查到一种止酸剂为铝碳酸镁片,已知它与盐酸反应会生成两种盐,请完成下面的化学方程式
______ 
【活动一】止酸剂的反应原理
(1)兴趣小组的同学在调查市面上常见的止酸剂后,选取了实验室中的碳酸氢钠(俗称
【活动二】比较止酸剂的止酸效果
查阅资料:胃液的PH为0.9~1.5,胃蛋白酶作用的最适pH为2~3.5,随着pH的升高,酶活性逐步降低,当pH超过6时,将发生不可逆转的变性而失去活性。
实验步骤:小组同学搭建如图所示装置,气球中加入固体物质,三颈烧瓶中放入稀盐酸,实验时将气球中的固体物质放入瓶中,用压强、pH传感器测定实验过程中的变化。

(2)装置中气球的作用是
(3)三种物质与稀盐酸反应后的压强变化如图1所示,可知曲线①对应的物质是

(4)三种物质与稀盐酸反应后的pH变化如图2所示,根据资料信息,推断止酸效果较好的物质是

【活动三】测定某胃药中碳酸氢钠的含量。
兴趣小组的同学定量测定某品牌胃药中碳酸氢钠的含量,步骤如下:
①分别配制7.3%的稀盐酸和4%的氢氧化钠;
②取一粒药片(1.0g)研碎后加入20mL蒸馏水溶解;
③用4%的NaOH溶液去中和,共用去10g;
④加入10g7.3%的稀盐酸
(5)测定过程正确的操作顺序是
【活动四】课后拓展
(6)小组同学还查到一种止酸剂为铝碳酸镁片,已知它与盐酸反应会生成两种盐,请完成下面的化学方程式


您最近一年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐1】化学兴趣小组对金属钠在空气中燃烧及其产物进行研究,
【查阅资料】①金属钠在空气中燃烧生成淡黄色的固体过氧化钠( );
);
②过氧化钠能和水或二氧化碳反应: ;
;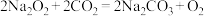 .
.
【发现问题】将淡黄色固体露置于空气中,一段时间后变为白色粉末.
【提出问题】白色粉末可能是什么物质?
【做出猜想】
(1)猜想1:NaOH;猜想2:NaOH和 ;猜想3:
;猜想3:______ .
【设计方案】
(2)为确定该白色粉末的成分,老师为同学们提供了稀盐酸、石蕊试液、酚酞试液、氢氧化钙溶液、氯化钡溶液等试剂,请选择合适的试剂进行设计实验方案,验证猜想2正确:______ .
【总结反思】
(3)证明NaOH和 同时存在的思路是
同时存在的思路是______ .
【查阅资料】①金属钠在空气中燃烧生成淡黄色的固体过氧化钠(
 );
);②过氧化钠能和水或二氧化碳反应:
 ;
;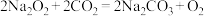 .
.【发现问题】将淡黄色固体露置于空气中,一段时间后变为白色粉末.
【提出问题】白色粉末可能是什么物质?
【做出猜想】
(1)猜想1:NaOH;猜想2:NaOH和
 ;猜想3:
;猜想3:【设计方案】
(2)为确定该白色粉末的成分,老师为同学们提供了稀盐酸、石蕊试液、酚酞试液、氢氧化钙溶液、氯化钡溶液等试剂,请选择合适的试剂进行设计实验方案,验证猜想2正确:
【总结反思】
(3)证明NaOH和
 同时存在的思路是
同时存在的思路是
您最近一年使用:0次
【推荐2】某兴趣小组的同学帮老师一起整理实验室时,他们看到了一个不和谐的“音符”(如图)。

(1)此情此景你首先想到的是它可能变质了,该变质反应的化学方程式为______ 。
(2)围绕此瓶NaOH溶液是否变质的问题,兴趣小组同学利用当时实验桌上的三种试剂(氯化钙溶液、稀盐酸、酚酞试液)展开了探究活动。
①小丽取少量溶液于试管中,滴加某种试剂,有气泡产生,证明NaOH溶液已经变质。你认为小丽所加的试剂是______ 。
②为进一步验证这瓶NaOH溶液变质的程度如何,小组同学开展了如下探究活动。
【提出猜想】猜想1:NaOH溶液部分变质。猜想2:NaOH溶液完全变质。
【实验探究】小组同学设计实验方案,证明了上述猜想。请根据表中内容填写实验时的现象
【反思与评价】下列物质可代替探究实验中氯化钙溶液的是______ (填序号)。
A.氢氧化钙溶液 B.氯化钡溶液 C.稀盐酸
(3)实验室保存NaOH溶液的方法是______ 。

(1)此情此景你首先想到的是它可能变质了,该变质反应的化学方程式为
(2)围绕此瓶NaOH溶液是否变质的问题,兴趣小组同学利用当时实验桌上的三种试剂(氯化钙溶液、稀盐酸、酚酞试液)展开了探究活动。
①小丽取少量溶液于试管中,滴加某种试剂,有气泡产生,证明NaOH溶液已经变质。你认为小丽所加的试剂是
②为进一步验证这瓶NaOH溶液变质的程度如何,小组同学开展了如下探究活动。
【提出猜想】猜想1:NaOH溶液部分变质。猜想2:NaOH溶液完全变质。
【实验探究】小组同学设计实验方案,证明了上述猜想。请根据表中内容填写实验时的现象
| 实验步骤 | 实验操作 | 实验现象 | 实验结论 |
| 步骤一 | 取样品,加水配制成溶液,并向其中滴加过量氯化钙溶液,充分反应后过滤 | 有 | 猜想1成立 |
| 步骤二 | 取上述少量滤液于试管中,滴加 |
A.氢氧化钙溶液 B.氯化钡溶液 C.稀盐酸
(3)实验室保存NaOH溶液的方法是
您最近一年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐3】化学兴趣小组同学为探究碳酸钠的化学性质,进行如下实验,请据实验回答:
【实验一】

【实验二】

【实验一】
加入足量稀盐酸后B中看到的现象是_______ 。
【实验二】
①写出C中发生反应的化学方程式_______ 。
②为证明将C过滤后所得溶液中含有那些溶质,将过滤后的溶液平均分成两份,并进行了D、E实验,根据实验现象,说明将C过滤后所得溶液中含有的溶质是_______ (填溶质的化学式)。
结论:Na2CO3可以和酸碱指示剂、酸、碱、盐等发生反应。
【实验一】

【实验二】

【实验一】
加入足量稀盐酸后B中看到的现象是
【实验二】
①写出C中发生反应的化学方程式
②为证明将C过滤后所得溶液中含有那些溶质,将过滤后的溶液平均分成两份,并进行了D、E实验,根据实验现象,说明将C过滤后所得溶液中含有的溶质是
结论:Na2CO3可以和酸碱指示剂、酸、碱、盐等发生反应。
您最近一年使用:0次



