为测定某地石灰石中碳酸钙的质量分数,某兴趣小组将一定质量的石灰石样品粉碎后分成两等份,进行如下实验:
(1)一份放于烧杯中,向烧杯中逐渐加入某一浓度的盐酸,反应过程测得剩余固体质量与加入盐酸的质量关系如图1所示(石灰石中的杂质不与盐酸反应,也不溶与水)。请回答下列问题:
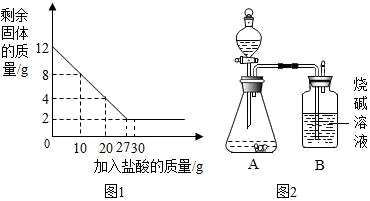
①石灰石样品中碳酸钙的质量分数_____ ;
②通过计算求所用盐酸的溶质质量分数。_____
(2)另一份进行如图2所示的实验:把产生的CO2气体用足量的烧碱溶液吸收,同时测量B瓶烧碱溶液增加的质量,结果如下表所示:
①上表中,第5分钟时,x=_____ ;
②该实验测得样品中碳酸钙的质量分数_____ (填大于、小于或等于)另一实验,其原因可能是_____ 。
(1)一份放于烧杯中,向烧杯中逐渐加入某一浓度的盐酸,反应过程测得剩余固体质量与加入盐酸的质量关系如图1所示(石灰石中的杂质不与盐酸反应,也不溶与水)。请回答下列问题:

①石灰石样品中碳酸钙的质量分数
②通过计算求所用盐酸的溶质质量分数。
(2)另一份进行如图2所示的实验:把产生的CO2气体用足量的烧碱溶液吸收,同时测量B瓶烧碱溶液增加的质量,结果如下表所示:
| 时间/分 | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| B增加的质量 | 0 | 2 | 3 | 4 | 4.6 | X | 4.6 |
②该实验测得样品中碳酸钙的质量分数
2018·广东珠海·三模 查看更多[4]
广东省珠海市紫荆中学2018届九年级第三次模拟考试化学试题(已下线)2019年3月2019届九年级第一次模拟大联考(广东)-化学【市级联考】江苏省徐州市2019届九年级下学期中考二模化学试题【区级联考】山东省泰安市泰山区2019届九年级下学期中考一模化学试题
更新时间:2018-06-12 11:01:49
|
相似题推荐
填空与简答-填空题
|
较难
(0.4)
解题方法
【推荐1】某白色固体可能由碳酸钠、硫酸钠、硫酸铜、硝酸钾、氯化钡中的一种或几种物质组成。同学们为了确定该白色固体的成分,进行了如下实验。
实验一:将白色粉末放入足量的水中,充分溶解后,过滤,得到白色沉淀甲和无色滤液乙。
实验二:向白色沉淀甲中加入过量的稀硝酸-沉淀不溶解。
实验三:将溶液乙蒸干,只得到一种溶质。
(1)通过实验一的现象,确定原白色固体中一定没有的物质是______ 。
(2)写出生成白色沉淀甲的化学方程式______ 。
(3)通过以上三个实验得出原白色固体一定含有______ (写化学式)。
(4)若实验二中的现象为沉淀部分溶解,将7.5g沉淀甲加入足量的稀硫酸,充分反应后,过滤得到7.86g沉淀,则混合物中不溶于酸的沉淀的质量为______ g。
实验一:将白色粉末放入足量的水中,充分溶解后,过滤,得到白色沉淀甲和无色滤液乙。
实验二:向白色沉淀甲中加入过量的稀硝酸-沉淀不溶解。
实验三:将溶液乙蒸干,只得到一种溶质。
(1)通过实验一的现象,确定原白色固体中一定没有的物质是
(2)写出生成白色沉淀甲的化学方程式
(3)通过以上三个实验得出原白色固体一定含有
(4)若实验二中的现象为沉淀部分溶解,将7.5g沉淀甲加入足量的稀硫酸,充分反应后,过滤得到7.86g沉淀,则混合物中不溶于酸的沉淀的质量为
您最近一年使用:0次
【推荐2】味精是生活中的调味品。味精的鲜味来自于主要成分“谷氨酸钠”(化学式是C5H8NO4Na,易溶于水,与AgNO3不反应),另外还含有NaCl及其它成分。
(1)实验表明,味精在100 ℃时加热半小时,只有0.3%的味精(谷氨酸钠)生成焦谷氨酸钠(有毒),对人体的影响甚微。对此,下列认识正确的是_____________ 。
a.味精不能吃,对人体有害 b.尽量避免在菜肴温度较高时使用味精
c.生成焦谷氨酸钠的过程是物理变化 d.实验是研究问题的一种有效方法
(2)称取5.0 g味精配制成50 g溶液,量取蒸馏水的量筒规格是_____________ 。
a.10 mL b.50 mL c.100 mL
(3)右图是配制过程,正确的操作顺序为_____________ (填序号)。

(4)为测定味精中NaCl的质量分数,进行如下
实验:向上述配制好的溶液中加入AgNO3 溶液至___________ ,充分反应。反应的化学方程式是___________ 。过滤后得沉淀质量为2.87 g,则该味精中NaCl的质量分数为___________ 。
(5)实验后对比味精袋上的标签,发现所测得的NaCl的质量分数偏高,则可能的原因的是___________ (填字母)。
a.配制溶液时仰视量水 b.反应中加入的AgNO3溶液过量
c.洗涤、干燥沉淀不彻底 d.味精中有其它能与AgNO3反应生成沉淀的物质
(1)实验表明,味精在100 ℃时加热半小时,只有0.3%的味精(谷氨酸钠)生成焦谷氨酸钠(有毒),对人体的影响甚微。对此,下列认识正确的是
a.味精不能吃,对人体有害 b.尽量避免在菜肴温度较高时使用味精
c.生成焦谷氨酸钠的过程是物理变化 d.实验是研究问题的一种有效方法
(2)称取5.0 g味精配制成50 g溶液,量取蒸馏水的量筒规格是
a.10 mL b.50 mL c.100 mL
(3)右图是配制过程,正确的操作顺序为

(4)为测定味精中NaCl的质量分数,进行如下
实验:向上述配制好的溶液中加入AgNO3 溶液至
(5)实验后对比味精袋上的标签,发现所测得的NaCl的质量分数偏高,则可能的原因的是
a.配制溶液时仰视量水 b.反应中加入的AgNO3溶液过量
c.洗涤、干燥沉淀不彻底 d.味精中有其它能与AgNO3反应生成沉淀的物质
您最近一年使用:0次
填空与简答-流程题
|
较难
(0.4)
名校
【推荐3】过氧化钙晶体(CaO2.8H2O)较稳定,呈白色,微溶于水,广泛应用于环境杀菌、消毒。以贝壳为原料制备CaO2流程如下:

(1)气体X的名称是________ ;将过氧化钙晶体与溶液分离的方法是________ ;
(2)反应Y需控制温度在0~5°C,可将反应容器放在________ 中,该反应是化合反应,反应产物是CaO2∙8H2O,请写出化学方程式_____ ;获得的过氧化钙晶体中常含有Ca( OH)2杂质,原因是______ ;
(3)过氧化钙晶体(CaO2∙8H2O)的相对分子质量为______ ;H、O元素的质量比为_______ ;
(4)为测定制得的过氧化钙晶体中CaO2∙8H2O的质量分数,设计的实验如下:称取晶体样品50g,加热到220°C充分反应(方程式为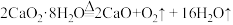 ,杂质不发生变化),测得生成氧气的质量为3.2g,请计算样品中CaO2∙8H2O的质量分数,写出必要的计算过程。
,杂质不发生变化),测得生成氧气的质量为3.2g,请计算样品中CaO2∙8H2O的质量分数,写出必要的计算过程。_______ 。

(1)气体X的名称是
(2)反应Y需控制温度在0~5°C,可将反应容器放在
(3)过氧化钙晶体(CaO2∙8H2O)的相对分子质量为
(4)为测定制得的过氧化钙晶体中CaO2∙8H2O的质量分数,设计的实验如下:称取晶体样品50g,加热到220°C充分反应(方程式为
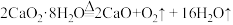 ,杂质不发生变化),测得生成氧气的质量为3.2g,请计算样品中CaO2∙8H2O的质量分数,写出必要的计算过程。
,杂质不发生变化),测得生成氧气的质量为3.2g,请计算样品中CaO2∙8H2O的质量分数,写出必要的计算过程。
您最近一年使用:0次
填空与简答-简答题
|
较难
(0.4)
解题方法
【推荐1】将打磨过的一定量铝放入60g一定浓度的氢氧化钠溶液中,恰好完全反应,得到偏铝酸钠(NaA1O2)溶液和密度最小的气体,其反应的化学方程为________________ ;实验测得反应前后溶液中钠元素的质量分数之比为26:25,则实验前加入铝片的质量为_____________________ g。
您最近一年使用:0次
填空与简答-流程题
|
较难
(0.4)
名校
【推荐2】为了测定某稀硫酸的溶质的质量分数,设计了如图1实验方案。


第②步实验测得的部分数据见图2:
(1)分析第②步实验:首先与80g NaOH溶液反应的物质是_____ (填化学式)
(2)计算稀硫酸的溶质的质量分数是多少?_____ (写出具体计算过程)
(3)a的读数为_____ ,b的读数为 _____ 。
(4)将最后得到的蓝色沉淀经洗涤、烘干后,充分加热得到黑色固体CuO质量为_____ 。


第②步实验测得的部分数据见图2:
(1)分析第②步实验:首先与80g NaOH溶液反应的物质是
(2)计算稀硫酸的溶质的质量分数是多少?
(3)a的读数为
(4)将最后得到的蓝色沉淀经洗涤、烘干后,充分加热得到黑色固体CuO质量为
您最近一年使用:0次
填空与简答-填空题
|
较难
(0.4)
解题方法
【推荐3】现有氧化铜、氢氧化铜的混合物共1g,向其中加入10g9.8%的稀硫酸恰好完全反应,则固体混合物中铜元素的质量为__________ ,反应后所得溶液的溶质质量分数为_________ (结果精确到0.1%)。
您最近一年使用:0次
填空与简答-推断题
|
较难
(0.4)
名校
解题方法
【推荐1】如图涉及的是我们最近复习的六种物质。用“一”表示两种物质之间能发生反应,用“→”表示一种物质可以转化为另一种物质。其中打开B瓶塞会有白雾,其中A和F为两种铁矿石主要成分,试回答下列问题:

(1)写出化学式E________ ,F________ ;
(2)用“→”补全还有的转化关系(初中范围内)______ ;
(3)B和D反应的化学方程式为________ 。

(1)写出化学式E
(2)用“→”补全还有的转化关系(初中范围内)
(3)B和D反应的化学方程式为
您最近一年使用:0次
填空与简答-流程题
|
较难
(0.4)
解题方法
【推荐2】以煤粉灰(主要成分为A12O3、SiO2及少量Fe2O3等)为原料制取A12O3的部分工艺流程如下图:

【资料】FeC13溶液中滴入KSCN溶液会呈血红色
(1)“酸浸”包含操作溶解和_______ 。“酸浸”时温度不宜过高的原因是_________ 。滤渣的主要成分是_________ 。
(2)“除铁”时,发生的反应为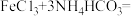
_______ 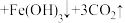 ;检验溶液中铁元素已除尽的方法是
;检验溶液中铁元素已除尽的方法是_________ 。
(3)“结晶”是向浓溶液中通入HCl气体,从而获得A1Cl3·6H2O晶体的过程。溶液中Al3+和盐酸的浓度随通气时间的变化如右图所示。由此可得出的结论是_______ 。

(4)“煅烧”时发生反应的化学方程式_________ 。
(5)上述流程中,可以循环利用的物质是_________ 。
(6)高温烧结的氧化铝,又称人造刚玉或人造宝石,可用于制机械轴承、钟表中的钻石、坩埚、高强度陶瓷等。由此可推知氧化铝的性质有 。

【资料】FeC13溶液中滴入KSCN溶液会呈血红色
(1)“酸浸”包含操作溶解和
(2)“除铁”时,发生的反应为
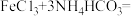
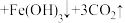 ;检验溶液中铁元素已除尽的方法是
;检验溶液中铁元素已除尽的方法是(3)“结晶”是向浓溶液中通入HCl气体,从而获得A1Cl3·6H2O晶体的过程。溶液中Al3+和盐酸的浓度随通气时间的变化如右图所示。由此可得出的结论是

(4)“煅烧”时发生反应的化学方程式
(5)上述流程中,可以循环利用的物质是
(6)高温烧结的氧化铝,又称人造刚玉或人造宝石,可用于制机械轴承、钟表中的钻石、坩埚、高强度陶瓷等。由此可推知氧化铝的性质有 。
| A.硬度大 | B.熔点高 | C.性质稳定 |
您最近一年使用:0次




