化学兴趣小组探究金属的性质时,将一段去除氧化膜的镁条,放入一定量的稀盐酸中,有气泡产生,充分反应后静置,发现试管中有灰白色沉淀。写出产生气泡的反应化学方程式______ 。
【提出问题】灰白色沉淀是什么物质?
【猜想假设】①小华认为灰白色沉淀为碳酸镁(MgCO3),其他同学认为不需要实验就能否定小华的猜想,理由是_____________________ 。
②小宇认为由于反应后氯化镁的生成量偏多,灰白色沉淀为不能再溶解的氯化镁固体。
③小彤认为灰白色沉淀为__________________ 。
【实验探究1】
基于以上探究与分析,原有猜想均遭到了否定。
【查阅资料】
HCl+AgNO3═HNO3+AgCl↓,AgCl是一种白色沉淀。氯化氢是酸性气体,能使蓝色石蕊试纸变红。进行分析:
【实验探究2】
他们又另取灰白色沉淀放入试管中加热,将蘸有硝酸银溶液的玻璃棒伸入试管内,玻璃棒上的溶液出现白色浑浊,证明产生了__ 气体。如何检验这种气体_______ (实验步骤、现象、结论)。
同学们请教老师后得知,足量的镁与稀盐酸反应时,溶液会经历从酸性到碱性且碱性逐步增强的过程,从而生成了碱式氯化镁沉淀。据文献介绍,碱式氯化镁存在多种组成结构,化学通式可表示为Mgx(OH)yClz•mH2O(其中2x﹣y﹣z=0,0≤m≤6)。
【反思拓展】
(1)做镁与稀盐酸反应的实验时,为了不让试管中出现灰白色沉淀,镁条的用量_______ 。
(2)铁片和铜片放入稀硫酸中产生的现象也不相同,据此推测出铁的活动性比铜_____ 。
【提出问题】灰白色沉淀是什么物质?
【猜想假设】①小华认为灰白色沉淀为碳酸镁(MgCO3),其他同学认为不需要实验就能否定小华的猜想,理由是
②小宇认为由于反应后氯化镁的生成量偏多,灰白色沉淀为不能再溶解的氯化镁固体。
③小彤认为灰白色沉淀为
【实验探究1】
| 实验操作 | 现象 | 结论 |
| ①取试管中的上层清液,加入适量的氯化镁固体 | 氯化镁固体 | 小宇猜想错误 |
| ②取适量白色沉淀加入足量稀盐酸中 | 没有气泡冒出 | 小彤猜想错误 |
基于以上探究与分析,原有猜想均遭到了否定。
【查阅资料】
HCl+AgNO3═HNO3+AgCl↓,AgCl是一种白色沉淀。氯化氢是酸性气体,能使蓝色石蕊试纸变红。进行分析:
【实验探究2】
他们又另取灰白色沉淀放入试管中加热,将蘸有硝酸银溶液的玻璃棒伸入试管内,玻璃棒上的溶液出现白色浑浊,证明产生了
同学们请教老师后得知,足量的镁与稀盐酸反应时,溶液会经历从酸性到碱性且碱性逐步增强的过程,从而生成了碱式氯化镁沉淀。据文献介绍,碱式氯化镁存在多种组成结构,化学通式可表示为Mgx(OH)yClz•mH2O(其中2x﹣y﹣z=0,0≤m≤6)。
【反思拓展】
(1)做镁与稀盐酸反应的实验时,为了不让试管中出现灰白色沉淀,镁条的用量
(2)铁片和铜片放入稀硫酸中产生的现象也不相同,据此推测出铁的活动性比铜
2019·福建漳州·一模 查看更多[4]
【校级联考】福建省长泰县第一中学、华安县第一中学2019届九年级下学期第一次联考化学试题安徽省淮南市钱庙中学2019届九年级下学期中考模拟化学试题安徽省安徽省淮南市钱庙中学2019届九年级下学期中考模拟化学试题(已下线)高分突破06 有关金属活动性的探究-备战2022年中考化学实验探究题高分突破
更新时间:2019-03-28 17:14:34
|
相似题推荐
科学探究题
|
困难
(0.15)
解题方法
【推荐1】铁、铜的氧化物能与氢气、一氧化碳和氨气(NH3)等具有还原性的气体反应生成金属单质,某研究性学习小组设计实验进行系列探究。
(一)探究氨气(NH3)与氧化铜的反应
【资料一】
①实验室常用浓氨水和生石灰混合的方法制取氨气:CaO+NH3·H2O=Ca(OH)2+NH3↑。
②碱石灰和浓硫酸是常用的干燥剂,浓硫酸能与氨气反应
③Cu2O是一种红色固体,能与稀硫酸反应:Cu2O+H2SO4=Cu+CuSO4+H2O。
Cu和硫酸不反应。

(1)小组同学按图设计组装好仪器,装入药品前应进行的实验操作是_______
(2)A中烧瓶内发生的反应为_______ 反应(填“放热”或“吸热”)。
(3)C中玻璃管内氨气与氧化铜在加热条件下完全反应生成铜、水和一种气体单质X,反应的化学方程式为_______ ,反应过程中氨气也可能将氧化铜还原为Cu2O。反应一段时间后,C中固体全部变为红色,取反应后固体少许于试管中,加入足量的稀硫酸,观察到溶液呈_______ ,说明红色固体中含有Cu2O,该红色固体的成分是_______ (写出所有可能)。
(4)气体X的密度和空气接近,难溶于水,上图D处欲用下图装置①②③收集较纯净的气体X并测其体积,装置的连接顺序是_______ 。

(二)探究一氧化碳与铁的氧化物反应
【资料二】
①Fe2O3·xH2O在温度为110℃时分解为Fe2O3和H2O,FeCO3在282℃时分解为FeO和CO2。
②温度高于500℃时铁的氧化物才能被CO还原。
③用CO还原Fe2O3炼铁的过程大致分为三个阶段
阶段1:3Fe2O3+CO 2Fe3O4+CO2
2Fe3O4+CO2
阶段2:Fe3O4+CO 3FeO+CO2
3FeO+CO2
阶段3:FeO+CO Fe+CO2
Fe+CO2
(5)已知铁锈的成分为Fe2O3·xH2O和FeCO3,由此可知:铁生锈过程中,空气中的氧气、水和___ 都参与了反应。
(6)小组同学将铁锈在300℃热分解的产物继续分阶段升温,通入CO还原铁的氧化物。剩余固体质量随温度变化的曲线如下图所示。E点固体的成分是____ ,G点固体的成分是____
计算图中G点对应的a的值,写出计算过程____ 。

(7)金属矿物资源储量有限且不可再生,为防止铁制品生锈,可以采取____ 的措施。
(一)探究氨气(NH3)与氧化铜的反应
【资料一】
①实验室常用浓氨水和生石灰混合的方法制取氨气:CaO+NH3·H2O=Ca(OH)2+NH3↑。
②碱石灰和浓硫酸是常用的干燥剂,浓硫酸能与氨气反应
③Cu2O是一种红色固体,能与稀硫酸反应:Cu2O+H2SO4=Cu+CuSO4+H2O。
Cu和硫酸不反应。

(1)小组同学按图设计组装好仪器,装入药品前应进行的实验操作是
(2)A中烧瓶内发生的反应为
(3)C中玻璃管内氨气与氧化铜在加热条件下完全反应生成铜、水和一种气体单质X,反应的化学方程式为
(4)气体X的密度和空气接近,难溶于水,上图D处欲用下图装置①②③收集较纯净的气体X并测其体积,装置的连接顺序是

(二)探究一氧化碳与铁的氧化物反应
【资料二】
①Fe2O3·xH2O在温度为110℃时分解为Fe2O3和H2O,FeCO3在282℃时分解为FeO和CO2。
②温度高于500℃时铁的氧化物才能被CO还原。
③用CO还原Fe2O3炼铁的过程大致分为三个阶段
阶段1:3Fe2O3+CO
 2Fe3O4+CO2
2Fe3O4+CO2阶段2:Fe3O4+CO
 3FeO+CO2
3FeO+CO2阶段3:FeO+CO
 Fe+CO2
Fe+CO2(5)已知铁锈的成分为Fe2O3·xH2O和FeCO3,由此可知:铁生锈过程中,空气中的氧气、水和
(6)小组同学将铁锈在300℃热分解的产物继续分阶段升温,通入CO还原铁的氧化物。剩余固体质量随温度变化的曲线如下图所示。E点固体的成分是
计算图中G点对应的a的值,写出计算过程

(7)金属矿物资源储量有限且不可再生,为防止铁制品生锈,可以采取
您最近一年使用:0次
科学探究题
|
困难
(0.15)
【推荐2】小华将浸泡过硫酸铜溶液后晾干所得的蓝色滤纸放在酒精灯火焰上,观察到滤纸并不会立即燃烧,而是由蓝变白后才燃烧。他好奇地发现在燃烧后的灰烬中有少量红色固体,于是进行多次重复试验,收集到一定量的红色固体后进行了相关探究。
【提出问题】红色固体是什么物质?它是如何产生的?
【查阅资料】①蓝色CuSO4•5H2O在200℃左右失水生成白色CuSO4,CuSO4在500℃左右开始分解生成CuO和另一种非金属化合物A。
②温度超过1000℃,CuO会分解生成氧化亚铜(Cu2O);Cu2O是红色固体,能与稀硫酸发生如下反应:Cu2O+H2SO4=CuSO4+Cu+H2O。
【提出猜想】猜想I:红色固体是Cu:猜想Ⅱ:红色固体是Cu2O;猜想Ⅲ:红色固体是____ 。
【实验探究】操作1:取少量红色固体在酒精灯外焰上灼烧,红色固体出现变黑现象。操作2:取少量红色固体于试管中,加入稀硫酸,固体不溶解,溶液无色。
【得出结论】操作1证明猜想____ 不能成立。操作2证明猜想____ 也不能成立。
由此确定,红色固体是____ 。
【拓展反思】
(1)经过晾干的硫酸铜蓝色滤纸放在火焰上不能立即燃烧,是因为____ 。
(2)滤纸主要含碳、氢、氧三种元素,红色固体应该是滤纸在燃烧过程中产生的碳或一氧化碳与CuO发生反应的结果。其中,一氧化碳与CuO反应的化学方程式为____ 。
(3)若CuSO4受热分解前后各元素的化合价保持不变,则A的化学式为____ 。
(4)我国古代采用煅烧绿矾法制硫酸。若在空气中进行煅烧,可发生的反应之一是4FeSO4+O2 2X+4A,则X的化学式为
2X+4A,则X的化学式为____ ,X的主要用途是____ (写一条)。
【提出问题】红色固体是什么物质?它是如何产生的?
【查阅资料】①蓝色CuSO4•5H2O在200℃左右失水生成白色CuSO4,CuSO4在500℃左右开始分解生成CuO和另一种非金属化合物A。
②温度超过1000℃,CuO会分解生成氧化亚铜(Cu2O);Cu2O是红色固体,能与稀硫酸发生如下反应:Cu2O+H2SO4=CuSO4+Cu+H2O。
【提出猜想】猜想I:红色固体是Cu:猜想Ⅱ:红色固体是Cu2O;猜想Ⅲ:红色固体是
【实验探究】操作1:取少量红色固体在酒精灯外焰上灼烧,红色固体出现变黑现象。操作2:取少量红色固体于试管中,加入稀硫酸,固体不溶解,溶液无色。
【得出结论】操作1证明猜想
由此确定,红色固体是
【拓展反思】
(1)经过晾干的硫酸铜蓝色滤纸放在火焰上不能立即燃烧,是因为
(2)滤纸主要含碳、氢、氧三种元素,红色固体应该是滤纸在燃烧过程中产生的碳或一氧化碳与CuO发生反应的结果。其中,一氧化碳与CuO反应的化学方程式为
(3)若CuSO4受热分解前后各元素的化合价保持不变,则A的化学式为
(4)我国古代采用煅烧绿矾法制硫酸。若在空气中进行煅烧,可发生的反应之一是4FeSO4+O2
 2X+4A,则X的化学式为
2X+4A,则X的化学式为
您最近一年使用:0次
科学探究题
|
困难
(0.15)
解题方法
【推荐3】探究乙醇(俗名酒精,化学式为C2H5OH)的元素组成,进行以下实验。
【查阅资料】①工业酒精(含少量水)可作酒精灯的燃料
②101.3kPa时,酒精的沸点为78.5℃
③酒精灯灯芯的主要成分是天然纤维素【(C6H10O5)n】
④无水硫酸铜遇水由白色变蓝色
【实验1】进行如图甲实验_____ 元素;从选取原料的角度分析:此步骤设计的不足之处是_____ 。
(2)若步骤2现象不明显的原因可能是_____ ;从选取原料的角度分析:此步骤设计的不足之处是_____ 。
【实验2】进行如图乙实验_____ 。
(4)步骤2瓶内壁出现白雾,由此_____ (填“能”或“不能”)肯定该白雾即是水。
(5)步骤3观察到的现象是_____ ,由此推理出乙醇中一定含_____ 元素。
【实验3】进行如图丙实验_____ 。
【查阅资料】①工业酒精(含少量水)可作酒精灯的燃料
②101.3kPa时,酒精的沸点为78.5℃
③酒精灯灯芯的主要成分是天然纤维素【(C6H10O5)n】
④无水硫酸铜遇水由白色变蓝色
【实验1】进行如图甲实验
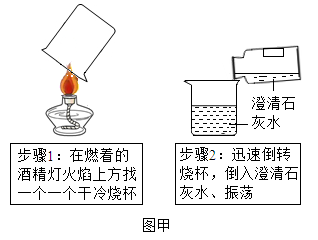
(2)若步骤2现象不明显的原因可能是
【实验2】进行如图乙实验

(4)步骤2瓶内壁出现白雾,由此
(5)步骤3观察到的现象是
【实验3】进行如图丙实验

您最近一年使用:0次
【推荐1】【科学探究】
锰钢(含Fe、Mn、C等)是具有优良金属性能的合金,在生产生活中有广泛的应用。
查阅文献得知:①金属锰是难溶于水的灰白色固体。
②金属锰在水溶液中反应通常显 价,使溶液呈肉色。
价,使溶液呈肉色。
③锰钢板中锰元素的含量一般在11%至14%之间。
(1)锰钢常用作高铁轨道,写一条锰钢具有的性质:___________ 。
兴趣小组同学为了解Mn、Fe、Cu三种金属的活动性顺序,进行了如下探究。
(2)根据金属活动性顺序( ),对Mn的金属活动性提出了三种猜想:
),对Mn的金属活动性提出了三种猜想:
猜想I: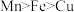 ;
;
猜想Ⅱ: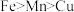 ;
;
猜想Ⅲ:___________ 。
(3)进行实验:
【分析评价】
(4)有同学认为实验1除了颜色的变化还应该有其他实验现象,理由是___________ (任选一个,用化学方程式解释)。
【补充实验】
(5)为更好地探究过量的硫酸与等质量的铁和锰反应实验(如下图所示),气球膨胀速度较快的是___________ (选填“Mn”或“Fe”),产生气体质量较大的是___________ (选填“Mn”或“Fe”)。
(6)交流:金属与酸的反应快慢还受哪些因素的影响呢?(请根据上表解答)
①金属与酸反应的接触面积;②___________ 。
(7)你认为金属与酸反应,可能还受哪些因素的影响:___________ (说出一项即可)。
锰钢(含Fe、Mn、C等)是具有优良金属性能的合金,在生产生活中有广泛的应用。
查阅文献得知:①金属锰是难溶于水的灰白色固体。
②金属锰在水溶液中反应通常显
 价,使溶液呈肉色。
价,使溶液呈肉色。③锰钢板中锰元素的含量一般在11%至14%之间。
(1)锰钢常用作高铁轨道,写一条锰钢具有的性质:
兴趣小组同学为了解Mn、Fe、Cu三种金属的活动性顺序,进行了如下探究。
(2)根据金属活动性顺序(
 ),对Mn的金属活动性提出了三种猜想:
),对Mn的金属活动性提出了三种猜想:猜想I:
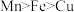 ;
;猜想Ⅱ:
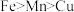 ;
;猜想Ⅲ:
(3)进行实验:
| 实验序号 | 操作 | 现象 | 结论 |
| 1 | 将三种打磨好,粗细质量相同的金属片,分别放入相同的稀硫酸中 | 放入铁片溶液呈绿色,放入锰片溶液为肉色,放入铜片溶液为无色 | 猜想 |
| 2 | 将打磨好的锰片放入硫酸亚铁溶液中 | 猜想I正确 |
【分析评价】
(4)有同学认为实验1除了颜色的变化还应该有其他实验现象,理由是
【补充实验】
(5)为更好地探究过量的硫酸与等质量的铁和锰反应实验(如下图所示),气球膨胀速度较快的是
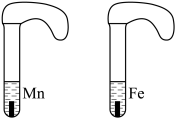
| 实验编号 | 盐酸的浓度 (均取20mL) | 金属 (均取2g) | 金属的形状 | 收集50mL氢气所需时间/s |
| ① | 10% | 铝 | 粉状 | 70 |
| ② | 10% | 铁 | 片状 | 120 |
| ③ | 10% | 铝 | 片状 | 112 |
| ④ | 20% | 铁 | 片状 | 110 |
(6)交流:金属与酸的反应快慢还受哪些因素的影响呢?(请根据上表解答)
①金属与酸反应的接触面积;②
(7)你认为金属与酸反应,可能还受哪些因素的影响:
您最近一年使用:0次
科学探究题
|
困难
(0.15)
名校
解题方法
【推荐2】化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究
【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】 a.可能与金属本身的性质有关,b .可能与酸的浓度有关
【设计探究】实验前所用金属均已用砂纸打磨。
实验一:为探究猜想 a,小组同学分别在两支试管中放入相同质量的金属单质 X 和 Y,然后分别加入相同浓度和质量的稀盐酸,观察到放金属 X 的试管中 立即产生大量气泡,放金属 Y 的试管中只产生少量气泡。从实验现象可判断: 金属活动性 x__ y (填“< ”或“=”或“> ”)。由此想出结论:金属与盐酸发生反应的剧烈程度与金属本身性质有关。
实验二:为探究猜想 b,小组同学设计如下图所示的实验,其中注射器的作用是______________________________
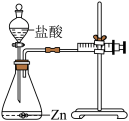
收集数据如下表
【得出结论】金属与盐酸发生反应的剧烈程度与盐酸的浓度有关,其关系是____________________________ ;
【反思评价】根据表一中实验 II 数据分析,请描述 Zn 与 HCl 发生反应快慢的变化情况并解释原 因_____________________________ ;
【拓展延伸】很多金属不仅能与酸反应,也能与化合物的溶液反应。现将 a g 铁钉投入到 CuSO4溶液中, 反应一段时间后,将固体取出洗净、烘干,称重为 b g,则生成铜的质量为_____________________________ g
【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】 a.可能与金属本身的性质有关,b .可能与酸的浓度有关
【设计探究】实验前所用金属均已用砂纸打磨。
实验一:为探究猜想 a,小组同学分别在两支试管中放入相同质量的金属单质 X 和 Y,然后分别加入相同浓度和质量的稀盐酸,观察到放金属 X 的试管中 立即产生大量气泡,放金属 Y 的试管中只产生少量气泡。从实验现象可判断: 金属活动性 x
实验二:为探究猜想 b,小组同学设计如下图所示的实验,其中注射器的作用是

收集数据如下表
| 实验编号 | 选用金属 (均取2g, 大小一致) | 盐酸(均取50mL) 质量分数 | 每分钟产生氢气的体积/mL | |||||
| 1分钟 | 1~2分钟 | 2~3分钟 | 3~4分钟 | 4~5分钟 | 前5分钟共收集气体 | |||
| I | 锌片 | 15% | 2.9 | 16.9 | 11.9 | 9.2 | 7.6 | 48.5 |
| Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
【反思评价】根据表一中实验 II 数据分析,请描述 Zn 与 HCl 发生反应快慢的变化情况并解释原 因
【拓展延伸】很多金属不仅能与酸反应,也能与化合物的溶液反应。现将 a g 铁钉投入到 CuSO4溶液中, 反应一段时间后,将固体取出洗净、烘干,称重为 b g,则生成铜的质量为
您最近一年使用:0次
【推荐3】小聪同学家新换了水龙头,从说明书上了解到该水龙头是铜质镀铬。好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,邀请你一起参加。
【提出猜想】猜想一:Cr>Fe>Cu;猜想二:__________ ;猜想三:Fe>Cu>Cr。
【查阅资料】(1)铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。
(2)铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀且致密的氧化膜。
【设计实验】小聪同学取大小相同的三种金属片,用砂纸打磨光亮,分别置于三支试管中,再往其中分别放入等质量的相同质量分数的稀硫酸。
【结论与解释】(3)小聪得到的结论是猜想______ 正确。
(4)实验前用砂纸打磨金属片的目的是___________ 。
【知识运用】将铬片投入FeSO4溶液中,反应___ (填“能”或“不能”)进行。若能进行,请你写出反应的化学方程式_______________ 。
【拓展探究】为了测定金属镁样品中镁的质量分数(杂质不含镁元素,不溶于水,也不与其它物质发生反应),进行了如下实验。

据图计算:
(5)实验过程中产生氢气的总质量为____ g。
(6)所用稀盐酸的溶质质量分数______ 。
(7)该金属镁样品中镁的质量分数_____ 。
【提出猜想】猜想一:Cr>Fe>Cu;猜想二:
【查阅资料】(1)铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。
(2)铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀且致密的氧化膜。
【设计实验】小聪同学取大小相同的三种金属片,用砂纸打磨光亮,分别置于三支试管中,再往其中分别放入等质量的相同质量分数的稀硫酸。
| 实验 | 试管1 | 试管2 | 试管3 |
| 实 验 操 作 |  |  |  |
| 实验 现象 | 铁片表面产生气泡较慢,溶液变为浅绿色 | 铬片表面产生气泡较快,溶液变成为蓝色 |
(4)实验前用砂纸打磨金属片的目的是
【知识运用】将铬片投入FeSO4溶液中,反应
【拓展探究】为了测定金属镁样品中镁的质量分数(杂质不含镁元素,不溶于水,也不与其它物质发生反应),进行了如下实验。

据图计算:
(5)实验过程中产生氢气的总质量为
(6)所用稀盐酸的溶质质量分数
(7)该金属镁样品中镁的质量分数
您最近一年使用:0次
科学探究题
|
困难
(0.15)
解题方法
【推荐1】某学习小组的同学对实验室制取二氧化碳及二氧化碳的性质进行如下两个方面的探究。
Ⅰ.二氧化碳的制取
第一小组用如图①所示的装置制取二氧化碳并测定生成二氧化碳的体积,实验开始时他们通过分液漏斗将20 mL稀盐酸快速全部加入锥形瓶中并关闭活塞,记录盘简中水的体积,数据如下表所示:

(1)丙中最好选规格为_______ (填“50”、“”或“250”)mL的量筒。
(2)乙中如果不加植物油就会使测定结果________ (填“偏大”或“偏小”),原因是____________ 。
(3)根据以上实验数据分析,最终生成二氧化碳的体积是___ mL。
Ⅱ.二氧化碳的性质
第二小组用如图②所示装置验证二氧化碳的有关性质。

实验步骤如下:
步骤一:按如图②所示连接好装置,向外拉动任一注射器的活塞,一段时间后松开手。
步骤二:注射器A中吸入20 mL澄清石灰水,注射器B中吸入20 mL盐酸,再从中间瓶口通入二氧化碳气体将瓶装满,最后旋上带压力传感器的橡胶塞。
步骤三:先后将两注射器中的试剂快速全部推入三颈烧瓶中,并保持注射器活塞在注射器底部,振荡三颈烧瓶,压力传感器测得三颈烧瓶中压强随时间变化如图③所示。
(4)步骤一中松开手后,若观察到_______ ,则说明装置气密性良好。
(5)在步骤二中如何检验三颈烧瓶中已充满二氧化碳气体___________ 。
(6)分析图③可知,步骤三中先推的是注射器_______ (填“A”或“B”,此时三颈烧瓶中发生反应的文字表达式为_____________ 。
(7)步骤三中第二次推入试剂后,三颈烧瓶中压强变化对应图③中的_______ 段(填“ab”、“bc”或“cd”)。
Ⅰ.二氧化碳的制取
第一小组用如图①所示的装置制取二氧化碳并测定生成二氧化碳的体积,实验开始时他们通过分液漏斗将20 mL稀盐酸快速全部加入锥形瓶中并关闭活塞,记录盘简中水的体积,数据如下表所示:

| 时间/min | 1 | 2 | 3 | 4 | 5 | 6 |
| 量筒读数/mL | 40 | 50 | 55 | 58 | 60 | 60 |
(1)丙中最好选规格为
(2)乙中如果不加植物油就会使测定结果
(3)根据以上实验数据分析,最终生成二氧化碳的体积是
Ⅱ.二氧化碳的性质
第二小组用如图②所示装置验证二氧化碳的有关性质。

实验步骤如下:
步骤一:按如图②所示连接好装置,向外拉动任一注射器的活塞,一段时间后松开手。
步骤二:注射器A中吸入20 mL澄清石灰水,注射器B中吸入20 mL盐酸,再从中间瓶口通入二氧化碳气体将瓶装满,最后旋上带压力传感器的橡胶塞。
步骤三:先后将两注射器中的试剂快速全部推入三颈烧瓶中,并保持注射器活塞在注射器底部,振荡三颈烧瓶,压力传感器测得三颈烧瓶中压强随时间变化如图③所示。
(4)步骤一中松开手后,若观察到
(5)在步骤二中如何检验三颈烧瓶中已充满二氧化碳气体
(6)分析图③可知,步骤三中先推的是注射器
(7)步骤三中第二次推入试剂后,三颈烧瓶中压强变化对应图③中的
您最近一年使用:0次
科学探究题
|
困难
(0.15)
解题方法
【推荐2】某化学兴趣小组在某次实验中发现镁、钠都能在纯净的二氧化碳中燃烧,反应后瓶底有黑色颗粒,瓶壁上附着有白色物质。经检验,黑色颗粒是碳。他们对白色物质的成分分别进行了如下探究:
探究活动一:镁在纯净的二氧化碳中燃烧生成的白色物质是什么?
同学们认为一定不是Mg(OH)2,理由是________ 。
【作出猜想】猜想①MgO:猜想②________ 。猜想③MgO和MgCO3的混合物。
【进行实验】取少量白色物质于试管中,加入足量的稀盐酸,观察到__________ ,证明猜想①正确。
【实验结论】镁在二氧化碳中燃烧的化学方程式为_________ 。
探究活动二:钠在纯净的二氧化碳中燃烧生成的白色物质是什么?
【查阅资料】a金属钠能与冷水发生剧烈反应;b.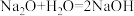 。
。
【作出猜想】猜想①Na2O:猜想②Na2CO3:猜想③Na2O和Na2CO3的混合物。
【实验设计】同学们设计了以下方案进行探究:
步骤I中加入Ca(OH)2溶液发生反应的化学方程式为________ 。
【实验反思】小东认为上述方案不合理,理由是________ 。
【拓展应用】实验室里镁、钠等金属发火灾时,可以选用的灭火物质是________ (填序号)。
A.水 B.二氧化碳 C.干沙土
探究活动一:镁在纯净的二氧化碳中燃烧生成的白色物质是什么?
同学们认为一定不是Mg(OH)2,理由是
【作出猜想】猜想①MgO:猜想②
【进行实验】取少量白色物质于试管中,加入足量的稀盐酸,观察到
【实验结论】镁在二氧化碳中燃烧的化学方程式为
探究活动二:钠在纯净的二氧化碳中燃烧生成的白色物质是什么?
【查阅资料】a金属钠能与冷水发生剧烈反应;b.
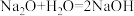 。
。【作出猜想】猜想①Na2O:猜想②Na2CO3:猜想③Na2O和Na2CO3的混合物。
【实验设计】同学们设计了以下方案进行探究:
| 实验步骤 | 实验现象 | 实验结论 |
| I.取少量白色物质于试管中,加水溶解,再加入足量的Ca(OH)2溶液 | 白色物质中有Na2CO3 | |
| Ⅱ.静置,向上层清液中滴加无色酚酞溶液 | 溶液变红 | 白色物质中有Na2O |
【实验反思】小东认为上述方案不合理,理由是
【拓展应用】实验室里镁、钠等金属发火灾时,可以选用的灭火物质是
A.水 B.二氧化碳 C.干沙土
您最近一年使用:0次
科学探究题
|
困难
(0.15)
解题方法
【推荐3】.甲、乙同学在学完酸的化学性质后,做了如下实验:
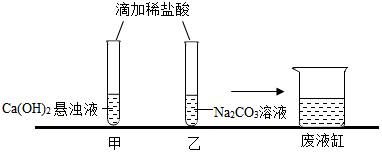
实验结束,甲、乙同学依次将废液缓慢倒入同一洁净的废液缸中,然后进行了讨论。
【观察与讨论1】甲同学在做实验时没有观察到明显现象,于是对氢氧化钙溶液和稀盐酸能发生反应表示怀疑。但乙同学认为,甲同学实验时向氢氧化钙溶液中应先滴几滴酚酞试液,再滴加适量的稀盐酸,当观察到(1)_________ 时。就可以说明两种物质能发生反应。
【观察与讨论2】当乙同学沿废液缸内壁缓慢倾倒液体时,观察到废液缸中先有气泡产生,然后又出现了白色沉淀。经过讨论确定,甲、乙同学试管中废液含有的溶质分别是(2)_____ (3) ___________ (均写化学式),才会出现上述现象。
为了科学处理试验后产生的废液,甲、乙同学决定对废液缸中最终废液溶质的成分进行探究。
【提出问题】最终废液中含有什么溶质?
【猜想与假设】甲同学猜想:废液中含有NaCl、CaCl2两种物质
乙同学猜想:废液中含有NaCl、Na2CO3两种物质
【活动与探究】甲、乙同学为了验证自己的猜想分别同时进行了如下实验:
甲同学实验:取少量废液于试管中,向其中滴加碳酸钠溶液,无明显现象。
得出结论:甲猜想不成立,则 乙猜想成立。
乙同学实验:取少量废液于试管中,向其中滴加氯化钙溶液,出现白色沉淀。
得出结论:乙猜想成立,则甲猜想不成立。
【反思与评价】请对甲同学由实验现象得出的结论给予评价(4)____________________ 。
【表达与交流】甲、乙同学确认了最终废液中溶质的成分。你认为处理该废液的方法是
(5)_________________________________________ 。

实验结束,甲、乙同学依次将废液缓慢倒入同一洁净的废液缸中,然后进行了讨论。
【观察与讨论1】甲同学在做实验时没有观察到明显现象,于是对氢氧化钙溶液和稀盐酸能发生反应表示怀疑。但乙同学认为,甲同学实验时向氢氧化钙溶液中应先滴几滴酚酞试液,再滴加适量的稀盐酸,当观察到(1)
【观察与讨论2】当乙同学沿废液缸内壁缓慢倾倒液体时,观察到废液缸中先有气泡产生,然后又出现了白色沉淀。经过讨论确定,甲、乙同学试管中废液含有的溶质分别是(2)
为了科学处理试验后产生的废液,甲、乙同学决定对废液缸中最终废液溶质的成分进行探究。
【提出问题】最终废液中含有什么溶质?
【猜想与假设】甲同学猜想:废液中含有NaCl、CaCl2两种物质
乙同学猜想:废液中含有NaCl、Na2CO3两种物质
【活动与探究】甲、乙同学为了验证自己的猜想分别同时进行了如下实验:
甲同学实验:取少量废液于试管中,向其中滴加碳酸钠溶液,无明显现象。
得出结论:甲猜想不成立,则 乙猜想成立。
乙同学实验:取少量废液于试管中,向其中滴加氯化钙溶液,出现白色沉淀。
得出结论:乙猜想成立,则甲猜想不成立。
【反思与评价】请对甲同学由实验现象得出的结论给予评价(4)
【表达与交流】甲、乙同学确认了最终废液中溶质的成分。你认为处理该废液的方法是
(5)
您最近一年使用:0次



