黄铜矿(主要成分是CuFeS2)经初步处理后,所得溶液甲中溶质为Fe2(SO4)3、CuSO4及H2SO4。某同学通过废铁屑与溶液甲反应,制取补血剂原料碳酸亚铁并回收铜。主要步骤如图所示[Fe2(SO4)3+Fe═3FeSO4]:
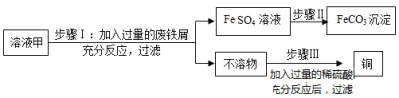
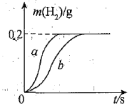
图1 图2
(1)步骤Ⅰ加入的废铁屑中含有少量铁锈,但对产物的成分没有影响,原因是_____ .
(2)步骤Ⅱ中加入一种可溶性试剂可实现其转化,该试剂可以是_____ 。
(3)为了测定步骤Ⅲ中所用稀硫酸的溶质质量分数,该同学取两份相同溶质质量分数的稀硫酸各100g,分别加入等质量的铁和锌,相同条件下充分反应,产生氢气的质量随时间变化的曲线如图2所示,则下列说法正确的是_____ 。
A 表示锌和稀硫酸反应的情况的是曲线a
B 稀硫酸的溶质质量分数为9.8%
C 加入铁的质量至少有5.6g
D 加入锌的质量可能是13g


图1 图2
(1)步骤Ⅰ加入的废铁屑中含有少量铁锈,但对产物的成分没有影响,原因是
(2)步骤Ⅱ中加入一种可溶性试剂可实现其转化,该试剂可以是
(3)为了测定步骤Ⅲ中所用稀硫酸的溶质质量分数,该同学取两份相同溶质质量分数的稀硫酸各100g,分别加入等质量的铁和锌,相同条件下充分反应,产生氢气的质量随时间变化的曲线如图2所示,则下列说法正确的是
A 表示锌和稀硫酸反应的情况的是曲线a
B 稀硫酸的溶质质量分数为9.8%
C 加入铁的质量至少有5.6g
D 加入锌的质量可能是13g
更新时间:2019-06-28 09:24:20
|
相似题推荐
填空与简答-流程题
|
较难
(0.4)
解题方法
【推荐1】废旧手机的电路板中含有铝、铁、铜、银、金等多种金属,随意丢弃既会造成资源浪费,也会污染土壤和水体。化学兴趣小组为回收其中的铜,设计并进行了如下实验。已知:Cu+H2O2+H2SO4=CuSO4+2H2O;不考虑金、银发生类似反应。
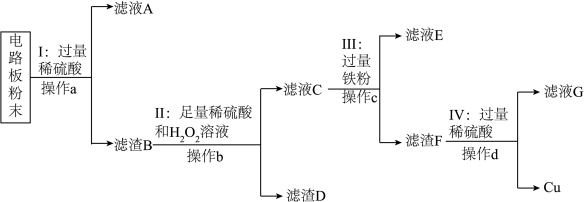
(1)将电路板粉碎成粉末的目的是_____ 。
(2)滤液A中的溶质除硫酸外,还有_____ 。
(3)步骤Ⅱ中的实验现象是:固体部分溶解,_____ 。
(4)上述步骤_____ (选填步骤编号)所包含的反应体现铁的活动性比铜强。
(5)步骤IV中反应的化学方程式是_____ ;判断步骤Ⅳ中加入的稀硫酸过量的方法是_____ 。

(1)将电路板粉碎成粉末的目的是
(2)滤液A中的溶质除硫酸外,还有
(3)步骤Ⅱ中的实验现象是:固体部分溶解,
(4)上述步骤
(5)步骤IV中反应的化学方程式是
您最近一年使用:0次
填空与简答-推断题
|
较难
(0.4)
【推荐2】如下图,甲、乙、丙为常见的单质,A与B是组成元素相同的常见液体,D与E是组成元素相同的常见气体,C为红色粉末,丙为黑色固体,D能进行光合作用。图中的反应条件和部分反应物、生成物已略去,请回答:
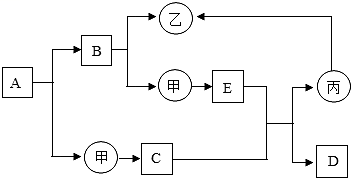
(1)E的化学式为_____________ .
(2)由B生成甲和乙的反应的基本反应类型为___________ .
(3)乙和C反应生成丙的化学方程式为________________________________ .
(4)实验室检验D气体的化学反应方程式为_____________________ .

(1)E的化学式为
(2)由B生成甲和乙的反应的基本反应类型为
(3)乙和C反应生成丙的化学方程式为
(4)实验室检验D气体的化学反应方程式为
您最近一年使用:0次
填空与简答-流程题
|
较难
(0.4)
解题方法
【推荐3】硫酸锌在工业、医学上有诸多应用。可用菱锌矿(主要成分是 ,含有少量的
,含有少量的 和
和 )制备
)制备 ,其制备流程如图所示,回答下列问题:
,其制备流程如图所示,回答下列问题: 难溶于水,也不与稀硫酸反应。①
难溶于水,也不与稀硫酸反应。①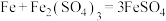
(1)将菱锌矿粉碎的目的是________ 。
(2)“酸浸”中可观察到的现象是________ 。
(3)滤液1中含有的阳离子是________ (填离子符号)。
(4)“转化”中加入足量锌粉,除发生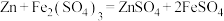 外,还发生的另一个反应为
外,还发生的另一个反应为________ (填化学方程式)。
(5)下列说法正确的是________(填字母)。
 ,含有少量的
,含有少量的 和
和 )制备
)制备 ,其制备流程如图所示,回答下列问题:
,其制备流程如图所示,回答下列问题:
 难溶于水,也不与稀硫酸反应。①
难溶于水,也不与稀硫酸反应。①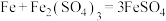
(1)将菱锌矿粉碎的目的是
(2)“酸浸”中可观察到的现象是
(3)滤液1中含有的阳离子是
(4)“转化”中加入足量锌粉,除发生
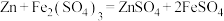 外,还发生的另一个反应为
外,还发生的另一个反应为(5)下列说法正确的是________(填字母)。
| A.在“转化”中可以用铁粉代替锌粉除去杂质 |
| B.滤渣甲、滤渣乙均能与稀硫酸反应产生气体 |
| C.滤液2的质量一定比滤液1的质量大 |
您最近一年使用:0次
填空与简答-填空题
|
较难
(0.4)
解题方法
【推荐1】向含有氯化钠、氯化钙和稀盐酸的混合溶液中滴加碳酸钠溶液, 溶液的 pH变化情况如图所示:

(1)0-a段发生的化学反应方程式为___________ 。
(2)a-b 段溶液的 pH 没有变化的原因是:___________ 。

(1)0-a段发生的化学反应方程式为
(2)a-b 段溶液的 pH 没有变化的原因是:
您最近一年使用:0次
填空与简答-流程题
|
较难
(0.4)
解题方法
【推荐2】某废水中含有AgNO3、Ca(NO3)2、Fe(NO3)2、Cu(NO3)2、NaNO3几种物质。为了回收金属,同时得到较纯的硝酸钠,保护环境,化学小组的同学设计了一个处理该废水的实验方案,流程如下:

[查阅资料]白色的Fe(OH)2沉淀在潮湿空气中会迅速转化为红褐色的Fe(OH)3。
(1)操作X的名称是_______ 。
(2)操作中加入过量金属Fe,用铁粉末比铁片更好,其原因是_____ ,加入过量金属Fe可以除去废水中的______ 。
(3)溶液C中含有的阴离子有______ 。
(4)写出白色的Fe(OH)2沉淀转化为红褐色Fe(OH)3反应的化学方程式:______ 。
(5)化学兴趣小组对以上流程得到的NaNO3液进行检测,分析后可知得到的NaNO3溶液不纯,含有杂质,则最后得到的NaNO3溶液所含的杂质是_____ 。

[查阅资料]白色的Fe(OH)2沉淀在潮湿空气中会迅速转化为红褐色的Fe(OH)3。
(1)操作X的名称是
(2)操作中加入过量金属Fe,用铁粉末比铁片更好,其原因是
(3)溶液C中含有的阴离子有
(4)写出白色的Fe(OH)2沉淀转化为红褐色Fe(OH)3反应的化学方程式:
(5)化学兴趣小组对以上流程得到的NaNO3液进行检测,分析后可知得到的NaNO3溶液不纯,含有杂质,则最后得到的NaNO3溶液所含的杂质是
您最近一年使用:0次
填空与简答-推断题
|
较难
(0.4)
名校
【推荐3】A、B、C、D、E、F是初中常见的六种物质,其中A、E、F属于相同类别的物质,B是人体胃液的主要成分,C是生活中最常见的一种液体(图中用“-”表示两种物质间能发生反应,用“→”或“↔”表示两种物质间能单向或双向转化,部分反应物和生成物及反应条件已略去,图中部分反应需在溶液中进行,物质是溶液的只考虑溶质),六种物质的部分反应和转化关系如图所示:

(1)请写出下列物质(或溶质)的化学式:B:_________ D:________ 。
(2)F转化为E的化学方程式为:__________ 。
(3)A转化为E的现象为___________ 。

(1)请写出下列物质(或溶质)的化学式:B:
(2)F转化为E的化学方程式为:
(3)A转化为E的现象为
您最近一年使用:0次



