碳酸钠用途非常广泛,是工业生产中重要的化工原料。在1921年我国科学家侯德榜创造了一种著名的纯碱生产方法——“侯氏制碱法”。“侯氏制碱法”生产过程如下:
(1)第一步主要反应为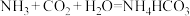 ,该反应属于
,该反应属于_________ 反应基本反应类型。在生产中为了得到饱和 溶液,气体通入的顺序是
溶液,气体通入的顺序是________ 。
(2)第二步用食盐与 反应。食盐来源于某盐田,该粗盐主要含有氯化钠,此外还含有少量硫酸钠、氯化钙和氯化镁。经净化、精制得到生产碳酸钠所需要的食盐水,其主要流程如图所示。
反应。食盐来源于某盐田,该粗盐主要含有氯化钠,此外还含有少量硫酸钠、氯化钙和氯化镁。经净化、精制得到生产碳酸钠所需要的食盐水,其主要流程如图所示。
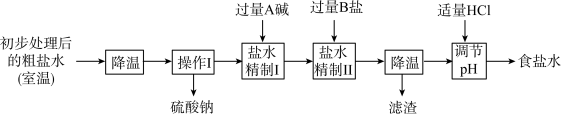
①通过降温使硫酸钠从粗盐水中析出,其原理是____________________________ 。
②“精制Ⅰ”操作中,加入过量含钙元素的碱的化学式是___________ ,其化学反应方程式为_________ 。
③“精制Ⅱ”操作中,加入B盐的有关化学方程式为_____________ 。
④检验“精制Ⅱ”操作中B盐过量的实验方法是_______________ 。
⑤查阅资料得知有关物质在30℃时的溶解度如下表所示:
根据溶解度表所提供的信息,推断“侯氏制碱法”中的第二步属于复分解反应的化学方程式为____________ 。反应后,经过过滤、_____________ 可获得碳酸氢钠。为了滤液中分离出副产品 ,可向滤液中通入某种气体,同时加入磨细的食盐,可析出不夹带
,可向滤液中通入某种气体,同时加入磨细的食盐,可析出不夹带 的
的 ,
, 和
和 的溶解度曲线如图所示,通入的气体和控制的温度应该是
的溶解度曲线如图所示,通入的气体和控制的温度应该是_____________ 。
A. 、0~10℃B.
、0~10℃B.  、30~40℃
、30~40℃
C. 、0~10℃D.
、0~10℃D.  、30~40℃
、30~40℃
(3)第三步煅烧碳酸氢钠制得碳酸钠,反应的化学方程式为____________ 。
(4)“侯氏制碱法”的优点是原料中各原子的利用率高,除水以外可在本法中再用的物质有______________________ (填写化学式)。
(1)第一步主要反应为
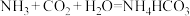 ,该反应属于
,该反应属于 溶液,气体通入的顺序是
溶液,气体通入的顺序是(2)第二步用食盐与
 反应。食盐来源于某盐田,该粗盐主要含有氯化钠,此外还含有少量硫酸钠、氯化钙和氯化镁。经净化、精制得到生产碳酸钠所需要的食盐水,其主要流程如图所示。
反应。食盐来源于某盐田,该粗盐主要含有氯化钠,此外还含有少量硫酸钠、氯化钙和氯化镁。经净化、精制得到生产碳酸钠所需要的食盐水,其主要流程如图所示。
①通过降温使硫酸钠从粗盐水中析出,其原理是
②“精制Ⅰ”操作中,加入过量含钙元素的碱的化学式是
③“精制Ⅱ”操作中,加入B盐的有关化学方程式为
④检验“精制Ⅱ”操作中B盐过量的实验方法是
⑤查阅资料得知有关物质在30℃时的溶解度如下表所示:
| 温度 |  |  |  |  |  |
| 30℃ | 41.1g | 27.0g | 11.1g | 36.3g | 39.7g |
 ,可向滤液中通入某种气体,同时加入磨细的食盐,可析出不夹带
,可向滤液中通入某种气体,同时加入磨细的食盐,可析出不夹带 的
的 ,
, 和
和 的溶解度曲线如图所示,通入的气体和控制的温度应该是
的溶解度曲线如图所示,通入的气体和控制的温度应该是
A.
 、0~10℃B.
、0~10℃B.  、30~40℃
、30~40℃C.
 、0~10℃D.
、0~10℃D.  、30~40℃
、30~40℃(3)第三步煅烧碳酸氢钠制得碳酸钠,反应的化学方程式为
(4)“侯氏制碱法”的优点是原料中各原子的利用率高,除水以外可在本法中再用的物质有
更新时间:2019-08-26 10:46:51
|
相似题推荐
综合应用题
|
困难
(0.15)
名校
解题方法
【推荐1】改造物质应用物质。我国海岸线长达 3.2 万千米,海洋专属经济区幅员辽阔,海洋资源丰富,开发的前景十分远大.

【海水淡化】采用如图 1 所示的膜分离法淡化海水,水分子可以通过淡化膜进入左侧的淡水池,从而得到淡水。下列说法中正确的是_______ (选字母序号)。
A膜分离法也是一种分离混合物的方法
B膜分离法的原理与滤纸过滤原理类似
C通过膜分离法可将海水中的可溶性杂质除尽
D加压后右侧海水中溶质的质量增大
【粗盐提纯】除去难溶性杂质后的食盐水中还含有Ca2+、Mg2+、SO42-等杂质离子,得到较纯的氯化钠,进行如下的流程的实验操作,请填空:①加入过量的 NaOH 溶液;②_______ ;③_______ ;④过滤;⑤加入适量稀盐酸; ⑥蒸发。在利用粗盐制备精盐过程的第⑤步操作中,加入适量盐酸的目的是_____________ 。
【海水制镁】部分途径如图2。实际生产中,步骤Ⅲ常选用___________ 作为沉淀剂,母液中本来就有氯 化镁, 为什么还要经过Ⅲ、Ⅳ两步转换再得到氯化镁?_______ 。
【海水制碱】将氨气通入饱和食盐水中,可制成饱和氨盐水(氨气极易溶于水)。氨盐水比食盐水更容易吸收二氧化碳的原因是:______________ 。
【反思与评价】浩瀚的海洋将为我们全人类贡献丰富的资源。同学们:除了可燃冰、食盐以外,你还能从化学学科角度再说出一种你所知道的海洋资源吗?_______________ 。

【海水淡化】采用如图 1 所示的膜分离法淡化海水,水分子可以通过淡化膜进入左侧的淡水池,从而得到淡水。下列说法中正确的是
A膜分离法也是一种分离混合物的方法
B膜分离法的原理与滤纸过滤原理类似
C通过膜分离法可将海水中的可溶性杂质除尽
D加压后右侧海水中溶质的质量增大
【粗盐提纯】除去难溶性杂质后的食盐水中还含有Ca2+、Mg2+、SO42-等杂质离子,得到较纯的氯化钠,进行如下的流程的实验操作,请填空:①加入过量的 NaOH 溶液;②
【海水制镁】部分途径如图2。实际生产中,步骤Ⅲ常选用
【海水制碱】将氨气通入饱和食盐水中,可制成饱和氨盐水(氨气极易溶于水)。氨盐水比食盐水更容易吸收二氧化碳的原因是:
【反思与评价】浩瀚的海洋将为我们全人类贡献丰富的资源。同学们:除了可燃冰、食盐以外,你还能从化学学科角度再说出一种你所知道的海洋资源吗?
您最近一年使用:0次
综合应用题
|
困难
(0.15)
名校
解题方法
【推荐2】浩瀚的大海里蕴藏着丰富的资源,开发海水资源前景广阔。
(1)工业上利用太阳能进行海水晒盐。已知海水蒸发浓缩过程中析出盐的种类和质量如下表:(表中数据为每升海水在浓缩过程中析出各种盐的质量,单位为g)
①海水从密度为1.21g/mL浓缩到1.22g/mL时,下列说法正确的是___________ 。
A.各种盐的溶解度增大B.海水中NaBr的质量分数不变
C.析出粗盐中NaCl的质量分数增大D.海水中水的质量分数不变
②海水在浓缩过程中,最先析出的盐是___________ 。
(2)工业上利用粗盐水(含有少量CaCl2、MgCl2)生产纯碱,工艺流程如图:

已知:ⅰ、常温下,NH3极易溶于水,CO2能溶于水;
ⅱ、NaHCO3加热易分解,Na2CO3加热不易分解。
完成下列填空:
①粗盐水加入沉淀剂NaOH,Na2CO3分别除去MgCl2、CaCl2,固体C为___________ 。
②流程中,先“氨化”后“碳酸化”的目的是___________ 。
③“碳酸化”后过滤获得的NH4Cl可用作___________ 肥,也可先___________ (填“加热”或“冷却”)NH4Cl溶液,再加入石灰水以循环使用的物质是___________ 。
④“煅烧”时,NaHCO3分解生成的气体D是___________ ,若将气体D直接排入空气不合理的理由是___________ 。
(3)以含有CaCl2、MgCl2的卤水和贝壳(主要成分为CaCO3)为主要原料在实验室制备无水CaCl2,流程如图1。

请回答下列问题:
①操作Ⅰ的名称是___________ 。
②以MgCl2为例写出卤水中除去Mg2+时发生反应的化学方程式___________ 。
③操作Ⅱ酸化时应选择的酸是___________ (填化学式)。
④回收的CO2在紫外线照射和催化剂作用下能与水蒸气反应,生成甲烷和氧气,该反应的化学方程式为___________ 。紫外线照射时,在不同催化剂(①、②、③)的作用下,甲烷产量随光照时间的变化如图2所示,在第10小时时,甲烷产量最高是___________ (填写“①”“②”或“③”)。

(1)工业上利用太阳能进行海水晒盐。已知海水蒸发浓缩过程中析出盐的种类和质量如下表:(表中数据为每升海水在浓缩过程中析出各种盐的质量,单位为g)
| 海水密度 | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
①海水从密度为1.21g/mL浓缩到1.22g/mL时,下列说法正确的是
A.各种盐的溶解度增大B.海水中NaBr的质量分数不变
C.析出粗盐中NaCl的质量分数增大D.海水中水的质量分数不变
②海水在浓缩过程中,最先析出的盐是
(2)工业上利用粗盐水(含有少量CaCl2、MgCl2)生产纯碱,工艺流程如图:

已知:ⅰ、常温下,NH3极易溶于水,CO2能溶于水;
ⅱ、NaHCO3加热易分解,Na2CO3加热不易分解。
完成下列填空:
①粗盐水加入沉淀剂NaOH,Na2CO3分别除去MgCl2、CaCl2,固体C为
②流程中,先“氨化”后“碳酸化”的目的是
③“碳酸化”后过滤获得的NH4Cl可用作
④“煅烧”时,NaHCO3分解生成的气体D是
(3)以含有CaCl2、MgCl2的卤水和贝壳(主要成分为CaCO3)为主要原料在实验室制备无水CaCl2,流程如图1。

请回答下列问题:
①操作Ⅰ的名称是
②以MgCl2为例写出卤水中除去Mg2+时发生反应的化学方程式
③操作Ⅱ酸化时应选择的酸是
④回收的CO2在紫外线照射和催化剂作用下能与水蒸气反应,生成甲烷和氧气,该反应的化学方程式为

您最近一年使用:0次
综合应用题
|
困难
(0.15)
名校
【推荐3】碳酸钠在实际生产、生活中有着广泛的用途,如制造玻璃、造纸和纺织等。
(1)碳酸钠俗称苏打或____ 。如图为侯氏制碱法的流程图,通过步骤I后得到的悬浊液中有小苏打(在该溶液中难溶)和一种氮肥,请写出步骤I中发生反应的化学方程式:_____ ;上述过程中得到的氮肥遇碱会生成具有刺激性气味的______ (填化学式),该气体能使_____ ;从流程图中可得出小苏打的一条化学性质是_____ 。

(2)氢氧化钠在空气中容易变质生成碳酸钠,现有放在空气中一段时间的氢氧化钠溶液,其中溶质的成分可能是:猜想①:NaOH;猜想②:Na2CO3;猜想③:_____ 。请设计实验证明猜想③正确。(写出相关的步骤和现象)________
(3)某海洋化工集团生产的碳酸钠产品中含有少量氯化钠杂质,其产品包装袋上标明:碳酸钠≥96%。为测定该产品中碳酸钠的质量分数,现取11.0g碳酸钠样品放入烧杯中,称得烧杯及所盛碳酸钠样品的总质量为158.0g,然后向烧杯中加入100g稀盐酸,充分反应,实验数据记录如下:
请你据此分析计算,该产品中碳酸钠的质量分数_____ (是、否)符合标准。(写出计算过程,结果精确到0.1%)
(4)小强同学想在社区宣传栏出一期“低碳减排·绿色生活”专刊,内容之一是汽车耗油量与二氧化碳排放量间关系。已知:①汽油密度约为0.7kg/L;②汽油(假定其为纯净物,根据汽油中C、H组成关系,其化学式可简单表示为CH2,其燃烧的化学方程式可表示为:2CH2+3O2 2CO2+2H2O;请计算4升汽油完全燃烧生成二氧化碳的质量
2CO2+2H2O;请计算4升汽油完全燃烧生成二氧化碳的质量______ ?
(1)碳酸钠俗称苏打或

(2)氢氧化钠在空气中容易变质生成碳酸钠,现有放在空气中一段时间的氢氧化钠溶液,其中溶质的成分可能是:猜想①:NaOH;猜想②:Na2CO3;猜想③:
(3)某海洋化工集团生产的碳酸钠产品中含有少量氯化钠杂质,其产品包装袋上标明:碳酸钠≥96%。为测定该产品中碳酸钠的质量分数,现取11.0g碳酸钠样品放入烧杯中,称得烧杯及所盛碳酸钠样品的总质量为158.0g,然后向烧杯中加入100g稀盐酸,充分反应,实验数据记录如下:
| 反应时间/min | 3 | 6 | 9 | 12 |
| 烧杯及所盛物质的总质量/g | 255.8 | 254.0 | 253.6 | 253.6 |
请你据此分析计算,该产品中碳酸钠的质量分数
(4)小强同学想在社区宣传栏出一期“低碳减排·绿色生活”专刊,内容之一是汽车耗油量与二氧化碳排放量间关系。已知:①汽油密度约为0.7kg/L;②汽油(假定其为纯净物,根据汽油中C、H组成关系,其化学式可简单表示为CH2,其燃烧的化学方程式可表示为:2CH2+3O2
 2CO2+2H2O;请计算4升汽油完全燃烧生成二氧化碳的质量
2CO2+2H2O;请计算4升汽油完全燃烧生成二氧化碳的质量
您最近一年使用:0次
综合应用题
|
困难
(0.15)
【推荐1】海洋是一个远未完全开发的巨大化学资源宝库,海洋资源的综合利用具有非常广阔的前景。工业上从海水中可提取许多广泛应用于生活、生产、科技等方面的物质和原料。
Ι.从海水中获得淡水
下列方法常用于海水淡化的是____________ (填字母)。
A.蒸馏法 B.吸附法 C.沉淀法 D.过滤法
Ⅱ.从海水中提取溴(Br2)
工业上通常是将氯气通入海水晒盐后的母液中,将溶液中的溴化钠(NaBr)转化为溴单质(Br2),然后鼓入热空气,使溴单质(Br2)从溶液中挥发出来,冷凝后得到粗溴。该过程中主要反应的化学方程式为_______________________ ,其反应类型是 ______________ 。
Ⅲ.从海水中提取金属镁
镁及其合金是一种用途很广的金属材料,工业上从海水晒盐后的母液中提取镁的主要流程如下:
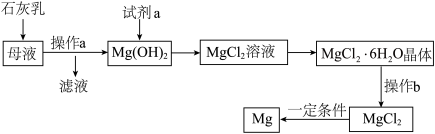
试回答下列问题:
(1)石灰乳主要成分的化学式为_____________ 。
(2)Mg(OH)2中加入试剂a发生反应的化学方程式为____________________________ 。
(3)操作b是在HCl气体氛围中高温灼烧进行的。若直接灼烧MgCl2·6H2O晶体,则生成MgO和另外两种化合物,写出有关反应的化学方程式___________________________ 。
Ⅳ.以海水中提取的食盐为原料制备纯碱
制备过程中主要涉及以下三步反应:
① CO2+NH3+H2O =NH4HCO3
② NH4HCO3 + NaCl=NaHCO3 ↓ + NH4Cl
③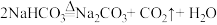
试回答下列问题:
(1)制备过程中可以直接循环回收利用的物质是H2O和__________________ 。
(2)在实验室里证明反应③中的NaHCO3已完全分解的具体操作是________ 。
(3)某化学兴趣小组认为,在碳酸氢钠完全分解的情况下,所得的纯碱中也会混有来自反应②中的杂质,为此他们进行了如下探究:
a.取2.2g纯碱样品,加水完全溶解得100g溶液;
b.配制100g 3.65%的稀盐酸;
c.取上述一种溶液25g于锥形瓶中,再将另一种溶液逐滴加入锥形瓶内,反应后溶液的pH变化情况如下图所示。

步骤c中当滴入另一种溶液为10g时,锥形瓶内物质恰好完全反应。则纯碱样品中碳酸钠的质量分数为___________ (写出计算过程,计算结果保留1位小数)
Ι.从海水中获得淡水
下列方法常用于海水淡化的是
A.蒸馏法 B.吸附法 C.沉淀法 D.过滤法
Ⅱ.从海水中提取溴(Br2)
工业上通常是将氯气通入海水晒盐后的母液中,将溶液中的溴化钠(NaBr)转化为溴单质(Br2),然后鼓入热空气,使溴单质(Br2)从溶液中挥发出来,冷凝后得到粗溴。该过程中主要反应的化学方程式为
Ⅲ.从海水中提取金属镁
镁及其合金是一种用途很广的金属材料,工业上从海水晒盐后的母液中提取镁的主要流程如下:

试回答下列问题:
(1)石灰乳主要成分的化学式为
(2)Mg(OH)2中加入试剂a发生反应的化学方程式为
(3)操作b是在HCl气体氛围中高温灼烧进行的。若直接灼烧MgCl2·6H2O晶体,则生成MgO和另外两种化合物,写出有关反应的化学方程式
Ⅳ.以海水中提取的食盐为原料制备纯碱
制备过程中主要涉及以下三步反应:
① CO2+NH3+H2O =NH4HCO3
② NH4HCO3 + NaCl=NaHCO3 ↓ + NH4Cl
③
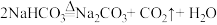
试回答下列问题:
(1)制备过程中可以直接循环回收利用的物质是H2O和
(2)在实验室里证明反应③中的NaHCO3已完全分解的具体操作是
(3)某化学兴趣小组认为,在碳酸氢钠完全分解的情况下,所得的纯碱中也会混有来自反应②中的杂质,为此他们进行了如下探究:
a.取2.2g纯碱样品,加水完全溶解得100g溶液;
b.配制100g 3.65%的稀盐酸;
c.取上述一种溶液25g于锥形瓶中,再将另一种溶液逐滴加入锥形瓶内,反应后溶液的pH变化情况如下图所示。

步骤c中当滴入另一种溶液为10g时,锥形瓶内物质恰好完全反应。则纯碱样品中碳酸钠的质量分数为
您最近一年使用:0次
综合应用题
|
困难
(0.15)
名校
解题方法
【推荐2】纯碱是化学工业生产中一种非常重要的化工原料。
反应原理:NaCl+H2O+NH3+CO2═NaHCO3↓+NH4Cl,
2NaHCO3══Na2CO3++H2O +CO2↑
已知:常温下氨气极易溶于水,1体积水大约可以溶解700体积的氨气;二氧化碳可溶于水,1体积水大约可以溶解1体积二氧化碳。
某课外活动小组模拟工业流程来制备纯碱,实验装置、所需实验药品和装置如图所示:

实验步骤:
(1)搭好装置并________________ 。
(2)中间的烧瓶中加入20mL饱和食盐水,并将其浸入冰水中; D中加入足量生石灰固体,E中加入足量浓氨水,利用该方法制取氨气的原理是_________________________ (写一点即可),根据该原理,生石灰也可以用_________ 固体代替;B中加入足量碳酸钙粉末,A中加入足量稀硫酸于(可分多次加入),写出该反应的化学方程式________________ ,选择用稀硫酸而不用稀盐酸的理由是___________________________ 。
(3)制备NaHCO3:先打开弹簧夹________ (填K1或K2),使对应一侧烧瓶中生成的气体进入饱和食盐水,大约20分钟左右时,再打开另一个弹簧夹,使其一侧的烧瓶中生成的气体进入饱和食盐水,大约5分钟即有浑浊出现,约15分钟出现大量白色固体。这种气体通入先后顺序的目的是_____________________________ 。
在该实验过程中,中间的烧瓶浸入冰水中的目的:___________________________ 。
(4)制备纯碱:欲得到纯碱,上述实验结束后,将固体过滤、洗涤后,还需进行的操作是_____ ;若将制得的纯碱放入足量的稀硫酸中,并将生成的气体全部通入氢氧化钠溶液中,溶液质量增加0.88g,则步骤(3)中制得的NaHCO3的质量是多少?(写出计算过程)_______
反应原理:NaCl+H2O+NH3+CO2═NaHCO3↓+NH4Cl,
2NaHCO3══Na2CO3++H2O +CO2↑
已知:常温下氨气极易溶于水,1体积水大约可以溶解700体积的氨气;二氧化碳可溶于水,1体积水大约可以溶解1体积二氧化碳。
某课外活动小组模拟工业流程来制备纯碱,实验装置、所需实验药品和装置如图所示:

实验步骤:
(1)搭好装置并
(2)中间的烧瓶中加入20mL饱和食盐水,并将其浸入冰水中; D中加入足量生石灰固体,E中加入足量浓氨水,利用该方法制取氨气的原理是
(3)制备NaHCO3:先打开弹簧夹
在该实验过程中,中间的烧瓶浸入冰水中的目的:
(4)制备纯碱:欲得到纯碱,上述实验结束后,将固体过滤、洗涤后,还需进行的操作是
您最近一年使用:0次
【推荐3】碳酸钠广泛用于造纸、纺织、玻璃、洗涤剂、肥皂、制革等工业,是一种重要的化工原料。吕布兰、索尔维和侯德榜为碳酸钠的工业化生产作出了巨大贡献。
Ⅰ、吕布兰法
1789年,法国医生吕布兰(N.Leblanc,1742—1806)以食盐、浓硫酸,木炭和石灰石为原料,开创了规模化工业制取碳酸钠的先河,具体流程如下:

(1)碳酸钠俗称______ 。
(2)在高温条件下,②中发生两步反应,其中一步是Na2SO4和木炭生成Na2S和CO,该反应的化学方程式为______ 。
(3)③中“水浸”时通常需要搅拌,其目的是______ 。
(4)不断有科学家对吕布兰法进行改进,是因为此法有明显不足,请写出一条不足之处______ 。
Ⅱ、索尔维法
1892年,比利时工程师索尔维发明氨碱法制碳酸钠,又称索尔维法。原理如下:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl,2NaHCO3 Na2CO3+CO2↑+H2O。某兴趣小组采用下列装置模拟索尔维法制备碳酸氢钠,进而制得碳酸钠。
Na2CO3+CO2↑+H2O。某兴趣小组采用下列装置模拟索尔维法制备碳酸氢钠,进而制得碳酸钠。

实验操作如下:
①关闭K1,打开K2通入NH3,调节气流速率,待其稳定后,打开K1通入CO2;
②待三颈烧瓶内出现较多固体时,关闭K2停止通NH3,一段时间后,关闭K1停止通CO2;
③将三颈烧瓶内的反应混合物过滤、洗涤、低温干燥,并将所得固体置于敞口容器中加热,记录剩余固体质量。
请回答下列问题:
(5)饱和NaHCO3溶液的作用是除去CO2中混有的HCl,反应的化学方程式为______ 。
(6)三颈烧瓶上连接的长颈漏斗的主要作用是______ ,有同学认为应该在长颈漏斗内放置一团蘸有酸液的棉花,理由是______ ;关闭K2停止通NH3后,还要继续通一段时间
CO2,其目的是______ 。
(7)根据实验记录,计算t2时NaHCO3固体的分解率______ (已分解的NaHCO3质量与加热前原NaHCO3质量的比值),请写出计算过程。若加热前NaHCO3固体中还存在少量NaCl,上述计算结果将_____ (填“偏大”、“偏小”或“无影响”)。
(8)制碱技术在很长一段时间内把持在英、法等西方国家手中,我国化学工程专家侯德榜先生独立摸索出索尔维法并公布于众,又于1943年创造性地将制碱与制氨两种工艺联合起来,基本消除废弃物的排放,同时生产出碳酸钠和氯化铵两种产品,这就是著名的侯氏制碱法。下列认识或理解正确的是______ 。
①科学认识是在曲折的、艰辛的积累过程中不断进步的;
②“科技兴邦、实业救国”是侯德榜先生回国研究的巨大动力;
③侯氏制碱法大大提高了原料的作用率,它符合当今“绿色化学”的理念。
Ⅰ、吕布兰法
1789年,法国医生吕布兰(N.Leblanc,1742—1806)以食盐、浓硫酸,木炭和石灰石为原料,开创了规模化工业制取碳酸钠的先河,具体流程如下:

(1)碳酸钠俗称
(2)在高温条件下,②中发生两步反应,其中一步是Na2SO4和木炭生成Na2S和CO,该反应的化学方程式为
(3)③中“水浸”时通常需要搅拌,其目的是
(4)不断有科学家对吕布兰法进行改进,是因为此法有明显不足,请写出一条不足之处
Ⅱ、索尔维法
1892年,比利时工程师索尔维发明氨碱法制碳酸钠,又称索尔维法。原理如下:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl,2NaHCO3
 Na2CO3+CO2↑+H2O。某兴趣小组采用下列装置模拟索尔维法制备碳酸氢钠,进而制得碳酸钠。
Na2CO3+CO2↑+H2O。某兴趣小组采用下列装置模拟索尔维法制备碳酸氢钠,进而制得碳酸钠。
实验操作如下:
①关闭K1,打开K2通入NH3,调节气流速率,待其稳定后,打开K1通入CO2;
②待三颈烧瓶内出现较多固体时,关闭K2停止通NH3,一段时间后,关闭K1停止通CO2;
③将三颈烧瓶内的反应混合物过滤、洗涤、低温干燥,并将所得固体置于敞口容器中加热,记录剩余固体质量。
| 加热时间/min | t0 | t1 | t2 | t3 | t4 | t5 |
| 剩余固体质量/g | 未记录 | 15.3 | 13.7 | 11.9 | 10.6 | 10.6 |
请回答下列问题:
(5)饱和NaHCO3溶液的作用是除去CO2中混有的HCl,反应的化学方程式为
(6)三颈烧瓶上连接的长颈漏斗的主要作用是
CO2,其目的是
(7)根据实验记录,计算t2时NaHCO3固体的分解率
(8)制碱技术在很长一段时间内把持在英、法等西方国家手中,我国化学工程专家侯德榜先生独立摸索出索尔维法并公布于众,又于1943年创造性地将制碱与制氨两种工艺联合起来,基本消除废弃物的排放,同时生产出碳酸钠和氯化铵两种产品,这就是著名的侯氏制碱法。下列认识或理解正确的是
①科学认识是在曲折的、艰辛的积累过程中不断进步的;
②“科技兴邦、实业救国”是侯德榜先生回国研究的巨大动力;
③侯氏制碱法大大提高了原料的作用率,它符合当今“绿色化学”的理念。
您最近一年使用:0次



