CO2的资源化利用日趋成为研究热点。
(1)查阅资料发现: CO2与H2能在催化剂表面反应生成CH4与H2O; CH4在高温条件下能与CuO反应;无水CuSO4遇水由白变蓝。为探究上述反应,设计如下装置。

①仪器M的名称是_____ ;装置B中反应的化学方程式为 _____ ;
②设计装置C的目的是_____ ;若要证明D中有CO2生成,则需在E、F之间增加盛有 _____ 溶液的洗气瓶。
③一段时间后,装置D中黑色固体变红,E中白色固体变蓝。由此得出结论:以上实验证明CH4在高温条件下能与CuO反应。你是否同意这个结论?_____ (填“同意”或“不同意”),理由是 _____ ;
(2)CH4、乙炔(C2H2)和丙烷(C3H8)都能在空气中燃烧,但是仅C2H2燃烧时有浓烈的黑烟。试从物质组成的角度分析其燃烧现象不同的原因:_____ ;CH4燃料电池具有洁净、高效的特点,其工作时主要是将 _____ 能转化为电能。
(1)查阅资料发现: CO2与H2能在催化剂表面反应生成CH4与H2O; CH4在高温条件下能与CuO反应;无水CuSO4遇水由白变蓝。为探究上述反应,设计如下装置。

①仪器M的名称是
②设计装置C的目的是
③一段时间后,装置D中黑色固体变红,E中白色固体变蓝。由此得出结论:以上实验证明CH4在高温条件下能与CuO反应。你是否同意这个结论?
(2)CH4、乙炔(C2H2)和丙烷(C3H8)都能在空气中燃烧,但是仅C2H2燃烧时有浓烈的黑烟。试从物质组成的角度分析其燃烧现象不同的原因:
更新时间:2019/11/07 23:41:52
|
相似题推荐
填空与简答-填空题
|
适中
(0.65)
解题方法
【推荐1】请用化学用语填空:
(1)①2个铝离子_________ ;
②镁在空气中燃烧生成的主要氧化物_____ ;
③最简单的有机物_____ ;
④海水中最多的金属元素______ 。
(2)请从H、C、O、Ca、N五种元素中选一种或几种元素,写出符合下列要求的化学式。
①能供人体呼吸的气体是_________ ;
②相对分子质量最小的气体是______ ;
③用于改良酸性土壤的物质是_____ ;
④能还原氧化铜的氧化物是______ ;
⑤用作食品干燥剂的物质是_______ ;
⑥含氮量高有机氮肥的是_______ 。
(1)①2个铝离子
②镁在空气中燃烧生成的主要氧化物
③最简单的有机物
④海水中最多的金属元素
(2)请从H、C、O、Ca、N五种元素中选一种或几种元素,写出符合下列要求的化学式。
①能供人体呼吸的气体是
②相对分子质量最小的气体是
③用于改良酸性土壤的物质是
④能还原氧化铜的氧化物是
⑤用作食品干燥剂的物质是
⑥含氮量高有机氮肥的是
您最近一年使用:0次
填空与简答-填空题
|
适中
(0.65)
【推荐2】人类的生活和生产离不开金属,我们要合理的利用开发金属及其矿物资源。
(1)请你写出赤铁矿(主要成分Fe2O3)为原料炼铁的化学方程式为_____
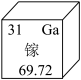
(2)如图是镓在元素周期表中的部分信息,则镓的相对原子质量是_____
(3)金属资源的储量有限,而且不能再生,因此要加强废旧金属的回收。回收废旧手机中的金属材料的意义是_____ (答一点即可)
(1)请你写出赤铁矿(主要成分Fe2O3)为原料炼铁的化学方程式为
(2)如图是镓在元素周期表中的部分信息,则镓的相对原子质量是

(3)金属资源的储量有限,而且不能再生,因此要加强废旧金属的回收。回收废旧手机中的金属材料的意义是
您最近一年使用:0次
填空与简答-填空题
|
适中
(0.65)
解题方法
【推荐3】金属在人类文明史上有着重要的意义。
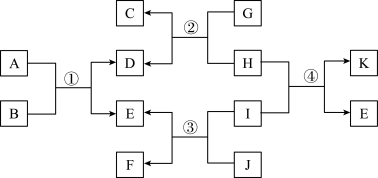
I、金属的应用:越是活泼的金属,越难以从其化合物中冶炼出单质。常见金属的使用发展史如图一所示。______ 。
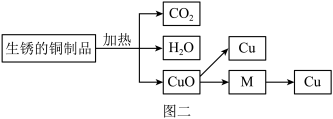
(2)我国的青铜文化历史悠久,但青铜器在放置过程中会生锈,生锈的铜制品主要成分为Cu和Cu2(OH)2CO3,加热Cu2(OH)2CO3能生成CuO、H2O、CO2。若将生锈铜制品中的铜进行回收,可以进行下列图二所示流程进行反应。______ 个;写出一个由CuO直接转化为Cu的化学反应方程式:______ ;在CuO间接转化为Cu的反应途径中,物质M的名称为______ (答一种)。
(3)我国发行的第五套人民币中,1元、5角、1角硬币的材料分别为钢芯镀镍、钢芯镀铜、铝合金。与古时的铜钱相比,合金硬币具有的优点为______(填标号)。
Ⅱ、金属的冶炼:同学们用图三装置进行了工业冶炼铁的模拟实验。(赤铁矿主要成分是氧化铁)______ 现象发生。
(5)从环保角度考虑,此装置的缺点为______ 。
(6)用氧化铁代替赤铁矿进行实验,完全反应后,若要证明氧化铁已经全部转化为铁,可将得到的固体产物冷却、拌匀,取样后进行的操作为______ (观察颜色方法除外)。
Ⅲ、金属活动性的验证:为了验证铁、铜、铝三种金属的活动性强弱,同学们做了图四所示的实验______ (填标号);有现象的实验中,涉及到的基本反应类型为______ 。
(8)同学们实验后反思,认为验证三种金属的活动性的强弱,甲、乙、丙实验中,无需进行的实验为______ 。
I、金属的应用:越是活泼的金属,越难以从其化合物中冶炼出单质。常见金属的使用发展史如图一所示。
(2)我国的青铜文化历史悠久,但青铜器在放置过程中会生锈,生锈的铜制品主要成分为Cu和Cu2(OH)2CO3,加热Cu2(OH)2CO3能生成CuO、H2O、CO2。若将生锈铜制品中的铜进行回收,可以进行下列图二所示流程进行反应。
(3)我国发行的第五套人民币中,1元、5角、1角硬币的材料分别为钢芯镀镍、钢芯镀铜、铝合金。与古时的铜钱相比,合金硬币具有的优点为______(填标号)。
| A.易加工 | B.抗腐蚀性好 | C.硬度大 |
Ⅱ、金属的冶炼:同学们用图三装置进行了工业冶炼铁的模拟实验。(赤铁矿主要成分是氧化铁)

(5)从环保角度考虑,此装置的缺点为
(6)用氧化铁代替赤铁矿进行实验,完全反应后,若要证明氧化铁已经全部转化为铁,可将得到的固体产物冷却、拌匀,取样后进行的操作为
Ⅲ、金属活动性的验证:为了验证铁、铜、铝三种金属的活动性强弱,同学们做了图四所示的实验
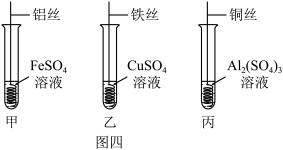
(8)同学们实验后反思,认为验证三种金属的活动性的强弱,甲、乙、丙实验中,无需进行的实验为
您最近一年使用:0次
填空与简答-推断题
|
适中
(0.65)
【推荐1】A~E是初中化学常见的物质,它们之间有如图所示的关系(图中短线“-”表示两端的物质能发生化学反应,箭头“→”表示物质间存在转化关系,部分反应物、生成物及反应条件均已略去)。其中A和C为氧化物,且C为相对分子质量最小的氧化物;D是黑色固体,在常温下性质稳定;B和E的组成元素相同,固态B俗称“干冰”。请回答:
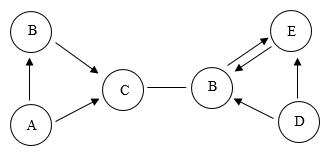
(1)写出下列物质的化学式:B_________ ;D_________ 。
(2)A→C的化学方程式为_________ 。
(3)B与E组成元素相同,但化学性质不同的原因是________ 。
(4)写出E物质的一种用途________ 。

(1)写出下列物质的化学式:B
(2)A→C的化学方程式为
(3)B与E组成元素相同,但化学性质不同的原因是
(4)写出E物质的一种用途
您最近一年使用:0次
填空与简答-流程题
|
适中
(0.65)
名校
解题方法
【推荐2】“一艘舰,单挑美国整个航母战斗群”。你相信这是真的吗?中国海军就创造出了这个奇迹,055型“南昌”驱逐舰与美航母编队缠斗20天,成功将其逼退,展示了中国海军无畏无惧、敢于亮剑的勇气和实力。2024年1月7日,中宣部授予南昌舰党委“时代楷模”光荣称号。钨被称为“战争金属之王”、“国防工业的灵魂”,也是“南昌”舰上最重要的金属之一,江西是世界上钨储量最丰富的地方,已钨的冶炼工艺流程图如下:
(1)操作Ⅰ的名称___________ 。
(2)为了提高碱浸速率,可采取的措施有___________ 。
(3)写出加入 溶液时产生钨酸钙
溶液时产生钨酸钙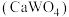 沉淀的化学反应方程式
沉淀的化学反应方程式___________ 。
(4)发展新质生产力的核心理念是创新,以下物质都可以代替工艺中的Al,从环保角度考虑,你的选择是______。
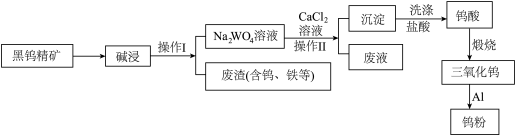
(1)操作Ⅰ的名称
(2)为了提高碱浸速率,可采取的措施有
(3)写出加入
 溶液时产生钨酸钙
溶液时产生钨酸钙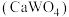 沉淀的化学反应方程式
沉淀的化学反应方程式(4)发展新质生产力的核心理念是创新,以下物质都可以代替工艺中的Al,从环保角度考虑,你的选择是______。
A. | B.C | C.CO |
您最近一年使用:0次
填空与简答-推断题
|
适中
(0.65)
解题方法
【推荐1】如图,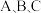 是初中化学常见的三种物质,“—”表示两端的物质相互可以发生反应,“
是初中化学常见的三种物质,“—”表示两端的物质相互可以发生反应,“ ”表示一种物质能一步转化为另一种物质,六种物质间的反应和转化关系均为初中常见的化学反应。
”表示一种物质能一步转化为另一种物质,六种物质间的反应和转化关系均为初中常见的化学反应。
(1)写出稀硫酸与 溶液反应的化学方程式:
溶液反应的化学方程式:_____________ 。
(2)C的化学式为_____________ 。
(3)稀硫酸与B的溶液反应时,可观察到的现象是_____________ 。
(4)A物质不可能是 (填字母)。
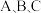 是初中化学常见的三种物质,“—”表示两端的物质相互可以发生反应,“
是初中化学常见的三种物质,“—”表示两端的物质相互可以发生反应,“ ”表示一种物质能一步转化为另一种物质,六种物质间的反应和转化关系均为初中常见的化学反应。
”表示一种物质能一步转化为另一种物质,六种物质间的反应和转化关系均为初中常见的化学反应。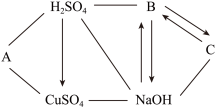
(1)写出稀硫酸与
 溶液反应的化学方程式:
溶液反应的化学方程式:(2)C的化学式为
(3)稀硫酸与B的溶液反应时,可观察到的现象是
(4)A物质不可能是 (填字母)。
| A.金属单质 | B.酸 | C.碱 | D.盐 |
您最近一年使用:0次
填空与简答-填空题
|
适中
(0.65)
真题
解题方法
【推荐2】2023年5月30日18时22分,神舟十六号航天员乘组进入空间站天和核心舱,“小船”对接“大站”圆满成功。
(1)天和核心舱内的气体组成和空气基本一致,其中含量最多的气体是______ 。
(2)航天服中有废气处理系统,能使呼吸产生的废气进入装有活性炭的装置进行净化,这是利用了活性炭的______ 性。
(3)下列航天食品中富含蛋白质的是______(填字母序号)。
(4)航天员排出的二氧化碳可用氢氧化锂(LiOH)吸收,得到碳酸锂(Li2CO3)和水(LiOH和Li2CO3均溶于水),此反应的化学方程式为______ 。
(1)天和核心舱内的气体组成和空气基本一致,其中含量最多的气体是
(2)航天服中有废气处理系统,能使呼吸产生的废气进入装有活性炭的装置进行净化,这是利用了活性炭的
(3)下列航天食品中富含蛋白质的是______(填字母序号)。
| A.脱水米饭 | B.冻干水果 | C.黑椒牛柳 |
您最近一年使用:0次
填空与简答-推断题
|
适中
(0.65)
解题方法
【推荐3】某同学用铁、硫酸、氢氧化钡、硫酸铜和碳酸钠五种物质玩化学拼图游戏(如图),游戏规则要求图中相邻物质之间能发生反应。其中C物质的溶液呈蓝色,A与E反应生成的气体是光合作用的原料之一。(提示:碳酸钡不溶于水)

(1)C物质的化学式是____________ ;
(2)A与E反应的化学方程式_______________________________ ;
(3)按游戏规则,下列能替代D物质的是________ (填序号).
①氧化铁 ②银 ③氯化钠 ④氢氧化钾

(1)C物质的化学式是
(2)A与E反应的化学方程式
(3)按游戏规则,下列能替代D物质的是
①氧化铁 ②银 ③氯化钠 ④氢氧化钾
您最近一年使用:0次
填空与简答-填空题
|
适中
(0.65)
解题方法
【推荐1】水是生命之源,与人类生活息息相关。
(1)饮用硬度过大的水不利于人体健康,生活中常用______ 的方法来降低水的硬度。
(2)净化水时常用二氧化氯( )消毒杀菌,二氧化氯中氯元素的化合价为
)消毒杀菌,二氧化氯中氯元素的化合价为______ 价。
(3)小亮同学在使用“除垢剂”去除热水瓶中的水垢时,发现有气泡产生。根据水垢的主要成分含有碳酸钙和氢氧化镁等物质,猜想到“除垢剂”的有效成分中可能含有酸。于是,他设计了用家庭中常见物质验证自己猜想的实验方案,请完成实验报告。
(4)根据实验结论,得出使用“除垢剂”时的注意事项有______ (写一条)。
(1)饮用硬度过大的水不利于人体健康,生活中常用
(2)净化水时常用二氧化氯(
 )消毒杀菌,二氧化氯中氯元素的化合价为
)消毒杀菌,二氧化氯中氯元素的化合价为(3)小亮同学在使用“除垢剂”去除热水瓶中的水垢时,发现有气泡产生。根据水垢的主要成分含有碳酸钙和氢氧化镁等物质,猜想到“除垢剂”的有效成分中可能含有酸。于是,他设计了用家庭中常见物质验证自己猜想的实验方案,请完成实验报告。
实验步骤 | 实验现象 | 结论 |
取适量“除垢剂”于瓷碗中, 向其中加入 | “除垢剂”的有效成分 中一定含有酸。 |
您最近一年使用:0次
填空与简答-流程题
|
适中
(0.65)
解题方法
【推荐2】有一包粉末,已知由CaCO3、FeCl3、MgCl2、Na2SO4、NaOH、NaNO3中的两种或两种以上物质组成。为确定其成分,进行以下实验:
步骤①:取一定质量的粉末 ,加足量水搅拌后过滤,得到沉淀甲和无色溶液A;
步骤②:向①的沉淀甲中加入足量稀盐酸,得到无色气体和黄色溶液;
步骤③:将①得到的无色溶液A进行如图所示的实验:
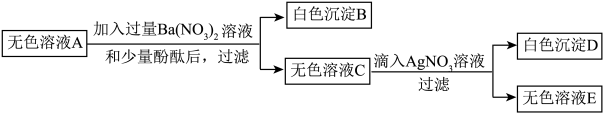
请回答问题:
(1)白色沉淀D的化学式为_______ 。
(2)步骤②得到黄色溶液时发生反应的化学方程式为_______ 。
(3)无色溶液A中_______ (填“一定”“可能”或“一定不”)存在Na2SO4。
(4)这包粉末的组成可能有_______ 种情况。
步骤①:取一定质量的粉末 ,加足量水搅拌后过滤,得到沉淀甲和无色溶液A;
步骤②:向①的沉淀甲中加入足量稀盐酸,得到无色气体和黄色溶液;
步骤③:将①得到的无色溶液A进行如图所示的实验:

请回答问题:
(1)白色沉淀D的化学式为
(2)步骤②得到黄色溶液时发生反应的化学方程式为
(3)无色溶液A中
(4)这包粉末的组成可能有
您最近一年使用:0次
填空与简答-流程题
|
适中
(0.65)
名校
解题方法
【推荐3】实验室有一包久置的生铁粉末(成分为碳、铁和氧化铁)。为测定各组分的质量分数,小怡取两份质量均为m的生铁粉末样品,分别进行如图实验。

I、测量碳的含量
已知:过氧化氢溶液能将Fe2+转化为Fe3+。

(1)步骤①中需要的仪器有______ 。
(2)写出一个步骤①中发生的反应的化学方程式______ 。
II、测定氧化铁的质量分数,如图所示装置气密性良好。
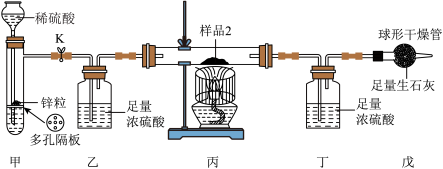
①在硬质玻璃管中放入样品
②打开止水夹K,在球形干燥管出口处检验氢气纯净后,点燃酒精灯
③待充分反应后,熄灭酒精灯,冷却至室温,关闭止水夹K
(3)打开止水夹K,观察到装置甲中的实验现象是______ 。
(4)若无装置乙,会导致测得氧化铁的质量分数______ (填“偏大”“偏小”或“不变”)。
(5)实验步骤③中,等冷却至室温后才关闭止水夹K的目的之一是______ 。
(6)实验过程中无污染性气体生成,且实验结束,硬质玻璃管中剩余固体为单质铁,丁装置中浓硫酸质量比实验前增重了0.54g,则m=______ g(结果精确到0.01)。

I、测量碳的含量
已知:过氧化氢溶液能将Fe2+转化为Fe3+。

(1)步骤①中需要的仪器有
(2)写出一个步骤①中发生的反应的化学方程式
II、测定氧化铁的质量分数,如图所示装置气密性良好。

①在硬质玻璃管中放入样品
②打开止水夹K,在球形干燥管出口处检验氢气纯净后,点燃酒精灯
③待充分反应后,熄灭酒精灯,冷却至室温,关闭止水夹K
(3)打开止水夹K,观察到装置甲中的实验现象是
(4)若无装置乙,会导致测得氧化铁的质量分数
(5)实验步骤③中,等冷却至室温后才关闭止水夹K的目的之一是
(6)实验过程中无污染性气体生成,且实验结束,硬质玻璃管中剩余固体为单质铁,丁装置中浓硫酸质量比实验前增重了0.54g,则m=
您最近一年使用:0次