金属在生活生产中有重要的作用,请回答下列问题。
(1)铜用于制作导线是因为其具有良好的_____ 性;自行车的闸线是由钢条抽成的钢丝,说明金属铁具有 _____ 性。
(2)现有镁、铝两种金属分别与稀盐酸充分反应,生成相同质量的氢气,则可能的情况有_____ 。
A.等质量的镁、铝分别与足量的稀盐酸充分反应
B.足量的镁、铝分别与等质量、等浓度的稀盐酸充分反应
C.质量比为4:3的镁、铝分别与足量的稀盐酸充分反应
D.质量比为8:9的镁、铝分别与足量的稀盐酸充分反应
(3)某合金6g与足量的稀硫酸充分反应后,如果生成0.2g氢气,该合金中的元素可能是_____ 。
A Ag和Cu
B Cu和Fe
C Zn和Fe
D Mg和Al
(4)某工厂欲从只含有 的废液中回收金属铜,并得到工业原料硫酸亚铁,其工业流程如下:
的废液中回收金属铜,并得到工业原料硫酸亚铁,其工业流程如下:

1操作a的名称是_____ 。
2图中固体的成分是_____ 。
3写出加入过量A时反应的化学方程式_____ 。
(1)铜用于制作导线是因为其具有良好的
(2)现有镁、铝两种金属分别与稀盐酸充分反应,生成相同质量的氢气,则可能的情况有
A.等质量的镁、铝分别与足量的稀盐酸充分反应
B.足量的镁、铝分别与等质量、等浓度的稀盐酸充分反应
C.质量比为4:3的镁、铝分别与足量的稀盐酸充分反应
D.质量比为8:9的镁、铝分别与足量的稀盐酸充分反应
(3)某合金6g与足量的稀硫酸充分反应后,如果生成0.2g氢气,该合金中的元素可能是
A Ag和Cu
B Cu和Fe
C Zn和Fe
D Mg和Al
(4)某工厂欲从只含有
 的废液中回收金属铜,并得到工业原料硫酸亚铁,其工业流程如下:
的废液中回收金属铜,并得到工业原料硫酸亚铁,其工业流程如下:
1操作a的名称是
2图中固体的成分是
3写出加入过量A时反应的化学方程式
更新时间:2019-12-04 15:17:10
|
相似题推荐
综合应用题
|
较难
(0.4)
解题方法
【推荐1】金属材料广泛应用于生产、生活中。
(1)生活中,铜质插头是利用了金属铜的______ 性(填“导电”或“导热”)。铝耐腐蚀的原因是铝能和空气中的氧气反应,生成一层_______ 。
(2)现代工业利用高炉炼铁,其主要反应原理是一氧化碳与氧化铁的反应,该反应的化学方程式为________ 。现有1500t含氧化铁80%的赤铁矿,理论上可以制得含铁96%的生铁______ t。
(3)将一定质量的镁粉放入到含有溶质为硝酸铝、硝酸铜、硝酸银的溶液中,充分反应后过滤,得到滤渣和滤液。
①若滤液呈蓝色,则滤渣中一定含有的金属是______ 。(填化学式)
②若向滤渣中加入稀盐酸无气泡产生,则滤液中一定含有的溶质是______ 。(填化学式)
(4)现有铁、氧化铁、四氧化三铁的混合物共50克,与足量的一氧化碳充分反应生成二氧化碳的质量为33克。则原混合物中铁单质的质量可能为______。
(1)生活中,铜质插头是利用了金属铜的
(2)现代工业利用高炉炼铁,其主要反应原理是一氧化碳与氧化铁的反应,该反应的化学方程式为
(3)将一定质量的镁粉放入到含有溶质为硝酸铝、硝酸铜、硝酸银的溶液中,充分反应后过滤,得到滤渣和滤液。
①若滤液呈蓝色,则滤渣中一定含有的金属是
②若向滤渣中加入稀盐酸无气泡产生,则滤液中一定含有的溶质是
(4)现有铁、氧化铁、四氧化三铁的混合物共50克,与足量的一氧化碳充分反应生成二氧化碳的质量为33克。则原混合物中铁单质的质量可能为______。
| A.6.5g | B.7.5g | C.10g | D.38g |
您最近一年使用:0次
综合应用题
|
较难
(0.4)
【推荐2】铁及其化合物在生产生活有广泛的应用。
一、铁的相关知识
(1)磁铁矿是早期司南的材料,磁铁矿中所含铁的氧化物主要是___________ 。
(2)某钢中含有少量Mn。MnO2和Al粉混合在高温下反应可得到Mn,该反应的化学方程式为___________ 。
(3)用铁锅加热食物,说明铁具良好的有___________ 性。
(4)铁锈主要成分是Fe2O3·nH2O,铁生锈主要与空气中的___________ 有关。
二、废铁屑的利用
草酸铁钾晶体[K3Fe(C2O4)3·xH2O]是一种光敏材料。用废铁屑(主要成分为Fe,含少量Fe2O3)

制备该晶体主要流程如下:
(5)“酸溶”时,产生的气体X为___________ 。
(6)“转化1”中加入铁粉是将+3价的铁转化为+2价的铁,该反应的化学方程式为___________ 。
(7)“转化2”反应生成FeC2O4·nH2O的化学方程式是___________ 。
(8)“转化3”需控制一定的温度,但温度不能太高的原因是___________ 。
(9)“一系列操作”包含蒸发浓缩、___________ 、过滤、洗涤、干燥。其中过滤所用的玻璃仪器有漏斗、烧杯、___________ 。
三、草酸铁钾晶体的实验
称取9.82g草酸铁钾晶体,用下图装置进行热分解实验。

【资料】
①Mr[K3Fe(C2O4)3]=437
②草酸铁钾晶体在110℃时失去全部结晶水,230℃时完全分解生成K2CO3、Fe、FeO、CO、CO2。
(10)连接好装置后,要先___________ 。
(11)控制温度对A中固体加热,加热前后及过程中均需通入N2.当加热到110℃后,通入N2的目的是防止倒吸和___________ 。
(12)数据处理:测得B、C装置在不同温度下的质量,如下表所示。230℃反应结束后,A中剩余固体5.42g。
计算:
①x=___________ 。
②尾气处理的方法可以是___________ 。
③上述K3Fe(C2O4)3热分解的化学方程式___________ 。
一、铁的相关知识
(1)磁铁矿是早期司南的材料,磁铁矿中所含铁的氧化物主要是
(2)某钢中含有少量Mn。MnO2和Al粉混合在高温下反应可得到Mn,该反应的化学方程式为
(3)用铁锅加热食物,说明铁具良好的有
(4)铁锈主要成分是Fe2O3·nH2O,铁生锈主要与空气中的
二、废铁屑的利用
草酸铁钾晶体[K3Fe(C2O4)3·xH2O]是一种光敏材料。用废铁屑(主要成分为Fe,含少量Fe2O3)

制备该晶体主要流程如下:
(5)“酸溶”时,产生的气体X为
(6)“转化1”中加入铁粉是将+3价的铁转化为+2价的铁,该反应的化学方程式为
(7)“转化2”反应生成FeC2O4·nH2O的化学方程式是
(8)“转化3”需控制一定的温度,但温度不能太高的原因是
(9)“一系列操作”包含蒸发浓缩、
三、草酸铁钾晶体的实验
称取9.82g草酸铁钾晶体,用下图装置进行热分解实验。

【资料】
①Mr[K3Fe(C2O4)3]=437
②草酸铁钾晶体在110℃时失去全部结晶水,230℃时完全分解生成K2CO3、Fe、FeO、CO、CO2。
(10)连接好装置后,要先
(11)控制温度对A中固体加热,加热前后及过程中均需通入N2.当加热到110℃后,通入N2的目的是防止倒吸和
(12)数据处理:测得B、C装置在不同温度下的质量,如下表所示。230℃反应结束后,A中剩余固体5.42g。
| 温度/℃ | 室温 | 110 | 230 |
| B装置/g | 200.00 | 201.08 | 201.08 |
| C装置/g | 200.00 | 200.00 | 202.20 |
①x=
②尾气处理的方法可以是
③上述K3Fe(C2O4)3热分解的化学方程式
您最近一年使用:0次
综合应用题
|
较难
(0.4)
【推荐3】铁是生活中最常见的金属。
(1)下图为常用的不粘锅,它利用了铁的______ (填“导电”或“导热”)性,它的手柄应选择______ (填“热塑”或“热固”)性塑料制作。

(2)工业上常用铁矿石来炼铁。为了测定某赤铁矿(主要成分为Fe2O3)中氧化铁的质量分数,化学兴趣小组的同学进行了如下实验(假设该赤铁矿中的杂质不含铁元素,也不与CO反应)。

称取该赤铁矿粉末10.0g装入硬质玻璃管中,按如图装置进行实验。开始时缓缓通入CO气体,过一段时间后再加热至高温使其充分反应,待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却。反应前后称量相关物质的总质量(装置内空气中的水燕气CO2忽略不计),所测的数据如下表:
【交流讨论】
①装置A中先通CO的目的是______ ,A装置中发生反应的化学方程式为______ 。从环保的角度分析,该装置的缺陷是______ 。
②根据上述表格中的实验数据计算:该铁矿石中氧化铁的质量分数为__ 。
【反思评价】本实验最后停止加热前______ (选填“需要”或“不需要”)先断开装置中A和B的连接处,理由是___ 。
【拓展延伸】有同学提出上述实验中的CO用H2代替,并将上面右图中B装置中NaOH换成浓硫酸,来测定氧化铁的含量,你认为是否可行?______ (选填“可行”或“不可行”)。
(1)下图为常用的不粘锅,它利用了铁的

(2)工业上常用铁矿石来炼铁。为了测定某赤铁矿(主要成分为Fe2O3)中氧化铁的质量分数,化学兴趣小组的同学进行了如下实验(假设该赤铁矿中的杂质不含铁元素,也不与CO反应)。
反应前 | 反应后 |
玻璃管和红色粉末的总质量为42.3g | 玻璃管和固体物质的总质量为39.9g |

称取该赤铁矿粉末10.0g装入硬质玻璃管中,按如图装置进行实验。开始时缓缓通入CO气体,过一段时间后再加热至高温使其充分反应,待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却。反应前后称量相关物质的总质量(装置内空气中的水燕气CO2忽略不计),所测的数据如下表:
【交流讨论】
①装置A中先通CO的目的是
②根据上述表格中的实验数据计算:该铁矿石中氧化铁的质量分数为
【反思评价】本实验最后停止加热前
【拓展延伸】有同学提出上述实验中的CO用H2代替,并将上面右图中B装置中NaOH换成浓硫酸,来测定氧化铁的含量,你认为是否可行?
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐1】钢铁是日常生活中使用最多的金属。
(1)“手撕钢”是厚度必须控制在0.025毫米以下的钢,它在军事、电子产品、航空航天、能源等领域都有着重要应用。

①“手撕钢”是一种铁合金,下列说法不正确的是____ (填字母)。
a.“手撕钢”的性能比生铁优越
b.“手撕钢”能完全溶解在稀盐酸中
c.“手撕钢”的含碳量比生铁高
②早在公元前4世纪,中国已广泛利用铁矿石与木炭生产生铁,并加入“黑土”以降低生铁的熔化温度;“黑土”含有磷酸铁(FePO4),其中磷元素的化合价为_____ 。
(2)据估计,世界每年生产的钢铁大约有1/4被锈“吃”掉了。
①锈能“吃”铁的原因是________________ 。
②为防止发生锈“吃”铁的现象发生可采取的措施有______________ (写一条)
(3)草酸(H2C2O4)分解的化学方程式为H2C2O4 CO↑+CO2↑+H2O。某化学小组为测定生锈铁片的组成(假设只含有铁和Fe2O3·xH2O),进行了以下探究,请你参与并完成对有关问题的解答。
CO↑+CO2↑+H2O。某化学小组为测定生锈铁片的组成(假设只含有铁和Fe2O3·xH2O),进行了以下探究,请你参与并完成对有关问题的解答。

主要操作为:取生锈铁片样品12.6g置于装置C的硬质玻璃管中,加热完全反应后得到固体的质量为8.4g,装置D增重6.6g。
①装置A的作用是_____ ;装置B的作用是____ 。
②通过计算求m(Fe)∶m(Fe2O3·xH2O)的比值______ 。
(1)“手撕钢”是厚度必须控制在0.025毫米以下的钢,它在军事、电子产品、航空航天、能源等领域都有着重要应用。

①“手撕钢”是一种铁合金,下列说法不正确的是
a.“手撕钢”的性能比生铁优越
b.“手撕钢”能完全溶解在稀盐酸中
c.“手撕钢”的含碳量比生铁高
②早在公元前4世纪,中国已广泛利用铁矿石与木炭生产生铁,并加入“黑土”以降低生铁的熔化温度;“黑土”含有磷酸铁(FePO4),其中磷元素的化合价为
(2)据估计,世界每年生产的钢铁大约有1/4被锈“吃”掉了。
①锈能“吃”铁的原因是
②为防止发生锈“吃”铁的现象发生可采取的措施有
(3)草酸(H2C2O4)分解的化学方程式为H2C2O4
 CO↑+CO2↑+H2O。某化学小组为测定生锈铁片的组成(假设只含有铁和Fe2O3·xH2O),进行了以下探究,请你参与并完成对有关问题的解答。
CO↑+CO2↑+H2O。某化学小组为测定生锈铁片的组成(假设只含有铁和Fe2O3·xH2O),进行了以下探究,请你参与并完成对有关问题的解答。
主要操作为:取生锈铁片样品12.6g置于装置C的硬质玻璃管中,加热完全反应后得到固体的质量为8.4g,装置D增重6.6g。
①装置A的作用是
②通过计算求m(Fe)∶m(Fe2O3·xH2O)的比值
您最近一年使用:0次
综合应用题
|
较难
(0.4)
【推荐2】在人类发展史中,化学为改善和提高人们生活质量作出重要贡献。
【古籍记载】
科技史专家认为,化学最早起源于古代中国许多中国古代典籍为此提供了有力的佐证。
(1)《天工开物》中介绍了锌的冶炼方法:“炉甘石(ZnCO3)、煤炭饼装罐泥封”“其底铺薪,发火煅红”“冷淀毁罐取出”,反应区中发生的主要反应有:ZnCO3分解生成ZnO和CO2;ZnO与C反应生成Zn。

Ⅰ、反应区中ZnCO3分解的化学方程式为___________ 。
Ⅱ、“冷淀”后方能“毁罐”取锌,从化学变化的角度分析其原因___________ 。
(2)《梦溪笔谈》是宋代科学巨著。其中记载:“信州铅山县有苦泉,煮之则得胆矾。熬胆矾铁釜,久之亦化为铜。”其中涉及的化学反应是: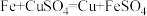 ,现有熬胆矾铁釜,称得其质量为11.5kg,其中含Cu8kg,其余是铁和未参加反应的杂质。试计算这件铁釜的最初质量为
,现有熬胆矾铁釜,称得其质量为11.5kg,其中含Cu8kg,其余是铁和未参加反应的杂质。试计算这件铁釜的最初质量为___________ kg。
【现代应用】
某金属冶炼厂的管道烟泥中含有少量铜、锌、硫等单质。现欲回收铜和锌,并对硫进行环保处理,主要步骤如图所示:

已知:加热的条件下,Zn、Cu与氧气反应分别生成ZnO、CuO。
(1)烟泥最初处理需要除油污,用洗涤剂除油污的过程中发生了___________ 现象。步骤①产生的废气B中,一定含有的有害气体是___________ (填化学式),若排放到大气中会造成的主要危害是会形成___________ ,环保处理废气B最好采用的试剂是___________ (选填下列字母序号)。
a、浓硫酸b、食盐水c、石灰乳
(2)步骤③和④的操作名称是___________ ,玻璃棒在该操作中的作用是___________ ;步骤④中甲的化学式是___________ 。
(3)我国古代就制得了一种外观似金子的锌和铜的合金,也就是黄铜,它的硬度比纯铜______ (选填“大”、“小”);区分黄金和黄铜的方法是___________ 。
(4)取少量的溶液C,往其中加入一定质量的镁粉,充分反应后过滤,得到滤渣和滤液。往滤渣中加入稀盐酸有气泡产生,则滤液中一定没有___________ (选填下列字母序号)。
a、硫酸镁b、硫酸锌c、硫酸铜d、硫酸
【古籍记载】
科技史专家认为,化学最早起源于古代中国许多中国古代典籍为此提供了有力的佐证。
(1)《天工开物》中介绍了锌的冶炼方法:“炉甘石(ZnCO3)、煤炭饼装罐泥封”“其底铺薪,发火煅红”“冷淀毁罐取出”,反应区中发生的主要反应有:ZnCO3分解生成ZnO和CO2;ZnO与C反应生成Zn。

Ⅰ、反应区中ZnCO3分解的化学方程式为
Ⅱ、“冷淀”后方能“毁罐”取锌,从化学变化的角度分析其原因
(2)《梦溪笔谈》是宋代科学巨著。其中记载:“信州铅山县有苦泉,煮之则得胆矾。熬胆矾铁釜,久之亦化为铜。”其中涉及的化学反应是:
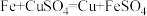 ,现有熬胆矾铁釜,称得其质量为11.5kg,其中含Cu8kg,其余是铁和未参加反应的杂质。试计算这件铁釜的最初质量为
,现有熬胆矾铁釜,称得其质量为11.5kg,其中含Cu8kg,其余是铁和未参加反应的杂质。试计算这件铁釜的最初质量为【现代应用】
某金属冶炼厂的管道烟泥中含有少量铜、锌、硫等单质。现欲回收铜和锌,并对硫进行环保处理,主要步骤如图所示:

已知:加热的条件下,Zn、Cu与氧气反应分别生成ZnO、CuO。
(1)烟泥最初处理需要除油污,用洗涤剂除油污的过程中发生了
a、浓硫酸b、食盐水c、石灰乳
(2)步骤③和④的操作名称是
(3)我国古代就制得了一种外观似金子的锌和铜的合金,也就是黄铜,它的硬度比纯铜
(4)取少量的溶液C,往其中加入一定质量的镁粉,充分反应后过滤,得到滤渣和滤液。往滤渣中加入稀盐酸有气泡产生,则滤液中一定没有
a、硫酸镁b、硫酸锌c、硫酸铜d、硫酸
您最近一年使用:0次
综合应用题
|
较难
(0.4)
真题
【推荐3】据统计全球每年消耗大约1500亿个易拉罐,其使用后的处理已成为研究热点。
Ⅰ、辨识材质
(1)易拉罐置于冰箱能迅速降温,这体现了金属的______ 性。
(2)易拉罐以铝或铁作为罐体材料。为区分常见装可乐和椰汁的罐体主材,对其进行如下探究:
①物理方法:分别将磁铁置于两个罐体样品上,可乐罐不能被磁铁吸引,椰汁罐可以被磁铁吸引,则说明可乐罐和椰汁罐的材质分别是______ 。
②化学方法:______ (填写一种操作、现象和结论)。
Ⅱ、铁罐回收
兴趣小组的同学们尝试用回收的铁罐来制备补铁剂硫酸亚铁。除去铁罐表层的涂层后将其剪碎,称取5份5.6g的铁屑,分别向其中加入一定体积14%的硫酸溶液(密度为1.1g•mL﹣1),测得硫酸亚铁的产率如表:
(3)至少加入______ mL(精确到0.1)14%的硫酸溶液能使5.6g铁屑完全反应。
(4)m(Fe):m(H2SO4)=______ 时进行反应最佳(从表中选择一组数据填写)。
Ⅲ、铝罐回收
科研人员将碱液捕集二氧化碳后的产物与铝罐在一定条件下制备高效储氢物质甲酸钠(HCOONa)和牙科材料勃姆石[AlO(OH)],工艺流程如图1:

为探究反应①进行的实验条件,科研人员将相同比例和质量的NaHCO3和Al在不同温度、碱度、反应时长进行对比实验,收集实验数据如图2所示:

(5)从捕集到的二氧化碳到产品甲酸钠,其中碳元素的化合价______ (选填“不变”、“升高”或“降低”)。
(6)由图2可知反应①的最佳实验条件为______ ,此时反应的化学方程式为______ 。
(7)若一定条件下甲酸钠产率为60%,1500亿(1.5×1011)个330mL铝制易拉罐(含铝约20克/个)可以制取约______ 万吨甲酸钠。
Ⅰ、辨识材质
(1)易拉罐置于冰箱能迅速降温,这体现了金属的
(2)易拉罐以铝或铁作为罐体材料。为区分常见装可乐和椰汁的罐体主材,对其进行如下探究:
①物理方法:分别将磁铁置于两个罐体样品上,可乐罐不能被磁铁吸引,椰汁罐可以被磁铁吸引,则说明可乐罐和椰汁罐的材质分别是
②化学方法:
Ⅱ、铁罐回收
兴趣小组的同学们尝试用回收的铁罐来制备补铁剂硫酸亚铁。除去铁罐表层的涂层后将其剪碎,称取5份5.6g的铁屑,分别向其中加入一定体积14%的硫酸溶液(密度为1.1g•mL﹣1),测得硫酸亚铁的产率如表:
| 序号 | m(Fe):m(H2SO4) | 产率/% |
| 1 | 5.6:8.82 | 74.63 |
| 2 | 5.6:9.80 | 76.74 |
| 3 | 5.610.78 | 87.85 |
| 4 | 5.6:11.16 | 95.14 |
| 5 | 5.6:12.74 | 92.36 |
(3)至少加入
(4)m(Fe):m(H2SO4)=
Ⅲ、铝罐回收
科研人员将碱液捕集二氧化碳后的产物与铝罐在一定条件下制备高效储氢物质甲酸钠(HCOONa)和牙科材料勃姆石[AlO(OH)],工艺流程如图1:

为探究反应①进行的实验条件,科研人员将相同比例和质量的NaHCO3和Al在不同温度、碱度、反应时长进行对比实验,收集实验数据如图2所示:

(5)从捕集到的二氧化碳到产品甲酸钠,其中碳元素的化合价
(6)由图2可知反应①的最佳实验条件为
(7)若一定条件下甲酸钠产率为60%,1500亿(1.5×1011)个330mL铝制易拉罐(含铝约20克/个)可以制取约
您最近一年使用:0次
综合应用题
|
较难
(0.4)
【推荐1】金属及化合物是工农业生产及日常生活中应用广泛的物质。
(1)金属铝既可以与酸反应,又可以与碱反应。铝与NaOH溶液反应生成 NaAlO2和H2,写出反应的化学方程式________ 。
(2)化学小组在A1(NO3)3、Cu(NO3)2和 AgNO3的混合溶液甲中加入一定量的锌粉,充分反应后过滤,得到固体乙和溶液丙,且溶液甲和溶液丙的质量相等。

①写山一个有关反应的化学方程式_________ 。
②写出溶液内中一定含有的金属离子(写化学符号)______ 。
③若液体丙为蓝色,向固体乙上滴加盐酸_____ (填“一定有”“可能有”或“一定没有”)气泡产生。
(3)在实验室里,可以利用右图装置制得铁。

①A处玻璃管内所发生反应的化学方程式为_________ 。
②B处可观察到的现象是___________ 。
③待四氧化三铁完全反应后,停止加热A处,在断开A、B之前应继续通入一氧化碳至A处玻璃管冷却。若不继续通入一氧化碳。可能出现的后果是___________ 。
(4)钛和钛合金性能优良,广泛用于航空、造船和化学工业中,工业上常用钠来制取钛,在高温时,钠与四氯化钛(TiC14)反应生成氯化钠和钛。若要用该方法制取1.2kg钛,理论上需要钠的质是是多少?_____
(1)金属铝既可以与酸反应,又可以与碱反应。铝与NaOH溶液反应生成 NaAlO2和H2,写出反应的化学方程式
(2)化学小组在A1(NO3)3、Cu(NO3)2和 AgNO3的混合溶液甲中加入一定量的锌粉,充分反应后过滤,得到固体乙和溶液丙,且溶液甲和溶液丙的质量相等。

①写山一个有关反应的化学方程式
②写出溶液内中一定含有的金属离子(写化学符号)
③若液体丙为蓝色,向固体乙上滴加盐酸
(3)在实验室里,可以利用右图装置制得铁。

①A处玻璃管内所发生反应的化学方程式为
②B处可观察到的现象是
③待四氧化三铁完全反应后,停止加热A处,在断开A、B之前应继续通入一氧化碳至A处玻璃管冷却。若不继续通入一氧化碳。可能出现的后果是
(4)钛和钛合金性能优良,广泛用于航空、造船和化学工业中,工业上常用钠来制取钛,在高温时,钠与四氯化钛(TiC14)反应生成氯化钠和钛。若要用该方法制取1.2kg钛,理论上需要钠的质是是多少?
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐2】金属及合金有广泛的用途。
(1)铝的原子结构示意图为_______ 。下列有关铝的叙述正确的是_______ 。(填序号)
①铝元素在周期表中位于第三周期;②铝原子在化学反应中易得电子;③铝元素是地壳中含量最高的元素;④金属铝化学性质活泼却较耐腐蚀。
(2)要证明Cu、Zn、Ag三种金属的活动性顺序,除了金属单质外,还至少需要一种溶液,用该溶液进行实验时发生反应的化学方程式为_______ 。
(3)向硝酸镁和硝酸银的混合溶液中加入一定量锌粉和铜粉的混合物,充分反应后过滤,观察到滤液为无色,请回答:
①要进一步确认此时所得滤渣的成分,请设计实验方案____ 。
②请分析并解释滤液的质量与反应前溶液的质量相比如何变化_____ 。
(4)某化学小组用如图徽型装置进行模拟冶铁的实验。(已知甲处反应生成CO)

①乙处玻璃管中观察到的现象是_______ 。
②丁装置的作用是什么?____ 。
(5)若将10g赤铁矿样品用CO还原,充分反应后剩余固体的质量为7.6g,请利用化学方程式计算该赤铁矿样品中氧化铁的质量分数。(杂质不参加反应)
(1)铝的原子结构示意图为
①铝元素在周期表中位于第三周期;②铝原子在化学反应中易得电子;③铝元素是地壳中含量最高的元素;④金属铝化学性质活泼却较耐腐蚀。
(2)要证明Cu、Zn、Ag三种金属的活动性顺序,除了金属单质外,还至少需要一种溶液,用该溶液进行实验时发生反应的化学方程式为
(3)向硝酸镁和硝酸银的混合溶液中加入一定量锌粉和铜粉的混合物,充分反应后过滤,观察到滤液为无色,请回答:
①要进一步确认此时所得滤渣的成分,请设计实验方案
②请分析并解释滤液的质量与反应前溶液的质量相比如何变化
(4)某化学小组用如图徽型装置进行模拟冶铁的实验。(已知甲处反应生成CO)

①乙处玻璃管中观察到的现象是
②丁装置的作用是什么?
(5)若将10g赤铁矿样品用CO还原,充分反应后剩余固体的质量为7.6g,请利用化学方程式计算该赤铁矿样品中氧化铁的质量分数。(杂质不参加反应)
您最近一年使用:0次
综合应用题
|
较难
(0.4)
名校
解题方法
【推荐1】金属在人类的生活和生产中起着重要的作用。
(1)某化学兴趣小组的同学利用如图装置做CO还原Fe2O3的实验并检验该反应的气体产物。

①图1虚线框内的装置是用于吸收CO2并收集CO,请从图2中(集气瓶内均为氢氧化钠溶液)选择最合适的装置______ (填序号)。
②写出图1装置中硬质玻璃管内发生反应的化学方程式______ 。
③实验结束后,先撤去酒精喷灯然后继续通入CO直至玻璃管冷却的目的是______ 。
(2)某同学研究水样的pH、水中溶解氧浓度与钢铁腐蚀速率的关系,查阅相关文献得到如下资料。

①图3表示水样温度22℃、含氧量6mL·L-1时,钢铁腐蚀速率与水样pH的关系。请写出当pH<4时,钢铁腐蚀速率明显增大的原因______ 。
②图4表示温度22℃、pH=7时,钢铁腐蚀速率与水中溶解氧浓度的关系,请写出当溶解氧超过20 mL·L-1时,钢铁腐蚀速率明显下降的原因______ 。
(3)在硝酸镁、硝酸铜和硝酸银的混合溶液中加入一定量的锌粉,反应停止后过滤,向滤液中插入洁净的铜丝,铜丝表面无明显变化。
①写出会导致溶液质量增大的有关反应的化学方程式______ 。
②滤渣中一定含有的物质和可能含有的物质分别是什么?______ 。
(4)某工厂利用废铁屑与废硫酸反应制取硫酸亚铁。现有废硫酸19.6t(硫酸的质量分数为10%),与足量的废铁屑反应,可生产硫酸亚铁多少吨?______
(1)某化学兴趣小组的同学利用如图装置做CO还原Fe2O3的实验并检验该反应的气体产物。

①图1虚线框内的装置是用于吸收CO2并收集CO,请从图2中(集气瓶内均为氢氧化钠溶液)选择最合适的装置
②写出图1装置中硬质玻璃管内发生反应的化学方程式
③实验结束后,先撤去酒精喷灯然后继续通入CO直至玻璃管冷却的目的是
(2)某同学研究水样的pH、水中溶解氧浓度与钢铁腐蚀速率的关系,查阅相关文献得到如下资料。

①图3表示水样温度22℃、含氧量6mL·L-1时,钢铁腐蚀速率与水样pH的关系。请写出当pH<4时,钢铁腐蚀速率明显增大的原因
②图4表示温度22℃、pH=7时,钢铁腐蚀速率与水中溶解氧浓度的关系,请写出当溶解氧超过20 mL·L-1时,钢铁腐蚀速率明显下降的原因
(3)在硝酸镁、硝酸铜和硝酸银的混合溶液中加入一定量的锌粉,反应停止后过滤,向滤液中插入洁净的铜丝,铜丝表面无明显变化。
①写出会导致溶液质量增大的有关反应的化学方程式
②滤渣中一定含有的物质和可能含有的物质分别是什么?
(4)某工厂利用废铁屑与废硫酸反应制取硫酸亚铁。现有废硫酸19.6t(硫酸的质量分数为10%),与足量的废铁屑反应,可生产硫酸亚铁多少吨?
您最近一年使用:0次



