通过化学反应探究生活中常见物质的成分。
(1)氧化钙是一种比较常见的白色粉末状的干燥剂,氧化钙作干燥剂可吸收空气中的水蒸气,写出该反应的化学方程式______________ ,基本反应类型是_______________ 。
(2)某化学兴趣小组打开一包装盒中的干燥剂,发现里面是黑色粉末同时还夹杂着少量红色粉末。该化学兴趣小组对该干燥剂的成分进行了探究:
查阅资料:①常见的黑色粉末有铁粉炭粉(C)、氧化铜、二氧化锰,常见的红色粉末有氧化铁、铜
②Fe与Fe3+在常温下反应生成Fe2+
根据上述实验得出干燥剂的成分是炭粉(C)、________________ 。
(3)写出步骤二中黑色粉末消失的反应化学方程式________________ 。
(4)步骤一中溶液变为浅绿色的原因是_____________ 。
(1)氧化钙是一种比较常见的白色粉末状的干燥剂,氧化钙作干燥剂可吸收空气中的水蒸气,写出该反应的化学方程式
(2)某化学兴趣小组打开一包装盒中的干燥剂,发现里面是黑色粉末同时还夹杂着少量红色粉末。该化学兴趣小组对该干燥剂的成分进行了探究:
查阅资料:①常见的黑色粉末有铁粉炭粉(C)、氧化铜、二氧化锰,常见的红色粉末有氧化铁、铜
②Fe与Fe3+在常温下反应生成Fe2+
| 实验步骤 | 实验操作 | 实验现象 |
| 一 | 取该干燥剂少许于试管中,加适量 | 溶液开始变为黄色又逐渐变为浅绿色,并有气泡产生,最后试管底部剩余有少量未溶解的黑色粉末 |
| 二 | 取步骤一中未溶解的残渣进行灼烧,在上方罩一只烧杯,一段时间后迅速倒转,向烧杯中加入适量澄清石灰水 | 黑色粉末消失, |
根据上述实验得出干燥剂的成分是炭粉(C)、
(3)写出步骤二中黑色粉末消失的反应化学方程式
(4)步骤一中溶液变为浅绿色的原因是
2019九年级·贵州遵义·学业考试 查看更多[1]
(已下线)【万唯】贵州省遵义市2019年初中毕业生学业(升学)统一考试综合理科化学试题《白卷》
更新时间:2020-02-13 08:37:20
|
相似题推荐
科学探究题
|
较难
(0.4)
名校
【推荐1】市售的“自热米饭”带有一个发热包,遇水后可迅速升温至150℃,保温时间达3小时,能将生米做成熟饭。某中学化学兴趣小组对发热包非常感兴趣,进行了以下探究。
【查阅资料】(1)发热包主要由生石灰、铁粉、镁粉、铝粉、炭粉、氯化钠中的若干种组成。
(2)氢氧化镁和氢氧化铝均为不溶于水的白色固体,但后者可溶于NaOH溶液。
【成分探究】取出某品牌的发热包内灰黑色的固体粉末,分成两份。
(1)小吴用磁铁靠近其中一份粉末,发现有黑色物质被磁铁吸引,证明粉末中含有______ (填名称)。用磁铁将该物质全部吸出后,剩余粉末为样品A;
(2)小周将另一份粉末加水溶解、过滤后,取部分滤液滴入酚酞试液,滤液变______ 色,证明原粉末中含生石灰。
(3)除上述物质外,还可能存在镁粉、铝粉、炭粉,对此大家提出了以下几种猜想:
猜想一:只存在上述三种中的一种;
猜想二:上述三种同时存在;
猜想三:存在铝粉和炭粉;
猜想四:存在镁粉和铝粉;
猜想五:______ 。
【实验验证】小施用样品A进行实验,流程如图1。向滤液B滴加氢氧化钠溶液时,他观察到开始时有白色沉淀生成,后来又全部消失,最后得到的是无色溶液E。
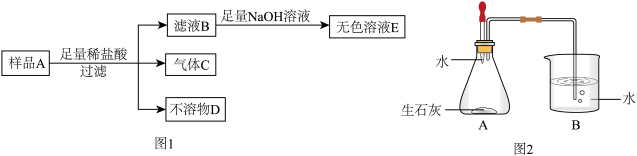
【实验结论】不溶物D是______ (填名称);
结合实验现象讨论后,认为猜想______ 正确,理由是______ 。
【原理探究】小吴利用如图2装置证明发热包放热主要来自于生石灰与水的反应。加水后发现A中温度迅速升高,B中有气泡产生,该气体为______ (填名称)。但温度很快下降,说明该反应很快结束,不能长时间保温。
【猜想】大家大胆猜测应该还有其他放热反应存在。
【实验验证】同学们按资料介绍,用铁粉、炭粉和食盐水在锥形瓶中模拟铁的锈蚀实验,不久后发现锥形瓶外壁微烫,并持续较长时间。该现象很好地解释了发热包的保温机理。
【拓展活动】在上述铁的锈蚀实验中未观察到有红色的铁锈产生。老师告诉同学们,铁锈蚀的过程是首先生成一种碱,这种碱在空气中极易被氧化又变成另外一种碱,请写出生成另外一种碱的反应化学方程式______ 。
【查阅资料】(1)发热包主要由生石灰、铁粉、镁粉、铝粉、炭粉、氯化钠中的若干种组成。
(2)氢氧化镁和氢氧化铝均为不溶于水的白色固体,但后者可溶于NaOH溶液。
【成分探究】取出某品牌的发热包内灰黑色的固体粉末,分成两份。
(1)小吴用磁铁靠近其中一份粉末,发现有黑色物质被磁铁吸引,证明粉末中含有
(2)小周将另一份粉末加水溶解、过滤后,取部分滤液滴入酚酞试液,滤液变
(3)除上述物质外,还可能存在镁粉、铝粉、炭粉,对此大家提出了以下几种猜想:
猜想一:只存在上述三种中的一种;
猜想二:上述三种同时存在;
猜想三:存在铝粉和炭粉;
猜想四:存在镁粉和铝粉;
猜想五:
【实验验证】小施用样品A进行实验,流程如图1。向滤液B滴加氢氧化钠溶液时,他观察到开始时有白色沉淀生成,后来又全部消失,最后得到的是无色溶液E。

【实验结论】不溶物D是
结合实验现象讨论后,认为猜想
【原理探究】小吴利用如图2装置证明发热包放热主要来自于生石灰与水的反应。加水后发现A中温度迅速升高,B中有气泡产生,该气体为
【猜想】大家大胆猜测应该还有其他放热反应存在。
【实验验证】同学们按资料介绍,用铁粉、炭粉和食盐水在锥形瓶中模拟铁的锈蚀实验,不久后发现锥形瓶外壁微烫,并持续较长时间。该现象很好地解释了发热包的保温机理。
【拓展活动】在上述铁的锈蚀实验中未观察到有红色的铁锈产生。老师告诉同学们,铁锈蚀的过程是首先生成一种碱,这种碱在空气中极易被氧化又变成另外一种碱,请写出生成另外一种碱的反应化学方程式
您最近一年使用:0次
科学探究题
|
较难
(0.4)
解题方法
【推荐2】“自热食品”是指不依赖电、火等方式加热,用自带发热包加热的预包装食品。国家标准将出台,助推规范发展。
【查阅资料】①发热包中物质的主要成分是生石灰,碳酸钠、铝粒。②铝和强碱溶液反应生成氢气。
探究一:发热包的发热原理
(1)取出自热食品中的发热包加入自带水,发生剧烈反应,迅速放出大量的热,该反应_____ (填“吸收”或“放出”)热量。同时发热包内固体物质变硬、结块,分析发热包内的物质可能发生的一个反应的化学方程式________ 。
(2)发热包上的安全警示图标有“禁止明火”,其原因可能是________ 。
(3)小明向使用后的发热包中加入稀盐酸,并对产生的气体展开进一步探究。
探究二:确定气体的成分
【猜想与假设】猜想一:该气体可能是H2;猜想二:该气体可能是_____ ;猜想三:该气体可能是CO2和H2的混合气体。
【实验设计】设计下图实验装置,对气体成分进行探究。

【实验验证】甲装置中的实验现象是______ ,丁装置中黑色的粉末逐渐变为红___ 色,试管口有水珠产生,则证明猜想三正确。装置乙的作用是充分吸收CO2,反应的化学方程式为______ 。
【拓展应用】通过以上探究,“自热米饭”发热包应____ 保存,使用后的发热包应包好,按照垃圾分类投放。
【查阅资料】①发热包中物质的主要成分是生石灰,碳酸钠、铝粒。②铝和强碱溶液反应生成氢气。
探究一:发热包的发热原理
(1)取出自热食品中的发热包加入自带水,发生剧烈反应,迅速放出大量的热,该反应
(2)发热包上的安全警示图标有“禁止明火”,其原因可能是
(3)小明向使用后的发热包中加入稀盐酸,并对产生的气体展开进一步探究。
探究二:确定气体的成分
【猜想与假设】猜想一:该气体可能是H2;猜想二:该气体可能是
【实验设计】设计下图实验装置,对气体成分进行探究。

【实验验证】甲装置中的实验现象是
【拓展应用】通过以上探究,“自热米饭”发热包应
您最近一年使用:0次
科学探究题
|
较难
(0.4)
解题方法
【推荐3】化学兴趣小组对网购的某食品专用发热包(部分标签如图所示)进行了探究。
Ⅰ.探究发热原理
(1)氧化钙和水的反应______ 热量。
(2)查阅资料:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,反应放热。据此推知发热包中碳酸钠的作用是______ (利用化学方程式作答)。
Ⅱ.探究发热剂中各成分的质量比
为能够自制发热包,设计如下实验对发热剂的组成进行定量探究。已知下图中B处为两个单向阀;推注射器时A1关闭, A2处打开;拉注射器时,A1打开进空气,A2关闭。
①检查实验装置气密性。
②称取5.0 g发热剂样品放入锥形瓶中,并在其它装置中装入足量的相应试剂。
③……,然后称得F处装置的质量为m1。
④打开分液漏斗的活塞,加入足量稀硫酸后关闭活塞,一段时间后再.....,然后称得F处装置的质量为m2。
(3)实验步骤③和④中“……”处操作相同,该操作是______ 。
【数据处理】
(4)基于实验所得数据,可以计算出该发热剂中氧化钙、铝粉、碳酸钠的质量比。5.0 g发热剂样品中氧化钙质量为______ 。
【模拟制作】
将氧化钙、铝粉碳酸钠按以上质量比混合均匀后,倒入无纺布袋中封口,将无纺布袋放入塑料自封袋中密封保存。
【拓展延伸】
(5)取以上自制发热包加水后,反应过程中溶液温度和pH随时间变化如图所示。下列说法正确的是______。

Ⅰ.探究发热原理
(1)氧化钙和水的反应
(2)查阅资料:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,反应放热。据此推知发热包中碳酸钠的作用是
Ⅱ.探究发热剂中各成分的质量比
为能够自制发热包,设计如下实验对发热剂的组成进行定量探究。已知下图中B处为两个单向阀;推注射器时A1关闭, A2处打开;拉注射器时,A1打开进空气,A2关闭。
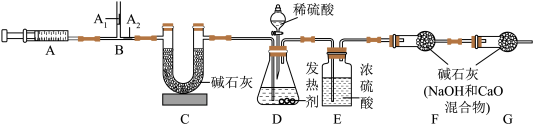
①检查实验装置气密性。
②称取5.0 g发热剂样品放入锥形瓶中,并在其它装置中装入足量的相应试剂。
③……,然后称得F处装置的质量为m1。
④打开分液漏斗的活塞,加入足量稀硫酸后关闭活塞,一段时间后再.....,然后称得F处装置的质量为m2。
(3)实验步骤③和④中“……”处操作相同,该操作是
【数据处理】
(4)基于实验所得数据,可以计算出该发热剂中氧化钙、铝粉、碳酸钠的质量比。5.0 g发热剂样品中氧化钙质量为
【模拟制作】
将氧化钙、铝粉碳酸钠按以上质量比混合均匀后,倒入无纺布袋中封口,将无纺布袋放入塑料自封袋中密封保存。
【拓展延伸】
(5)取以上自制发热包加水后,反应过程中溶液温度和pH随时间变化如图所示。下列说法正确的是______。

| A.0 ~500s内,温度升高的原因仅是氧化钙与水反应放热 |
| B.0~ 100s内,pH上升的原因仅是氧化钙和水生成氢氧化钙 |
| C.100~880 s内,pH变化的原因是氢氧化钠被铝粉逐渐消耗 |
| D.0~500s内,温度上升逐渐放缓,可能与生成的碳酸钙覆盖在反应物表面有关 |
您最近一年使用:0次
科学探究题
|
较难
(0.4)
名校
解题方法
【推荐1】甲、乙同学在学完酸的化学性质后,做了如下实验:
【观察讨论】
(1)当乙同学沿废液缸内壁缓慢倾倒液体时,观察到废液缸中先有气泡产生,然后又出现了白色沉淀。经过讨论确定,甲同学加入的稀盐酸______ ,而乙同学加入的稀盐酸______ 时才会出现上述现象。
A.过量 B.量不足 C.与试管中的物质恰好完全反应
为了科学处理实验后产生的废液,甲、乙同学对废液缸中最终废液溶质的成分进行探究。
【提出问题】最终废液中含有什么溶质?
(2)通过分析,甲乙同学一致认为废液缸中最终废液一定不存在盐酸。理由是:________ 。
【猜想假设】甲同学的猜想:废液中含有NaCl、 两种物质
两种物质
乙同学的猜想:废液中含有NaCl、 两种物质
两种物质
【实验探究】
甲、乙同学为了验证自己的分别同时进行了如下设计:
【反思评价】
(3)请对甲同学由实验现象得出的结论给予评价_________________ 。
【表达交流】
(4)甲、乙同学确认了最终废液中溶质的成分。你认为处理该废液的方法是__________ 。

【观察讨论】
(1)当乙同学沿废液缸内壁缓慢倾倒液体时,观察到废液缸中先有气泡产生,然后又出现了白色沉淀。经过讨论确定,甲同学加入的稀盐酸
A.过量 B.量不足 C.与试管中的物质恰好完全反应
为了科学处理实验后产生的废液,甲、乙同学对废液缸中最终废液溶质的成分进行探究。
【提出问题】最终废液中含有什么溶质?
(2)通过分析,甲乙同学一致认为废液缸中最终废液一定不存在盐酸。理由是:
【猜想假设】甲同学的猜想:废液中含有NaCl、
 两种物质
两种物质乙同学的猜想:废液中含有NaCl、
 两种物质
两种物质【实验探究】
甲、乙同学为了验证自己的分别同时进行了如下设计:
| 实验步骤及现象 | 实验结论 | |
| 甲同学实验 | 取少量废液于试管中,向其中滴加碳酸钠溶液,无明显现象。 | 甲猜想不成立,则乙猜想成立。 |
| 乙同学实验 | 取少量废液于试管中,向其中滴加氯化钙溶液,出现白色沉淀。 | 乙猜想成立,则甲猜想不成立。 |
(3)请对甲同学由实验现象得出的结论给予评价
【表达交流】
(4)甲、乙同学确认了最终废液中溶质的成分。你认为处理该废液的方法是
您最近一年使用:0次
科学探究题
|
较难
(0.4)
解题方法
【推荐2】小明同学在探究氢氧化钠固体溶液的放热现象后,没有及时将盛氢氧化钠固体的试剂瓶瓶塞盖上,老师告诉小明它可能变质了.
(1)老师认为氢氧化钠固体可能变质的理由是________ (用化学方程式表示).小明同学对老师的说法产生了质疑,于是他设计实验方案对该固体样品进行了探究.
【提出猜想】1.该样品没有变质;2.该样品部分变质;3.该样品全部变质.
【实验探究】
【讨论交流】小刚同学认为小明同学的设计不能证明该样品一定含有氢氧化钠,理由是______ ,他又补充了实验:取少量样品,加水溶解,向其中加入足量氯化钡溶液,静置,取上层清液,滴加无色酚酞溶液后溶液________ ,说明该样品部分变质.
【拓展迁移】要除去部分变质的氢氧化钠溶液中的杂质,可选择________ 溶液.
(1)老师认为氢氧化钠固体可能变质的理由是
【提出猜想】1.该样品没有变质;2.该样品部分变质;3.该样品全部变质.
【实验探究】
| 实验编号 | 实验操作 | 实验现象 | 实验结论 |
| ① | 取少量样品于试管里,向其中加入 | 样品变质了 | |
| ② | 取少量样品,加水溶解,然后滴加无色酚酞溶液 | 溶液变红 | 该样品部分变质 |
【讨论交流】小刚同学认为小明同学的设计不能证明该样品一定含有氢氧化钠,理由是
【拓展迁移】要除去部分变质的氢氧化钠溶液中的杂质,可选择
您最近一年使用:0次
科学探究题
|
较难
(0.4)
名校
解题方法
【推荐3】学习小组尝试从反应物消耗和新物质生成两个不同的角度,验证CO2与NaOH溶液发生了反应.
【查阅资料】
Ⅰ常温下,NaOH易溶于水也易溶于酒精,Na2CO3易溶于水但难溶于酒精。
ⅡBaC12溶液呈中性,不与氢氧化钠溶液反应:但能与碳酸钠溶液反应: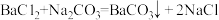
ⅢCO2不溶于酒精也不与酒精不反应。
【实验探究】(相关装置气密性良好,省略夹持仪器)
实验一:

实验二:D中滴入酚酞后呈__________ 色,证明B瓶溶液中NaOH已反应完了。若C中不加BaC12溶液,直接滴入酚酞试液,能否达到实验目的?理由是______________ 。

实验三:关闭止水夹a,注入足量饱和的NaOH的酒精溶液,振荡后观察到的现象是_________ ,发生反应的化学方程式为____________ 。一段时间后,注入足量的稀盐酸,打开止水夹a,观察到的现象是_____________ 。

实验四:向瓶中分别加入等体积的蒸馏水和NaOH溶液,用传感器测得瓶中气压变化的图像,如图所示。

分析上述图像,能否证明CO2与NaOH溶液发生了反应?理由是_______________ 。
【总结归纳】
以上四个实验中,既从反应物消耗角度,又从新物质生成角度,证明NaOH与CO2发生了反应的实验时_____________________ 。(选填“一”、“二”、“三”或“四”)。
【查阅资料】
Ⅰ常温下,NaOH易溶于水也易溶于酒精,Na2CO3易溶于水但难溶于酒精。
ⅡBaC12溶液呈中性,不与氢氧化钠溶液反应:但能与碳酸钠溶液反应:
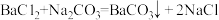
ⅢCO2不溶于酒精也不与酒精不反应。
【实验探究】(相关装置气密性良好,省略夹持仪器)
实验一:

实验二:D中滴入酚酞后呈

实验三:关闭止水夹a,注入足量饱和的NaOH的酒精溶液,振荡后观察到的现象是

实验四:向瓶中分别加入等体积的蒸馏水和NaOH溶液,用传感器测得瓶中气压变化的图像,如图所示。

分析上述图像,能否证明CO2与NaOH溶液发生了反应?理由是
【总结归纳】
以上四个实验中,既从反应物消耗角度,又从新物质生成角度,证明NaOH与CO2发生了反应的实验时
您最近一年使用:0次



