(1)分析下表数据回答下列问题:
①以上两种物质溶解度的变化受温度变化影响较小的是_______ 。
②NaCl 与 KNO3 具有相等溶解度的温度(t)范围是________ 。
③ 硝酸钾溶液中含有少量 NaCl 时,可通过___ 的方法提取较纯 KNO3。
④ 对③析出的晶体和剩余溶液描述正确的有____ (填标号)。
A 剩余溶液一定是 KNO3 饱和溶液
B 剩余溶液一定是 NaCl 饱和溶液
C 上述方法可以将两者完全分离
D 析出的晶体中只含有 KNO3
(2)甲、乙两种固体物质的溶解度曲线如图所示。
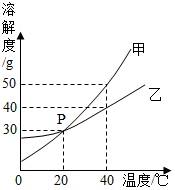
① 图中P 点的含义是_____ 。
② 40℃时,饱和溶液中溶质的质量分数:甲_ (填“>” “=”或“<”) 乙。
③20℃时,将 60 g 乙物质放入 100 g 水中,升温至 40℃,溶液中溶质与溶剂质量比为__ (填最简整数)。
④20℃时,进行如下图所示的实验:

上述实验过程中所得的溶液,属于不饱和溶液的有__ (填标号,下同);__ 溶液与 B 溶液中溶质的质量分数相同。
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| KNO3 的溶解度/g | 13.3 | 20.9 | 32 | 45.8 | 64 | 85.5 | 110 | 138 |
| NaCl 的溶解度/g | 35.7 | 35.8 | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 |
①以上两种物质溶解度的变化受温度变化影响较小的是
②NaCl 与 KNO3 具有相等溶解度的温度(t)范围是
③ 硝酸钾溶液中含有少量 NaCl 时,可通过
④ 对③析出的晶体和剩余溶液描述正确的有
A 剩余溶液一定是 KNO3 饱和溶液
B 剩余溶液一定是 NaCl 饱和溶液
C 上述方法可以将两者完全分离
D 析出的晶体中只含有 KNO3
(2)甲、乙两种固体物质的溶解度曲线如图所示。

① 图中P 点的含义是
② 40℃时,饱和溶液中溶质的质量分数:甲
③20℃时,将 60 g 乙物质放入 100 g 水中,升温至 40℃,溶液中溶质与溶剂质量比为
④20℃时,进行如下图所示的实验:

上述实验过程中所得的溶液,属于不饱和溶液的有
更新时间:2020-03-17 14:39:20
|
相似题推荐
综合应用题
|
较难
(0.4)
解题方法
【推荐1】我国化学家侯德榜创立了“侯氏制碱法”,为世界制纯碱的工业作出了杰出贡献。
(1)“侯氏制碱法”生产出Na2CO3的同时得到副产品NH4Cl,生产原理如下图。

Ⅰ、Na2CO3的类别属于______ (选填“酸”、“碱”或“盐”);副产品NH4Cl可作______ (选填“氮”、“磷”或“钾”)肥。
Ⅱ、制纯碱的过程中,可以循环利用的物质是______ 。
(2)下图是氯化钠、碳酸氢钠、氯化铵的溶解度曲线(资料:60℃时溶液中的碳酸氢铵受热分解)

Ⅰ、0℃时,碳酸氢钠的溶解度是______ 。
Ⅱ、20℃时,将20g氯化钠加入50g水中,充分溶解后得到______ (填“饱和”或“不饱和”)溶液。
Ⅲ、产物中NaHCO3比NH4Cl先结晶析出。结合①中生产原理及溶解度曲线解释其原因______ 。
(3)“侯氏制碱法”生产的纯碱中含有氯化钠。为测定纯碱样品(Na2CO3和NaCl的混合物)中碳酸钠的质量分数,兴趣小组进行了下图的实验。(过滤后滤渣损失忽略不计)

Ⅰ、纯碱样品中碳酸钠的物质的量为______ 。
Ⅱ、实验中个别同学过滤所得的滤渣未经洗涤直接干燥,这一操作会导致该纯碱样品中碳酸钠的质量分数______ (选填“偏大”、“不变”或“偏小”)。
(1)“侯氏制碱法”生产出Na2CO3的同时得到副产品NH4Cl,生产原理如下图。

Ⅰ、Na2CO3的类别属于
Ⅱ、制纯碱的过程中,可以循环利用的物质是
(2)下图是氯化钠、碳酸氢钠、氯化铵的溶解度曲线(资料:60℃时溶液中的碳酸氢铵受热分解)

Ⅰ、0℃时,碳酸氢钠的溶解度是
Ⅱ、20℃时,将20g氯化钠加入50g水中,充分溶解后得到
Ⅲ、产物中NaHCO3比NH4Cl先结晶析出。结合①中生产原理及溶解度曲线解释其原因
(3)“侯氏制碱法”生产的纯碱中含有氯化钠。为测定纯碱样品(Na2CO3和NaCl的混合物)中碳酸钠的质量分数,兴趣小组进行了下图的实验。(过滤后滤渣损失忽略不计)

Ⅰ、纯碱样品中碳酸钠的物质的量为
Ⅱ、实验中个别同学过滤所得的滤渣未经洗涤直接干燥,这一操作会导致该纯碱样品中碳酸钠的质量分数
您最近一年使用:0次
【推荐2】水和溶液对人类的生产、生活具有重要的意义,请结合所学知识回答下列问题。
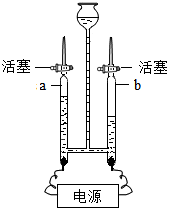
(1)如图是电解水的装置,玻璃管a收集到的气体是____ ,该实验说明水是由____ 组成的。
(2)自来水厂净化水的过程中用到了大量的活性炭,利用了活性炭的____ 作用,长期饮用硬度大的水不利于人体健康,生活中常用肥皂水来鉴别硬水和软水,并采用____ 的方法来降低水的硬度,也能起到杀菌消毒的作用。
(3)如图是甲、乙、丙三种固体物质(不含结晶水)在水中的溶解度曲线图。
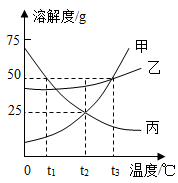
请结合图示回答下列问题。
①若固体甲中含有少量乙时,可用______ (填“蒸发结晶”或“降温结晶”)方法提纯甲。
②将丙的饱和溶液转化为不饱和溶液的方法之一是_______ 温度(填“升高”或“降低”)。
③将t3℃时甲、乙、丙三种物质的饱和溶液分别降温至t1℃,所得溶液中溶质质量分数由大到小的顺序_______ 。
④t3℃时,将甲物质的饱和溶液300g降温到t2℃,会析出甲物质________ g。

(1)如图是电解水的装置,玻璃管a收集到的气体是
(2)自来水厂净化水的过程中用到了大量的活性炭,利用了活性炭的
(3)如图是甲、乙、丙三种固体物质(不含结晶水)在水中的溶解度曲线图。

请结合图示回答下列问题。
①若固体甲中含有少量乙时,可用
②将丙的饱和溶液转化为不饱和溶液的方法之一是
③将t3℃时甲、乙、丙三种物质的饱和溶液分别降温至t1℃,所得溶液中溶质质量分数由大到小的顺序
④t3℃时,将甲物质的饱和溶液300g降温到t2℃,会析出甲物质
您最近一年使用:0次
综合应用题
|
较难
(0.4)
【推荐3】K2SO4是无氯优质钾肥,Mn3O4是生产软磁铁氧体材料的主要原料。以硫酸工业的尾气联合制备K2SO4和Mn3O4的工艺流程如下:

【相关资料】(1)含水结晶盐受热时通常先失去结晶水;
(2)图2中物质B就是工业产品Mn3O4 ;
(3)Mn3O4在高温时会被氧化,且锰的化合价从+1到+7变化时逐级升高,如+2的锰先氧化到+3的锰,再从+3氧化到+4分别是对应的氧化物为三氧化二锰和二氧化锰。

【问题解答】
(1)反应II中加入的NH4HCO3中氮元素的化合价为_______ ;
(2)反应Ⅲ中,向(NH4)2SO4溶液中加入KCl溶液充分反应后,进行蒸发浓缩、结晶、______ 、洗涤、干燥等操作即得K2SO4晶体;
(3)试分析反应Ⅲ后有K2SO4析出的原因是____________________________ ;
(4)加热MnSO4·H2O固体时第一次质量减少的原因是_______ (用化学方程式表示);
(5)煅烧过程中固体锰元素的质量分数随温度的升高而增大。但当温度超过1000℃时,再冷却后,测得产物中的锰元素的质量分数反而减小。试分析产物中锰元素的质量分数减小的原因:_________________________ 。

【相关资料】(1)含水结晶盐受热时通常先失去结晶水;
(2)图2中物质B就是工业产品Mn3O4 ;
(3)Mn3O4在高温时会被氧化,且锰的化合价从+1到+7变化时逐级升高,如+2的锰先氧化到+3的锰,再从+3氧化到+4分别是对应的氧化物为三氧化二锰和二氧化锰。

【问题解答】
(1)反应II中加入的NH4HCO3中氮元素的化合价为
(2)反应Ⅲ中,向(NH4)2SO4溶液中加入KCl溶液充分反应后,进行蒸发浓缩、结晶、
(3)试分析反应Ⅲ后有K2SO4析出的原因是
(4)加热MnSO4·H2O固体时第一次质量减少的原因是
(5)煅烧过程中固体锰元素的质量分数随温度的升高而增大。但当温度超过1000℃时,再冷却后,测得产物中的锰元素的质量分数反而减小。试分析产物中锰元素的质量分数减小的原因:
您最近一年使用:0次
【推荐1】20℃时,向 50g 水中加入 31.6g 硝酸钾(KNO3)固体并进行如下系列操作,请回答相关问题:

(1)图中烧杯A、C 中的溶液一定是饱和溶液,理由是______ 。
(2)若烧杯 B 中的溶液恰好饱和,则烧杯 C 中剩余固体的质量______ 20g(>,<,=)。
(3)操作 a 可采用的方法是______ 。(答一条即可)
(4)向 B 中恰好饱和的硝酸钾溶液中加入少量高锰酸钾固体,充分搅拌后发现溶液变为紫红色,由此可以得出的结论有______。
(5)实验需要 30g10%的硝酸钾溶液,若用 15%的硝酸钾溶液加水稀释,则需要多少克蒸馏水?(写出具体计算过程)
(6)下列因素会造成上述所配溶液溶质质量分数偏小的是______(填字母序号)。

(1)图中烧杯A、C 中的溶液一定是饱和溶液,理由是
(2)若烧杯 B 中的溶液恰好饱和,则烧杯 C 中剩余固体的质量
(3)操作 a 可采用的方法是
(4)向 B 中恰好饱和的硝酸钾溶液中加入少量高锰酸钾固体,充分搅拌后发现溶液变为紫红色,由此可以得出的结论有______。
| A.一定温度下硝酸钾的饱和溶液还能继续溶解其它物质 |
| B.溶液不一定都是无色的 |
| C.相同条件下,高锰酸钾的溶解能力比硝酸钾的溶解能力强 |
| D.一种溶液中可以有多种溶质 |
(6)下列因素会造成上述所配溶液溶质质量分数偏小的是______(填字母序号)。
| A.量取蒸馏水时仰视读数 |
| B.量取蒸馏水时俯视读数 |
| C.将称量好的 NaCl 固体转移至烧杯时,NaCl 洒落 |
| D.配好的溶液转移到试剂瓶时,部分溶液溅出 |
您最近一年使用:0次
综合应用题
|
较难
(0.4)
【推荐2】海水是一种宝贵的资源。



(1)海水晒盐提取食盐后留下的母液叫卤水,卤水中除含 外还含有
外还含有 、
、 等物质。它们的溶解度曲线如图(1)所示。下列说法正确的是
等物质。它们的溶解度曲线如图(1)所示。下列说法正确的是_________ 。
A:0℃时,三种物质的饱和溶液中,溶质质量分数最大的是
B.三种物质的溶解度都随温度升高而不断增大
C.将卤水加热到80℃以上蒸发水分,逐渐析出的晶体是 和
和
D.20°时向40g 固体和40g
固体和40g 固体中分别加入100g水充分溶解后,两种溶液均能达到饱和状态
固体中分别加入100g水充分溶解后,两种溶液均能达到饱和状态
(2)海上航行缺乏饮用水时可采用图(2)装置获得淡水。用该装置将2000g含氯化钠3%的海水暴晒4小时后,剩余海水中氯化钠的质量分数为4%,则收集到的可饮用水为_________ g。
(3)海水中的硼酸(化学式为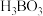 )可用于玻璃业,下表为硼酸的部分溶解度数据。
)可用于玻璃业,下表为硼酸的部分溶解度数据。
①由表可知,硼酸的溶解度随着温度的升高而_________ (填“增大”“减小”或“不变”)。
②60℃时,100g硼酸饱和溶液中含有硼酸_________ g(保留整数)。
③某同学设计如图(3)实验探究“温度”及“固体溶质的形态”对溶解速率的影响。
a.上述三个烧杯中,所得溶液浓度的大小关系是_________ (用“甲”“乙”“丙”表示)
b.若要达到实验目的,需改变实验甲中的一个条件是_________ (填编号)。
A.将20℃的水改为80℃ B.将水的体积改为50mL C.将粉末状固体改为块状
(4)某同学取模拟海水(含 ,
, 、
、 )200g,向溶液中先滴加足量的
)200g,向溶液中先滴加足量的_________ ,充分反应后,过滤,在滤液中滴加10%的硝酸银溶液,其沉淀质量变化如图(4)所示,测得模拟海水中氯元素的质量分数为_________ %(保留三位小数)。



(1)海水晒盐提取食盐后留下的母液叫卤水,卤水中除含
 外还含有
外还含有 、
、 等物质。它们的溶解度曲线如图(1)所示。下列说法正确的是
等物质。它们的溶解度曲线如图(1)所示。下列说法正确的是A:0℃时,三种物质的饱和溶液中,溶质质量分数最大的是

B.三种物质的溶解度都随温度升高而不断增大
C.将卤水加热到80℃以上蒸发水分,逐渐析出的晶体是
 和
和
D.20°时向40g
 固体和40g
固体和40g 固体中分别加入100g水充分溶解后,两种溶液均能达到饱和状态
固体中分别加入100g水充分溶解后,两种溶液均能达到饱和状态(2)海上航行缺乏饮用水时可采用图(2)装置获得淡水。用该装置将2000g含氯化钠3%的海水暴晒4小时后,剩余海水中氯化钠的质量分数为4%,则收集到的可饮用水为
(3)海水中的硼酸(化学式为
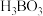 )可用于玻璃业,下表为硼酸的部分溶解度数据。
)可用于玻璃业,下表为硼酸的部分溶解度数据。| 温度/℃ | 0 | 20 | 40 | 60 | 80 |
| 溶解度/(g/100g水) | 3 | 5 | 9 | 15 | 23 |
①由表可知,硼酸的溶解度随着温度的升高而
②60℃时,100g硼酸饱和溶液中含有硼酸
③某同学设计如图(3)实验探究“温度”及“固体溶质的形态”对溶解速率的影响。
a.上述三个烧杯中,所得溶液浓度的大小关系是
b.若要达到实验目的,需改变实验甲中的一个条件是
A.将20℃的水改为80℃ B.将水的体积改为50mL C.将粉末状固体改为块状
(4)某同学取模拟海水(含
 ,
, 、
、 )200g,向溶液中先滴加足量的
)200g,向溶液中先滴加足量的
您最近一年使用:0次
综合应用题
|
较难
(0.4)
名校
解题方法
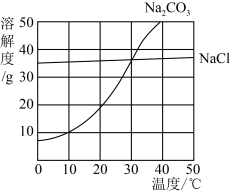
【推荐3】查阅资料得知,纯碱可以由自然界中天然的碱湖中得到。我国青海湖地区的盐湖的湖水中溶有大量的碳酸钠和氯化钠,当地人们习惯“夏天晒盐,冬天捞碱(纯碱)”。如图的氯化钠、碳酸钠(俗称纯碱)在水中的溶解度曲线,试解释“冬天捞碱”的原理: _____ 。
(1)冬天捞得的“碱”中含有少量氯化钠。化学兴趣小组Ⅰ为了测定“碱”样品中碳酸钠的含量,以捞出的碱作为样品,并用下图装置对样品进行分析,根据量瓶中收集到的液体的体积来计算样品中碳酸钠的含量(查阅资料得知:CO2能和碳酸钠溶液反应,但CO2不溶于饱和碳酸氢钠溶液),下列装置中正确的是( )

若实验中酸用的是浓盐酸,对测得的样品中碳酸钠的含量有什么影响(偏大?偏小?还是不变?),并说明理由_____ 。
(2)夏天晒盐中也会含有少量碳酸钠杂质。为了除去杂质,化学兴趣小组Ⅱ最初设计了如下方案并进行试验。
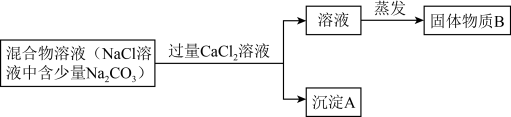
①写出产生沉淀A的化学方程式_____ 。
②在实验过程中,兴趣小组的同学又发现了新问题:此方案很容易引入新的杂质,请写出固体物质B的成分_____ (用化学式表示)。
③兴趣小组的同学讨论后提出新的方案:将混合物溶解,若滴加某溶液(稍过量)至不再产生气体为止,则既能除去Na2CO3杂质,又能有效的防止新杂质的引入。请写出该药品的名称_____ 。
(3) 纯碱在实验室中可以通过NaOH溶液与CO2反应得到。化学兴趣小组Ⅲ在探究过程中发现,将CO2通入NaOH溶液中时并没有观察到明显现象。为了证明反应确实发生了,该小组设计了如下的实验方案:取反应后的溶液,滴加无色酚酞溶液。该方案是否可行_____ ,并说明理由 _____ 。

(1)冬天捞得的“碱”中含有少量氯化钠。化学兴趣小组Ⅰ为了测定“碱”样品中碳酸钠的含量,以捞出的碱作为样品,并用下图装置对样品进行分析,根据量瓶中收集到的液体的体积来计算样品中碳酸钠的含量(查阅资料得知:CO2能和碳酸钠溶液反应,但CO2不溶于饱和碳酸氢钠溶液),下列装置中正确的是

若实验中酸用的是浓盐酸,对测得的样品中碳酸钠的含量有什么影响(偏大?偏小?还是不变?),并说明理由
(2)夏天晒盐中也会含有少量碳酸钠杂质。为了除去杂质,化学兴趣小组Ⅱ最初设计了如下方案并进行试验。

①写出产生沉淀A的化学方程式
②在实验过程中,兴趣小组的同学又发现了新问题:此方案很容易引入新的杂质,请写出固体物质B的成分
③兴趣小组的同学讨论后提出新的方案:将混合物溶解,若滴加某溶液(稍过量)至不再产生气体为止,则既能除去Na2CO3杂质,又能有效的防止新杂质的引入。请写出该药品的名称
(3) 纯碱在实验室中可以通过NaOH溶液与CO2反应得到。化学兴趣小组Ⅲ在探究过程中发现,将CO2通入NaOH溶液中时并没有观察到明显现象。为了证明反应确实发生了,该小组设计了如下的实验方案:取反应后的溶液,滴加无色酚酞溶液。该方案是否可行
您最近一年使用:0次



